ROS/SRC/FAK信号通路在膀胱癌疾病进展中的作用机制研究
2021-09-23罗华荣王天如陈晨黄盛松卞崔冬孙祖俊吴登龙
罗华荣,王天如,陈晨,黄盛松,卞崔冬,孙祖俊,吴登龙
膀胱癌属泌尿系统最常见恶性肿瘤,手术切除是目前首选治疗方法,但部分肿瘤会发生浸润或转移,且经过化疗后易造成化疗耐药性,因此,影响治疗效果[1]。活性氧(reactive oxygen species,ROS)可损坏细胞、抑制肿瘤细胞活性,促进肿瘤细胞死亡,且已验证在膀胱癌中发挥作用[2]。类固醇受体共激活因子(steroid receptor coactivator,SRC)/黏着斑激酶(focal adhesion kinase,FAK)信号通路激活后会形成一个双重的激酶复合物,进而促进细胞运动、细胞生长,在癌细胞中促进细胞生长、增殖和迁移过程[3]。随着研究的深入,发现ROS可作用于SRC/FAK信号通路从而影响相关肿瘤疾病进展,影响病情[4]。因此,现分析癌组织的临床病理因素,并以膀胱癌T24细胞为研究对象,验证诱发膀胱癌疾病进展的原因,报道如下。
1 材料与方法
1.1 材料
1.1.1 癌组织及细胞:收集2019年6月—2020年12月同济大学附属同济医院泌尿外科经膀胱镜活检、膀胱部分切除的膀胱癌组织标本69份,同时取癌旁组织作为对照。肿瘤病理分级(histopathological grading,简称G)根据世界卫生组织分类标准[5],临床分期(tumor node metastasis staging,TNM,简称T)根据国际抗癌联盟分期标准[6],为便于分析,将G1和G2归为分化较好,G3和G4归为分化较差;T0和T1归为非浸润性,T2、T3、T4归为浸润性;其中分化较好59份,分化较差10份;浸润性34份,非浸润性35份。本研究经医院伦理委员会审核批准(审批号:2019-TYH-051),患者及家属均知情同意并签署知情同意书。
膀胱癌T24细胞购自中国科学院典型培养物保藏委员会细胞库,批号 SCSP-536。
1.1.2 试剂与仪器:ROS清除剂N,N'-二甲基硫脲(DMTU,美国Biochem公司生产);SRC激酶抑制剂(PP2,美国Sigma公司生产);RPMI1640培养液、BCA试剂盒、DAB显色试剂、ROS检测试剂盒(江苏凯基生物科技发展有限公司生产);兔抗人SRC一抗、磷酸化SRC(phosphorylation-SRC,p-SRC)一抗、FAK一抗、磷酸化FAK(phosphorylation-FAK,p-FAK)一抗、基质金属蛋白酶9(matrix metalloproteinase 9,MMP-9)一抗、钙蛋白酶2(calcium-activated neutral protease 2,calpain2)一抗、GAPDH一抗、兔抗人二抗(英国Abcam公司生产)。显微镜(上海蔡康光学仪器有限公司,型号 XDS-800C);CO2培养箱(杭州聚同电子有限公司,型号 CHP-01);蛋白凝胶成像仪(上海Tanton公司,型号 5200)。
1.2 膀胱癌T24细胞处理及分组 膀胱癌T24细胞在含10%胎牛血清RPMI1640培养液(添加青霉素、链霉素各1 000 IU/L,完全培养液)中培养,置于5%CO2、37℃培养箱,待细胞密度达90%进行实验。实验细胞分为对照组、DMTU干预组、DMTU+PP2干预组。1×105个/孔细胞置于6孔板中,待细胞密度达80%时,各组细胞更换无血清培养液培养24 h。对照组更换为完全培养液继续培养;DMTU干预组用完全培养液稀释DMTU浓度20 μmol/L处理30 min,再更换为完全培养液培养;DMTU+PP2干预组用完全培养液稀释DMTU浓度20 μmol/L和PP2浓度5 μmol/L共同处理30 min,再更换为完全培养液培养。各组细胞继续培养24 h进行后续实验。
1.3 观察指标与方法
1.3.1 免疫组化检测膀胱癌组织、癌旁组织中SRC、FAK阳性表达:病理组织常规切片后,孵育SRC、FAK一抗,正常兔血清代替一抗作为阴性对照。由2位经验丰富的病理医师对病理组织免疫标记结果分析和计数。染色结果为棕黄色或棕褐色,则判定为阳性;细胞无色或淡黄色,则判定为阴性。
1.3.2 细胞ROS水平检测:收集各组膀胱癌T24细胞,按照ROS检测试剂盒说明书测定各组细胞ROS相对含量。
1.3.3 Transwell实验检测膀胱癌T24细胞迁移、侵袭情况: 收集各组膀胱癌T24细胞,无胎牛血清培养液稀释成1×104个/ml,取500 μl置于Transwell小室上层,下室加500 μl完全培养液,37℃、5% CO2培养箱中培养48 h,去除培养液,甲醇固定后结晶紫染色,拍照后计数每个视野的细胞数量以检测细胞迁移情况,每个小室5个不同视野计数并取平均值为迁移细胞数量。Transwell小室经基质胶包被,其余步骤与迁移步骤相同以检测细胞侵袭情况。
1.3.4 蛋白免疫印迹(WB)检测细胞中SRC、p-SRC、FAK、p-FAK、MMP-9、calpain2蛋白表达: 收集各组膀胱癌T24细胞,蛋白裂解液裂解细胞,4℃离心收集上清,BCA试剂盒测定蛋白总浓度。每孔上样30 ng,聚丙烯酰胺凝胶电泳分离蛋白质,聚偏氟乙烯膜转膜;5%脱脂奶粉室温封闭2 h;对应加入一抗SRC、p-SRC、FAK、p-FAK、MMP-9、calpain2、GAPDH(均为1∶2 000),4℃孵育过夜;对应加入二抗(1∶5 000),室温孵育1 h。DAB显色试剂显色,蛋白凝胶成像仪拍照和定量分析。

2 结 果
2.1 癌旁组织、膀胱癌组织中SRC、FAK阳性表达比较 SRC阳性表达于细胞膜上,FAK阳性表达于细胞浆中,见图1。与癌旁组织比较,膀胱癌组织中SRC、FAK阳性比例升高(P<0.01),见表1。69例膀胱癌患者癌组织中,SRC阳性表达39例(56.52%),FAK阳性表达44例(63.77%)。
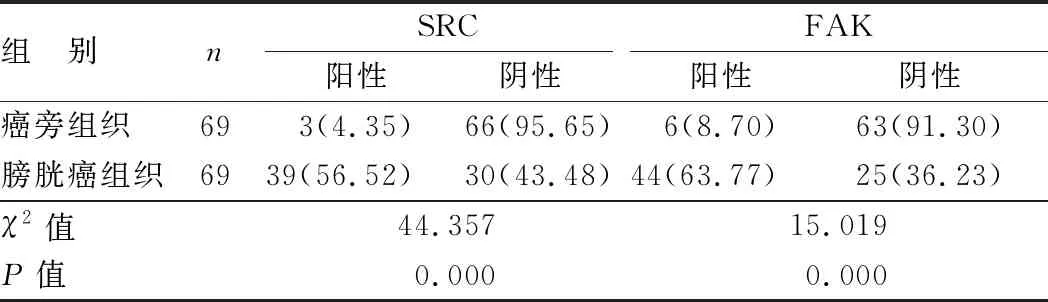
表1 膀胱癌患者癌组织及癌旁组织SRC、FAK阳性表达比较 [例(%)]
2.2 膀胱癌组织SRC、FAK表达阳性率在不同临床病理特征中比较 膀胱癌组织中SRC、FAK表达阳性率在不同分化程度中比较差异无统计学意义(P>0.05),而在浸润性膀胱癌组织中阳性率高于非浸润性癌组织(P<0.05),见表2。
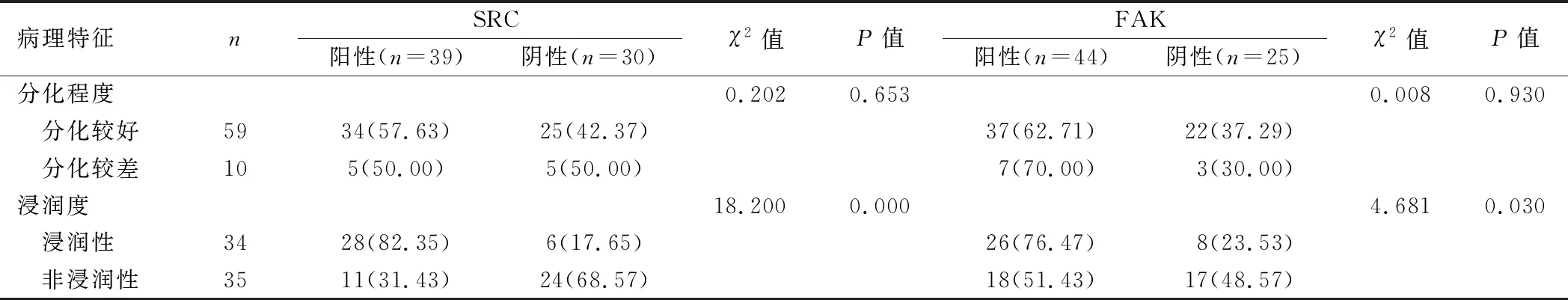
表2 膀胱癌组织SRC、FAK表达阳性率在不同临床病理特征中比较 [例(%)]
2.3 3组膀胱癌T24细胞ROS相对含量比较 与对照组(0.45±0.08)比较,DMTU干预组(0.26±0.04)含量下降;与DMTU干预组比较,DMTU+PP2干预组(0.64±0.03)升高,差异均有统计学意义(F=73.011,P=0.000)。
2.4 3组膀胱癌T24细胞迁移、侵袭比较 与对照组比较,DMTU干预组细胞迁移、侵袭数量升高(P<0.05);与DMTU干预组比较,DMTU+PP2干预组细胞迁移、侵袭数量降低(P<0.05),见图2、表3。
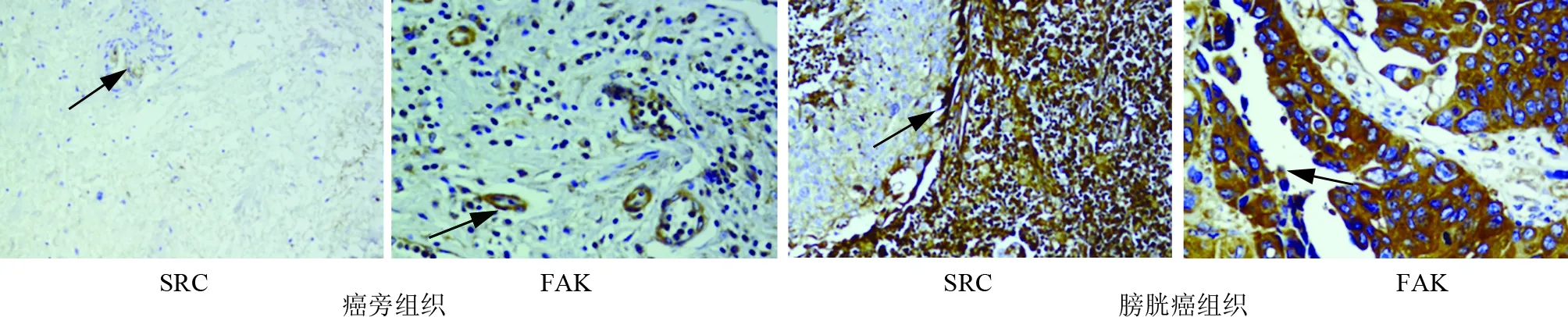
注:SRC.类固醇受体共激活因子;FAK.黏着斑激酶
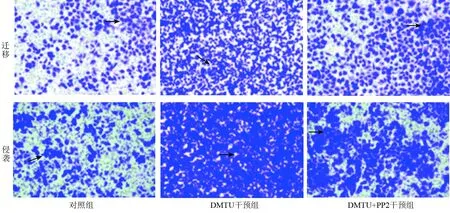
注:DMTU.N,N'-二甲基硫脲;PP2.SRC激酶抑制剂
表3 3组膀胱癌T24细胞迁移、侵袭数量比较个/HP)
2.5 3组膀胱癌T24细胞中SRC、p-SRC、FAK、p-FAK、MMP-9、calpain2蛋白表达比较 与对照组比较,DMTU干预组细胞中p-SRC/SRC、p-FAK/FAK、MMP-9、calpain2蛋白水平升高(P<0.05);与DMTU干预组比较,DMTU+PP2干预组细胞中SRC、p-SRC/SRC、p-FAK/FAK、MMP-9、calpain2蛋白水平降低(P<0.05),见图3、表4。

表4 3组膀胱癌T24细胞中SRC、p-SRC、FAK、p-FAK、MMP-9、calpain2蛋白水平比较
3 讨 论
据统计,中国膀胱癌发病率为8.05/10万,病死率达3.29/10万,难根治、易复发、易耐药、易转移等,导致膀胱癌5年生存率在50%左右[7]。尽管膀胱癌采取多种方法进行治疗,但患者由于自身并发症等原因导致不耐受,影响治疗[8]。发现与膀胱癌有关基因对于及早对应治疗具有至关重要作用。
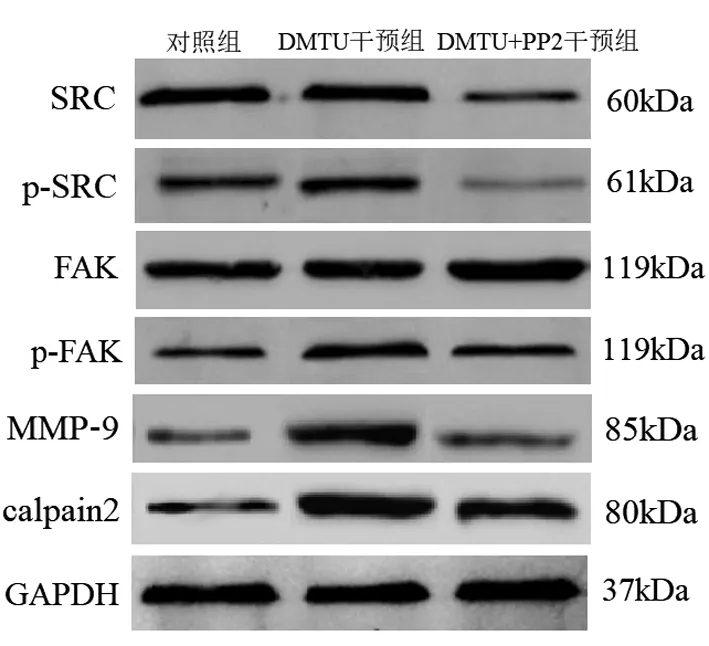
注:DMTU.N,N'-二甲基硫脲;PP2.SRC激酶抑制剂;SRC.类固醇受体共激活因子;p-SRC.磷酸化SRC;FAK.黏着斑激酶;p-FAK.磷酸化FAK;MMP-9.基质金属蛋白酶9;calpain2.钙蛋白酶2;GAPDH.内参基因
本研究发现,膀胱癌细胞中ROS降低,ROS及其所导致的氧化应激一直以来是肿瘤发生、发展及耐药的主要原因,适度ROS可促进肿瘤增殖,过度ROS可促进肿瘤细胞凋亡和坏死[9]。ROS稳定对于维持机体正常生理活动具有重要作用,正常情况下,机体氧化—抗氧化系统处于动态平衡,ROS作为信号因子参与细胞增殖、生长、分化等细胞存活途径[10]。在膀胱癌中ROS生成破坏细胞内氧化还原体系平衡,可引起DNA损伤、促进关键蛋白氧化[11-12]。ROS调控黏附分子的表达和血管形成等过程,影响肿瘤的侵袭和转移[13-14]。降低膀胱癌细胞中ROS水平可能促进黏附分子的表达从而促进细胞迁移、侵袭,进而加重疾病。
本研究发现,在膀胱癌中,SRC、FAK蛋白阳性率升高,且SRC、FAK蛋白阳性表达与癌组织浸润性关系密切。SRC在肿瘤细胞中异常活化,可迅速激活下游信号通路因子磷酸化,通过复杂信号传导影响细胞黏附,进而影响肿瘤的生长和转移[15]。SRC可通过肌动蛋白应力纤维的拆卸、丝足体的组装和黏着斑的共同作用调控细胞的运动[16];其是肿瘤获得迁移潜能的核心分子,可促进多种蛋白表达进而促进肿瘤的迁移、侵袭[17]。FAK是内源性蛋白酪氨酸激酶激活的主要底物,与肿瘤细胞黏附、增殖、迁移、侵袭等过程密切相关[18]。SRC通过其SH2结构域与FAK的Tyr397自动磷酸化位点直接结合形成FAK-SRC复合物,进而向胞内传递信号,促使细胞增殖、迁移、侵袭[19]。SRC、FAK蛋白水平升高可能促进肿瘤细胞侵袭、迁移过程,促进癌细胞浸润,促使疾病发生。清除ROS后细胞SRC、FAK磷酸化水平升高,促进侵袭、迁移相关蛋白MMP-9、calpain2蛋白表达,而FAK可以直接刺激MMP-9的分泌,参与膀胱间质成分的代谢,参与血管新生、影响细胞黏附作用从而影响肿瘤迁移、侵袭[20]。calpain2与FAK蛋白进行剪切进而影响FAK活性,从而改变细胞局部的黏附能力,可能是调控细胞迁移的机制之一[21-22]。提示降低ROS水平可促进SRC的表达及其磷酸化水平,从而与FAK结合进入细胞内促进MMP-9等基因的表达,进而促进细胞的侵袭、迁移,肿瘤浸润从而影响疾病。抑制SRC表达可抑制上述过程。
综上所述,在膀胱癌细胞中抑制ROS可促进SRC/FAK信号通路进而促进细胞迁移、侵袭过程,使肿瘤浸润诱导疾病。SRC/FAK信号通路亦影响细胞凋亡等过程进而影响肿瘤进展,是以后研究的重点。
利益冲突:所有作者声明无利益冲突
作者贡献声明
罗华荣:设计研究方案,实施研究过程,论文撰写;王天如、陈晨:提出研究思路,分析试验数据,论文审核;黄盛松、卞崔冬:实施研究过程,资料搜集整理,论文修改;孙祖俊:进行统计学分析;吴登龙:课题设计,论文撰写
