β-细辛醚激活PINK1/Parkin介导的线粒体自噬改善 APP/PS1小鼠认知和记忆功能障碍的研究
2021-09-22王南卜王志芳韩玉凤康健方永奇李翎
王南卜 王志芳 韩玉凤 康健 方永奇 李翎

〔摘要〕 目的 探討β-细辛醚对淀粉样前体蛋白(APP)/早老素1(PS1)小鼠的作用机制及对PINK1/Parkin介导的线粒体自噬的影响。方法 将APP/PS1小鼠随机分为模型组、β-细辛醚低、中、高剂量组(15、30、45 mg/kg)、多奈哌齐组(1 mg/kg)、雷帕霉素组(4 mg/kg)、3-甲基腺嘌呤(3-MA)组(4 mg/kg)、环孢霉素A组(10 mg/kg),另设正常组,每组10只。各组灌胃给药,模型组和正常组用等体积蒸馏水代替,1次/d,给药30 d。观察各组小鼠水迷宫实验,蛋白质印迹法检测小鼠海马中APP、PS1、神经突触素1(SYN1)、β-位点淀粉样前体蛋白裂解酶1(BACE1)、LC3 I/II、Beclin-1、p62、PINK1、Parkin和p-Parkin蛋白表达水平;反转录聚合酶链反应检测APP、PS1、BACE1、LC3B、Beclin-1、p62和Parkin mRNA表达水平。结果 与模型组相比,β-细辛醚高剂量组、β-细辛醚中剂量组和多奈哌齐组APP/PS1小鼠的逃避潜伏期缩短(P<0.05或P<0.01),小鼠海马内APP、PS1、BACE1的表达下降(P<0.01),SYN1表达上升(P<0.05或P<0.01);与模型组相比,β-细辛醚中剂量组APP/PS1小鼠内Beclin-1、LC3B表达均升高(P<0.05或P<0.01),p62表达下降(P<0.05);与模型组相比,雷帕霉素组Beclin-1、LC3B表达均升高(P<0.05或P<0.01),p62表达下降(P<0.01);与模型组相比,3-MA组p62表达升高(P<0.05);与模型组相比,β-细辛醚中剂量组APP/PS1小鼠内PINK1、p-Parkin表达均显著升高(P<0.01)。结论 β-细辛醚通过激活PINK1-Parkin介导的线粒体自噬而影响阿尔茨海默病病理,这为应用β-细辛醚治疗阿尔茨海默病提供了新的靶点。
〔关键词〕 阿尔茨海默病;β-细辛醚;线粒体自噬;PINK1;Parkin;淀粉样前体蛋白;早老素1;神经突触素1
〔中图分类号〕R277.7 〔文献标志码〕B 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.08.008
β-Asarone Improves Cognitive and Memory Impairment in APP/PS1 Mice by Activating
PINK1/Parkin Mediated Mitochondrial Autophagy
WANG Nanbu1, WANG Zhifang2, HAN Yufeng2, KANG Jian2, FANG Yongqi1, LI Ling1*
(1. The First Affiliated Hospital of Guangzhou University of Chinese Medicine, Guangzhou, Guangdong 510405, China;
2. Guangzhou University of Chinese Medicine, Guangzhou, Guangdong 510006, China)
〔Abstract〕 Objective To explore the mechanism of β-asarone on APP/PS1 mice and its effect on the mitochondrial autophagy mediated by PINK1/Parkin. Methods APP/PS1 mice were randomly divided into model group, low/medium/high dose groups (15, 30, 45 mg/kg) of β-asarone, donepezil group (1 mg/kg), rapamycin group (4 mg/kg), 3-methyladenine (3-MA) group (4 mg/kg), cyclosporine A (CsA) group (10 mg/kg) and normal group, with 10 mice in each group. Each group was given intragastric administration, and model group and normal group were given equal volume distilled water once a day for 30 days. Water maze test was observed in each group. Amyloid precursor protein (APP), prosenoxin 1 (PS1), synaptophysin 1 (SYN1), β-site amyloid precursor protein lyase 1 (BACE1) and LC3I/II, Beclin-1, p62, PINK1, Parkin and p-Parkin were detected in the hippocampus of mice by western blot. The mRNA expression levels of APP, PS1, BACE1, LC3B, Beclin-1, P62 and Parkin were detected by reverse transcription polymerase chain reaction. Results Compared with the model group, the escape latency of APP/PS1 mice in β-asarone high dose group, β-asarone medium dose group and donepezil group was significantly shortened (P<0.05 or P<0.01), the expression of APP, PS1 and BACE1 in hippocampus of mice decreased (P<0.01), and the expression of SYN1 increased (P<0.05 or P<0.01); compared with the model group, the expression of Beclin-1 and LC3B in β-asarone medium dose group increased (P<0.01 or P<0.05), and the expression of p62 decreased (P<0.05); compared with the model group, the expression of Beclin-1 and LC3B in rapamycin group increased (P<0.05 or P<0.01), and the expression of p62 decreased (P<0.01); the expression of p62 in 3-MA group was higher than that model group (P<0.05); compared with the model group, the expression levels of PINK1 and p-Parkin in APP/PS1 mice in β-asarone medium dose group were significantly increased (P<0.01). Conclusion β-asarone may affect Alzheimer's Disease (AD) pathology by activating mitochondrial autophagy mediated by PINK1-Parkin, which provides a new target for the treatment of AD with β-asarone.
〔Keywords〕 Alzheimer's disease; β-asarone; mitochondrial autophagy; PINK1; Parkin; amyloid precursor protein; prosenoxin 1; synaptophysin 1
阿尔茨海默病(Alzheimer's disease, AD)是以进行性认知功能障碍和记忆损害为主要临床表现的慢性神经退行性疾病,我国2015至2018年AD合并患病率为6.6%[1]。根据发病机制的研究进展,针对AD的新药物开发主要着眼于抑制β-淀粉样蛋白(β-amyloid protein, Aβ)的异常聚集、减少Tau蛋白过度磷酸化来改善AD患者的学习和记忆功能[2]。然而,目前在世界范围内用于治疗AD的一线药物仍以乙酰胆碱酯酶抑制剂和N-甲基-D-天冬氨酸受体拮抗剂为主,食品药品监督管理局自2003年以来未批准任何新药[3]。因此,对AD的治疗方案尚不成熟,仍需要不断探索和开发新的治疗药物以满足临床的需要。
AD属中医学的“中风”“痴呆”范畴[4],其主要病机以本虚为主,气血虚损致病理产物生成,以痰瘀阻窍为标,在治疗方面,多用补益药配伍活血、化痰、醒脑开窍药等。石菖蒲具有芳香走窜、开窍醒神的药性,其主要有效成分β-细辛醚分子量小,脂溶性强,在体内吸收和分布较快的特点[5],能快速通过血脑屏障,在脑组织内分布广泛[6-7]。并且β-细辛醚对神经退行性疾病、神经系统肿瘤,以及抑郁症、脑梗死等都有一定的治疗效果,所以,β-细辛醚具有很好的开发成AD治疗新药物的前景。
本文以APP/PS1双转基因小鼠为动物模型,以多奈哌齐作为阳性对照药,设置β-细辛醚低、中、高剂量组,通过观察小鼠的水迷宫实验、避暗实验和跳台实验结果判断β-细辛醚对APP/PS1小鼠学习和记忆能力是否具有改善作用;采用蛋白质印迹法(Western blot, WB)测定AD小鼠海马中淀粉样前體蛋白(amyloid precursor protein, APP)、早老素1(presenilin 1, PS1)、神经突触素1(synapsin 1, SYN1)、β-位点淀粉样前体蛋白裂解酶1(β-site amyloid precursor protein cleaving enzyme 1, BACE1)的表达和反转录聚合酶链反应(reverse transcription polymerase
chain reaction, RT-PCR)检测相关基因APP、PS1、BACE1 mRNA的表达,证明β-细辛醚是否通过影响APP/PS1小鼠海马内APP、PS1、SYN1和BACE1的基因表达和蛋白质合成起到治疗作用。以自噬激活剂雷帕霉素和自噬抑制剂3-甲基腺嘌呤(3-methyladenine, 3-MA)作为自噬研究的双向对照药,通过检测小鼠海马内LC3I/II、Beclin-1和p62的蛋白表达水平以及LC3II、Beclin-1和p62 mRNA表达水平,进一步研究β-细辛醚对自噬功能的影响。以线粒体自噬抑制剂环孢霉素A(cyclosporin A, CsA)[8]为PINK1/Parkin信号通路抑制剂为阴性药,检测小鼠海马PINK1、Parkin和p-Parkin蛋白表达水平以及Parkin mRNA表达水平,研究β-细辛醚对该信号通路是否具有调控作用。
1 材料
1.1 实验动物
实验小鼠由江苏集萃药康生物科技有限公司提供,合格证号:SCXK(苏)2018-0008,其中:B6C3-Tg(APPswe, PSEN1dE9)85Dbo/J品系的双转基因小鼠,SPF级,80只,雌雄各半,体质量(20±2) g,3月龄;B6C3-Tg(APPswe, PSEN1dE9)85Dbo/J品系阴性小鼠,SPF级,10只,雌雄各半,体质量(20±2) g,3月龄。于广州中医药大学第一附属医院实验中心进行实验,实验单位使用许可证号:SYXK(粤)2018-0092。实验前先将动物适应性饲养7 d,期间自由饮水、进食标准小鼠饲料;室内适度通风,光照12 h,室温(23±2) ℃,湿度(55±5)%。
1.2 主要药物与试剂
β-细辛醚由本实验中心自制。石菖蒲饮片购自广州中医药大学第一附属医院,批号:171401。按照《中华人民共和国药典》中挥发油提取法[9],从石菖蒲饮片中提取挥发油,进行冷冻结晶,得到β-细辛醚,经光谱(GC/MS,NMR,IR)检测,证实β-细辛醚纯度为99.55%。盐酸多奈哌齐片(中国卫材药业有限公司,批号:1703054);环孢素A(广州中医药大学第一附属医院,批号:1703054);雷帕霉素(美国Selleck Chemicals公司,批号:S1039);3-MA(美国Sigma公司,批号:M9281);水合氯醛(天津大茂化学试剂厂,批号:302-17-0);吐温20(上海晶纯生化科技股份有限公司,批号:A1318030);二甲基亚砜(dimethyl sulfoxide, DMSO)(安徽Biosharp公司,批号:D-5879);Anti-APP-1抗体(英国Abcam公司,批号:ab220832);Anti-PS1抗体(英国Abcam公司,批号:ab15456);Anti-SYN1抗体(英国Abcam公司,批号:ab194778);Anti-BACE1抗体(英国Abcam公司,批号:ab183612);Anti-Actin antibody(英国Abcam公司,货号:ab179467);Anti-beta Amyloid抗体(英国Abcam公司,批号:ab134022);2×预混实时荧光定量快速PCR反应体系(含ROX II)(北京康润诚业生物科技有限公司,批号:A304-10);Evo M-MLV反转录试剂盒(湖南艾科瑞生物工程有限公司,批号:AG11705);氯仿(广州化学试剂厂,批号:31004)。
1.3 主要仪器
Morris小鼠水迷宫仪(型号:XR-XM101,上海欣软信息科技有限公司);小鼠避暗仪(型号:SBA-2,中国医药科学院药物研究所);跳台仪(型号:YLS-3TB,济南益延科技发展有限公司);电子分析天平(型号:AE-200,上海梅特勒-托利多仪器有限公司);低温高速离心机(型号:3K30,美国Bio-Rad公司);Tetra System(型号:Mini-PROTEAN,美国Sigma公司);酶标仪(型号:Multiskan MK3,美国Thermo scientific公司);BioRad成像仪(型号:ChemiDoc XRS+System,美国Bio-Rad公司);梯度PCR扩增仪(型号:ABI ProFlex,美国Applied Biosystems公司);Real-Time PCR仪(型号:CFX96TM,美国Applied Biosystems公司)。
2 方法
2.1 实验分组与剂量
将80只APP/PS1双转基因小鼠随机分为8组,雌雄各半,每组10只,即模型组、β-细辛醚低剂量组(15 mg/kg)、β-细辛醚中剂量组(30 mg/kg)、β-细辛醚高剂量组(45 mg/kg)、多奈哌齐组(1 mg/kg)、雷帕霉素组(4 mg/kg)、3-MA组(4 mg/kg)、CsA组(10 mg/kg)。另设正常组,B6C3-Tg(APPswe, PSE?N1dE9)85Dbo/J品系阴性小鼠10只,雌雄各半。各组灌胃给药,模型组和正常组用等体积蒸馏水代替,1次/d,给药30 d。
2.2 药物配制
以0.1%吐温生理盐水溶解β-细辛醚晶体,高、中、低浓度剂量组分别配置成0.15、0.30、0.45 mg/mL,给药剂量按照人和动物给药换算公式及前期实验经验进行设置[10];盐酸多奈哌齐片捣碎,溶于生理盐水中,配制成浓度为0.06 mg/mL的水溶液。雷帕霉素和3-MA以0.02% DMSO溶解粉剂成浓度为0.04 mg/mL;环孢素A软胶囊用0.02% DMSO及生理盐水充分溶解成浓度为0.1 mg/mL,以上药物均超声水浴溶解至无沉淀,存于4 ℃冰箱备用。
2.3 水迷宮实验
在水迷宫内设有4个盲端,在水迷宫的终端装有平台,高出水面,小鼠游到平台时代表游泳结束。给药第28天后,各组小鼠每只依次在水迷宫内进行训练,连续训练4 d,每天依次训练取得1、2、3、4个盲端,再游完全程,其中设定总时间为5 min,超过5 min不能游出者,按5 min计。给药第20天后,把训练好的小鼠进行正式水迷宫实验,观察记录小鼠5 min内游泳到平台所用时间(s)(逃避潜伏期),超过5 min不能游出者,按5 min计[11-12]。
2.4 取材
水迷宫实验结束后,各组小鼠禁食禁水24 h,用0.1 g/mL水合氯醛,根据体质量按照0.35 g/kg进行腹腔注射麻醉,剪开胸部,暴露心脏,50 mL注射器抽取一定量生理盐水进行心脏灌注(从左心室推进,剪开右心耳排血)。观察到小鼠双肺变白,随即分离头部,在冰上迅速取出大脑,分离海马于-80 ℃冷冻待测。
2.5 指标检测
2.5.1 WB检测APP/PS1小鼠海马组织内APP、PS1、SYN1、BACE1蛋白表达水平 取各组小鼠海马组织加裂解液冷冻匀浆后,离心(13 000 g,4 ℃)10 min,上清液经BCA法检测蛋白浓度后配平。上样量为20 μL,电泳条件为80 V 20 min,然后100 V 50 min,湿法转膜,条件200 mA 90 min,APP、PS1、SYN1、BACE1抗体和内参抗体稀释比例分别为1∶1 000、1∶1 000、1∶1 000、1∶1 000和1∶10 000,二抗浓度是1∶10 000,其他方法步骤按常规WB进行,用ECL试剂盒在化学发光检测器中检测,用Image-pro进行分析。
2.5.2 RT-PCR检测APP/PS1小鼠内Beclin-1、p62、
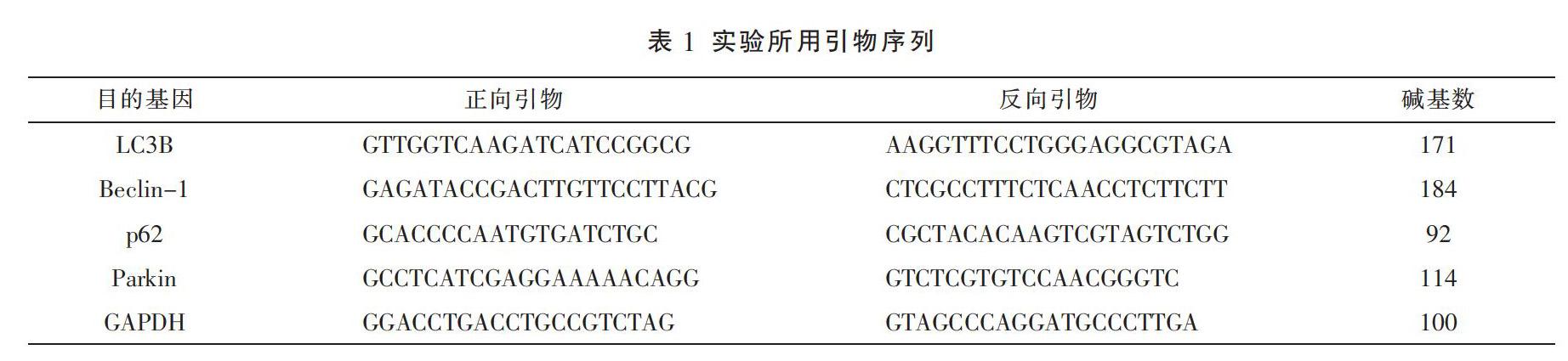
LC3B mRNA表达水平 取小鼠海马组织,根据PCR试剂盒操作步骤,提取总RNA后逆转录为DNA,最后进行RT-PCR,实验结束后,结果在Bio-rad CFX Manager中分析,实验引物序列见表1。
2.6 统计方法
各组数据用Graph Prism 8.0统计软件,数据用“x±s”表示,多组间比较采用单因素方差分析,用One-Way ANOVA进行两两比较,若方差齐则采用Bonferrioni法,若方差不齐则采用Tambanes T2法。以P<0.05为差异有统计学意义。
3 结果
3.1 β-细辛醚对AD模型小鼠的影响
3.1.1 行为学结果 与正常组对比,模型组APP/PS1小鼠的逃避潜伏期延长(P<0.01)。与模型组对比,β-细辛醚高剂量组、β-细辛醚中剂量组和多奈哌齐组APP/PS1小鼠的逃避潜伏期缩短(P<0.05或P<0.01)。见图1。
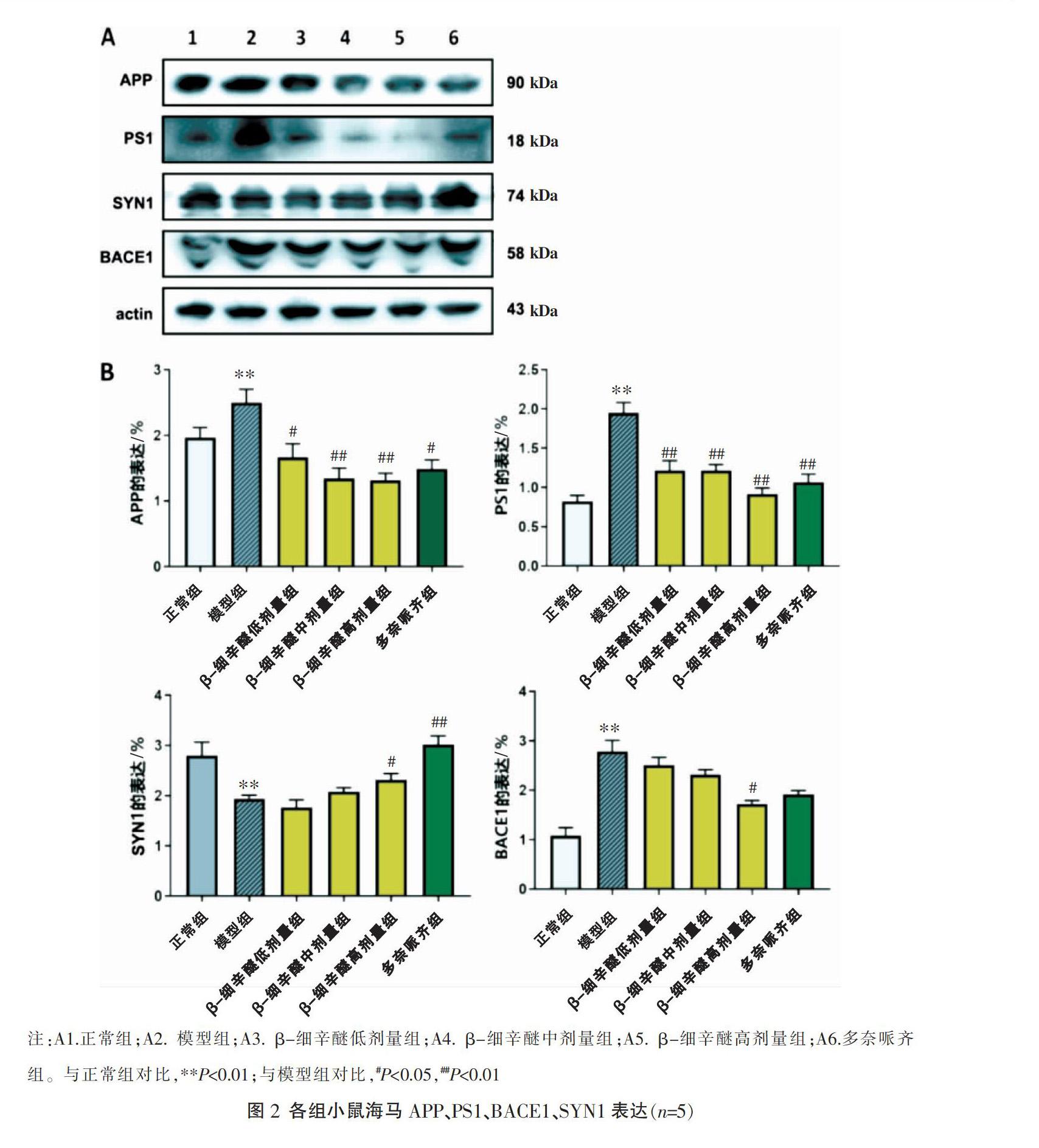
3.1.2 β-细辛醚对APP/PS1小鼠海马内APP、PS1、BACE1、SYN1蛋白表达的影响 与正常组对比,模型组APP/PS1小鼠内APP、PS1、BACE1表达显著升高,SYN1表达显著降低(P<0.01)。与模型组对比,β-细辛醚低剂量组、β-细辛醚中剂量组、β-细辛醚高剂量组、多奈哌齐组APP/PS1小鼠内APP、PS1表达降低(P<0.01)。与模型组对比,β-细辛醚高剂量组、多奈哌齐组APP/PS1小鼠内SYN1表达升高(P<0.05或P<0.01)。与模型组对比,β-细辛醚高剂量组APP/PS1小鼠内BACE1表达下降(P<0.05)。见图2。3.1.3 β-细辛醚对APP/PS1小鼠海马内APP、PS1、BACE1 mRNA表达的影响 与正常组对比,模型组APP/PS1小鼠内APP、PS1、BACE1 mRNA表达升高,差异均有统计学意义(P<0.01)。与模型组对比,β-细辛醚低剂量组、β-细辛醚中剂量组、β-细辛醚高剂量组、多奈哌齐组APP/PS1小鼠内APP mRNA表达降低(P<0.05或P<0.01)。与模型组对比,β-细辛醚中剂量组、β-细辛醚高剂量组、多奈哌齐组APP/PS1小鼠内PS1 mRNA表达降低(P<0.05或P<0.01)。与模型组对比,β-细辛醚高剂量组APP/PS1小鼠内BACE1表达降低(P<0.01)。见图3。
3.2 β-细辛醚对AD模型小鼠海马体内自噬的影响
3.2.1 β-细辛醚对APP/PS1小鼠海马内LC3 I/II、Beclin-1、p62蛋白表达的影响 与正常组对比,模型组APP/PS1小鼠内LC3 I/II、Beclin-1表达下降(P<0.05或P<0.01),p62表达升高(P<0.05)。与模型组对比,β-细辛醚中剂量组APP/PS1小鼠内LC3 I/II、Beclin-1表达均升高(P<0.05或P<0.01);3-MA组APP/PS1小鼠内LC3 I/II、Beclin-1表达均下降(P<0.01);雷帕霉素组LC3 I/II、Beclin-1表达均升高(P<0.01),p62表达下降(P<0.001)。见图4。
3.2.2 β-细辛醚对APP/PS1小鼠海马内LC3B、Beclin-1、p62 mRNA表达的影响 与正常组对比,模型组APP/PS1小鼠内Beclin-1、LC3B mRNA表达下降(P<0.05或P<0.01),p62 mRNA表达升高(P<0.01)。与模型组对比,β-细辛醚中剂量组APP/PS1小鼠内Beclin-1、LC3B mRNA表达均升高(P<0.05或P<0.01),p62 mRNA表达下降(P<0.05)。与模型组对比,雷帕霉素组Beclin-1、LC3B mRNA表达均升高(P<0.01或P<0.05),p62 mRNA表达下降(P<0.01);3-MA组p62 mRNA表达下降(P<0.05)。见图5。
3.3 β-细辛醚介导AD模型小鼠海马体内PINK1/Parkin通路的变化
3.3.1 β-细辛醚对APP/PS1小鼠内PINK1、Parkin、p-Parkin蛋白表达的影响 与正常组对比,模型组APP/PS1小鼠内PINK1、Parkin、p-Parkin蛋白表达均下降(P<0.05或P<0.01)。与模型组对比,β-细辛醚中剂量组APP/PS1小鼠内PINK1、p-Parkin蛋白表达均显著升高(P<0.01)。见图6。
3.3.2 β-细辛醚对ADAPP/PS1小鼠内Parkin mRNA表达的影响 与正常组对比,模型组APP/PS1小鼠内Parkin mRNA表达下降(P<0.01)。与模型组对比,β-细辛醚中剂量组APP/PS1小鼠内Parkin mRNA表达升高(P<0.01)。见图7。
4 讨论
AD的主要病理特征是Aβ的细胞外沉积、神经元纤维缠结和广泛神经元缺失[13-14]。研究[15]表明,自噬与APP的代谢、Aβ的形成关系密切。在健康人的大脑中,APP主要通过β-分泌酶进行代谢,而在AD患者的大脑中则普遍发生α-分泌酶减少、β-分泌酶增加或活性增强[16]而引起APP代谢异常。β-分泌酶主要包括BACE1和BACE2,既往动物实验[17]和细胞实验[18]都表明,BACE1的降低可以减少Aβ生成,但针对此机制的药物的研发并不顺利。一项全球多中心双盲临床研究[19]表明,在早期和轻度AD患者中,拉那司他的BACE1抑制剂与安慰剂相比,未体现出改善AD患者认知功能下降、延缓病情进展的效果。由于BACE2在神经系统中分布较少、缺乏代表性,本研究采用BACE1作为评价β-细辛醚药效作用的指标之一。动物实验[20]提示,SYN1对APP/PS1小鼠脑内Aβ斑块的形成具有抑制作用。本研究利用双转基因小鼠朊病毒蛋白因子能启动突变的PS1和APP基因,以模拟人类AD发病过程的APP/PS1小鼠作为研究对象,给予相应的药物治疗。研究结果提示,与正常组对比,模型组小鼠的水迷宫实验中模型组APP/PS1小鼠的逃避潜伏期延长,海马内APP、PS1、BACE1表达升高,SYN1表达的降低(P<0.01),提示APP/PS1小鼠處于AD的状态,神经突触在造模后明显受损,且该表型不会随着时间推移出现改善症状。与模型组相比,多奈哌齐组和β-细辛醚低、高剂量组APP/PS1小鼠的逃避潜伏期缩短(P<0.05或P<0.01),表明多奈哌齐和β-细辛醚都能改善小鼠的学习和记忆能力。与模型组对比,高剂量β-细辛醚可提高海马内SYN1表达,降低APP、PS1、BACE1表达(P<0.05或P<0.01),提示β-细辛醚可能通过抑制AD海马内APP的异常表达和β-分泌酶的异常增高,保护APP/PS1小鼠神经突触功能起到治疗AD的作用。
自噬在神经退行性疾病的病程中起延缓疾病进程或加速疾病进程的双向作用[21],自噬系统功能紊乱会导致细胞内异常蛋白沉积,与AD的Aβ积聚关系密切[22]。APP是自噬性降解的底物,自噬小体可能是APP产生的场所[23]。Tau蛋白的主要清除途径包括自噬-溶酶体系统[24],可见自噬功能变化会对AD的病理过程产生影响。而细胞内Aβ的过度积累可能会损害自噬清除,从而增加AD损伤的神经元内自噬功能损伤。AD患者的大脑中表现出独特的Aβ相关自噬病理:自噬泡(autophagic vacuoles, AVs)大量积聚在营养不良性神经突内,Aβ与AD大脑中的LE或多囊泡和AVs相关。促进Aβ螯合可减少细胞内和细胞外Aβ,而抑制自噬体成熟和溶酶体水解,却能增加细胞内Aβ并降低细胞外Aβ[25]。根据β-细辛醚对小鼠逃避潜伏期和脑内APP、PS1、BACE1、SYN1的变化结果,选取改善最明显的β-细辛醚中剂量组进行机制研究。本研究结果表明,β-细辛醚中剂量能升高APP/PS1小鼠海马内LC3 I/II、Beclin-1并降低p62表达(P<0.05或P<0.01),作用与雷帕霉素相似,能够促进自噬的发生。
作为选择性自噬的一种,线粒体相关的自噬同样贯穿AD的发病及疾病全程。线粒体是参与细胞能量合成代谢的重要细胞器。AD病患者表现出线粒体功能受损和线粒体清除缺陷的过程,如氧化磷酸化和腺苷三磷酸(adenosine triphosphate, ATP)产生減少,显著增加氧化应激并破坏抗氧化防御系统。ATP是细胞正常生命活动所需能量的直接来源,而线粒体产生ATP,可以维持自身稳态和神经元的正常生存[26]。在AD患者中,Aβ异常增多影响线粒体正常功能,其沉积也会阻碍受损线粒体的自我清除,线粒体功能障碍在AD发病中起着重要作用。PINK1/Parkin通路是一条具有调节哺乳动物中线粒体的自噬途径,其作用方式为通过泛素化Parkin以激活自噬[27]。PINK1为线粒体受损的主要探测器,当线粒体受损时,PINK1在线粒体外膜磷酸化Parkin将其从细胞质内募集至受损线粒体,进而磷酸化胞浆中的E3泛素蛋白连接酶Parkin诱导其从细胞质内向受损的线粒体外膜上募集[28],介导p62聚集物被VDAC1激活,启动线粒体清除的过程[29],而在大脑中逐渐减少的Parkin能够反映出增强的线粒体自噬功能的损伤[30-31]。本研究中β-细辛醚对PINK1/Parkin信号通路的作用结果提示,模型组和CsA组PINK1和Parkin的表达均受抑制(P<0.05或P<0.01)。此外,与模型组相比,β-细辛醚中剂量组中的PINK1和Parkin水平升高(P<0.01),提示β-细辛醚可能通过激活PINK1/Parkin通路改善AD病程中的自噬损伤,促进AD鼠自噬功能,这可能是β-细辛醚对APP/PS1小鼠治疗作用的机制之一。
综上所述,β-细辛醚调节PINK1/Parkin介导的线粒体自噬改善APP/PS1小鼠AD症状。本研究结果证明,β-细辛醚可能通过激活PINK1/Parkin信号通路,促进线粒体自噬,修复受损突触功能,这可能为应用β-细辛醚治疗AD提供了新的靶点。
参考文献
[1] DOMBI E, MORTIBOYS H, POULTON J. Modulating mitophagy in mitochondrial disease[J]. Current Medicinal Chemistry, 2018, 25(40): 5597-5612.
[2] HARRISON J R, OWEN M J. Alzheimer's disease: The amyloid hypothesis on trial[J]. The British Journal of Psychiatry, 2016, 208(1): 1-3.
[3] JOE E, RINGMAN J M. Cognitive symptoms of Alzheimer's disease: Clinical management and prevention[J]. British Medical Journal, 2019, 367: l6217.
[4] 谢 乐,伍大华,曹思佳,等.滋肾活血方通过PINK1/Parkin信号通路增加自噬对血管性痴呆大鼠的影响[J].湖南中医药大学学报,2020,40(9):1082-1085.
[5] FANG Y Q, SHI C, LIU L, et al. Analysis of transformation and excretion of β-asarone in rabbits with GC-MS[J]. European Journal of Drug Metabolism and Pharmacokinetics, 2012, 37(3): 187-190.
[6] LIU L,FANG Y Q. Analysis of the distribution of β-asarone in rat hippocampus, brainstem, cortex and cerebellum with gas chromatography-mass spectrometry(GC-MS)[J]. Journal of Medicinal Plants Research,2011, 5(9): 1728.
[7] FANG Y Q, SHI C, LIU L, et al. Pharmacokinetics of beta-asarone in rabbit blood, hippocampus, cortex, brain stem, thalamus and cerebellum[J]. Die Pharmazie, 2012, 67(2): 120-123.
[8] GUO T, LIU T Y, SUN Y, et al. Sonodynamic therapy inhibits palmitate-induced beta cell dysfunction via PINK1/Parkin-dependent mitophagy[J]. Cell Death & Disease, 2019, 10(6): 457.
[9] 国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2010:173.
[10] HAN Y F, WANG N B, KANG J, et al. β-Asarone improves learning and memory in Aβ1-42-induced Alzheimer's disease rats by regulating PINK1-Parkin-mediated mitophagy[J]. Metabolic Brain Disease, 2020, 35(7): 1109-1117.
[11] BROMLEY-BRITS K, DENG Y, SONG W H. Morris water maze test for learning and memory deficits in Alzheimer's disease
model mice[J]. Journal of Visualized Experiments, 2011(53): 2920.
[12] MAJKUTEWICZ I, KUROWSKA E, PODLACHA M, et al. Dimethyl fumarate attenuates intracerebroventricular streptozotocin-induced spatial memory impairment and hippocampal neu?
rodegeneration in rats[J]. Behavioural Brain Research, 2016, 308: 24-37.
[13] SOEJITNO A, TJAN A, PURWATA T E. Alzheimer's disease: Les?
sons learned from amyloidocentric clinical trials[J]. Central Nervous System Drugs, 2015, 29(6): 487-502.
[14] FUJIKAKE N, SHIN M, SHIMIZU S. Association between autophagy and neurodegenerative diseases[J]. Frontiers in Neuroscience, 2018, 12: 255.
[15] NILSSON P, LOGANATHAN K, SEKIGUCHI M, et al. Aβ secretion and plaque formation depend on autophagy[J]. Cell Reports, 2013, 5(1): 61-69.
[16] KANG M J, ABDELMOHSEN K, HUTCHISON E R, et al. HuD regulates coding and noncoding RNA to induce APP→Aβ processing[J]. Cell Reports, 2014, 7(5): 1401-1409.
[17] BAHN G, PARK J S, YUN U J, et al. NRF2/ARE pathway nega?
tively regulates BACE1 expression and ameliorates cognitive deficits in mouse Alzheimers models[J]. Proceedings of the National Academy of Sciences of the United States of America, 2019, 116(25): 12516-12523.
[18] JANITSCHKE D, NELKE C, LAUER A A, et al. Effect of caffeine and other methylxanthines on Aβ-homeostasis in SH-SY5Y cells[J]. Biomolecules, 2019, 9(11): E689.
[19] WESSELS A M, TARIOT P N, ZIMMER J A, et al. Efficacy and safety of lanabecestat for treatment of early and mild alzheimer disease: The AMARANTH and DAYBREAK-ALZ randomized clinical trials[J]. The Journal of the American Medical Association Neurology, 2020, 77(2): 199-209.
[20] BACHHUBER T, KATZMARSKI N, MCCARTER J F, et al. Inhibition of amyloid-β plaque formation by α-synuclein[J]. Nature Medicine, 2015, 21(7): 802-807.
[21] KIZILARSLANO?LU M C, üLGER Z. Role of autophagy in the pathogenesis of Alzheimer disease[J]. Turkish Journal of Medical Sciences, 2015, 45(5): 998-1003.
[22] ZHU J H, HORBINSKI C, GUO F L, et al. Regulation of autophagy by extracellular signal-regulated protein kinases during 1-methyl-4-phenylpyridinium-induced cell death[J]. The American Journal of Pathology, 2007, 170(1): 75-86.
[23] LEONG Y Q, NG K Y, CHYE S M, et al. Mechanisms of action of amyloid-beta and its precursor protein in neuronal cell death[J]. Metabolic Brain Disease, 2020, 35(1): 11-30.
[24] TANG M P, HARRISON J, DEATON C A, et al. Tau clearance mechanisms[J]. Advances in Experimental Medicine and Biology, 2019, 1184: 57-68.
[25] HAN K, KIM S H, CHOI M. Computational modeling of the effects of autophagy on amyloid-β peptide levels[J]. Theoretical Biology & Medical Modelling, 2020, 17(1): 2.
[26] 劉 妍,黄小波,陈玉静,等.自噬在神经退行性疾病中的作用及中药干预研究[J].中华中医药学刊,2021,39(3):245-250.
[27] 陈 珂,张宪亮,杜黎涛.运动提高沉默信息调节因子2相关酶1改善阿尔兹海默症[J/OL].中国生物化学与分子生物学报:1-14[2021-07-29].https://doi.org/10.13865/j.cnki.cjbmb.2021.07.1252.
[28] YU S, DU M Y, YIN A, et al. Bcl-xL inhibits PINK1/Parkin-dependent mitophagy by preventing mitochondrial Parkin accumulation[J]. The International Journal of Biochemistry & Cell Biology, 2020, 122: 105720.
[29] WHITLEY B N, ENGELHART E A, HOPPINS S. Mitochondrial dynamics and their potential as a therapeutic target[J]. Mitochondrion, 2019, 49: 269-283.
[30] CARTER F E, MOORE M E, PICKRELL A M. Methods to detect mitophagy in neurons during disease[J]. Journal of Neuroscience Methods, 2019, 325: 108351.
[31] CASTELLAZZI M, PATERGNANI S, DONADIO M, et al. Autophagy and mitophagy biomarkers are reduced in sera of patients with Alzheimer's disease and mild cognitive impairment[J]. Scientific Reports, 2019, 9(1): 20009.
