青少年颅内巨大孤立性纤维瘤1例
2021-09-22杨荣何家全
杨荣 何家全
孤立性纤维瘤(solitary fibrous tumor,SFT)是一类少见的间质原性肿瘤,起源于CD34树突状间叶细胞,常见于中老年,无明显性别差异,好发于胸膜,其次为盆腹腔、四肢等部位,颅内孤立性纤维瘤 (intracranial solitary fibrous tumor,ISFT)临床罕见,且相关文献报道的病例多为中老年,青少年ISFT鲜少报道。我院近期收治1例青少年颅内巨大孤立性纤维瘤,现报道如下。
1 临床资料
患者,男,15岁,因“头晕头痛1年”入院。检查:神志清楚,言语清晰,对答切题,记忆力、计算力、时间、地点定向力正常,眼睑无下垂,双侧瞳孔等大形圆,直径约2.5 mm,对光反射灵敏,听力正常,伸舌居中,咽反射正常,颈软,深浅感觉对称存在,四肢肌张力、肌力正常,指鼻试验、跟膝胫试验稳准,腱反射(++),脑膜刺激征阴性,病理征阴性。头颅CT示颅内顶枕部见巨大占位,大小约6.3 cm×11.1 cm×6.0 cm,形态欠规则,可见浅分叶,边界尚清,其内可见不规则片状低密度影。邻近脑组织受压推移。增强扫描病灶呈明显不均匀强化,其内可见片状无强化低密度区(图1A)。初步诊断:间叶组织肿瘤可能大,a孤立性纤维瘤,b血管外皮瘤或其他。MRI:顶枕叶团块状异常信号影,T1WI呈不均匀等或稍低混杂信号,以等信号为主,增强扫描后不均匀强化(图1B、C);T2WI呈高低混杂信号,内部可见留空血管影;增强后低信号区显著强化,边界较清,大小约6.1 cm×6.4 cm×11.0 cm(图1D)。头颅CTA+CTV示顶枕部病灶间质内可见裂隙状血管影,颅内动脉走行自然,管腔未见明显狭窄、扩张。上矢状窦顶枕部受压闭塞,直窦受压移位(图1E)。术中见右侧颞枕部受肿瘤压迫骨质变得十分菲薄,枕外隆突附近骨质多个血管孔与颅内外交通,硬脑膜张力较高,矢状窦两侧有薄层枕叶脑组织覆盖肿瘤,沿中线向两侧分开脑组织,见肿瘤巨大,色紫红,表面布满暗褐色血管,肿瘤有完整包膜,质地中等,血供极其丰富。在逐步切除肿瘤过程中,出血凶猛,使用双极电凝止血时,患者心率骤升,血压骤降,生命体征波动大,停止双极电凝时生命体征平稳,如此反复发作,与麻醉医师、患方充分沟通后中止手术,仅行肿瘤部分切除以做病理检查明确病变性质。术后病理:梭形细胞肿瘤,细胞有轻度异型,核分裂少见(每 10个高倍视野<5个),间质血管丰富(图 1F)。免疫组化:Vimentin(+)、CD34(-)、CD31(+)、STAT-6(+)、EMA(-)、S-100(-)、GFAP(-)、BCL-2(+)、PR(-)、Ki-67(阳性细胞,10%)。结合免疫表型结果及形态学表现,符合孤立性纤维性肿瘤。术后拔管脱机顺利,术后第3天下床活动,查体无特殊异常,术后第5天出院。术后第10天电话随访无特殊不适,拟去省级医院行二次手术。
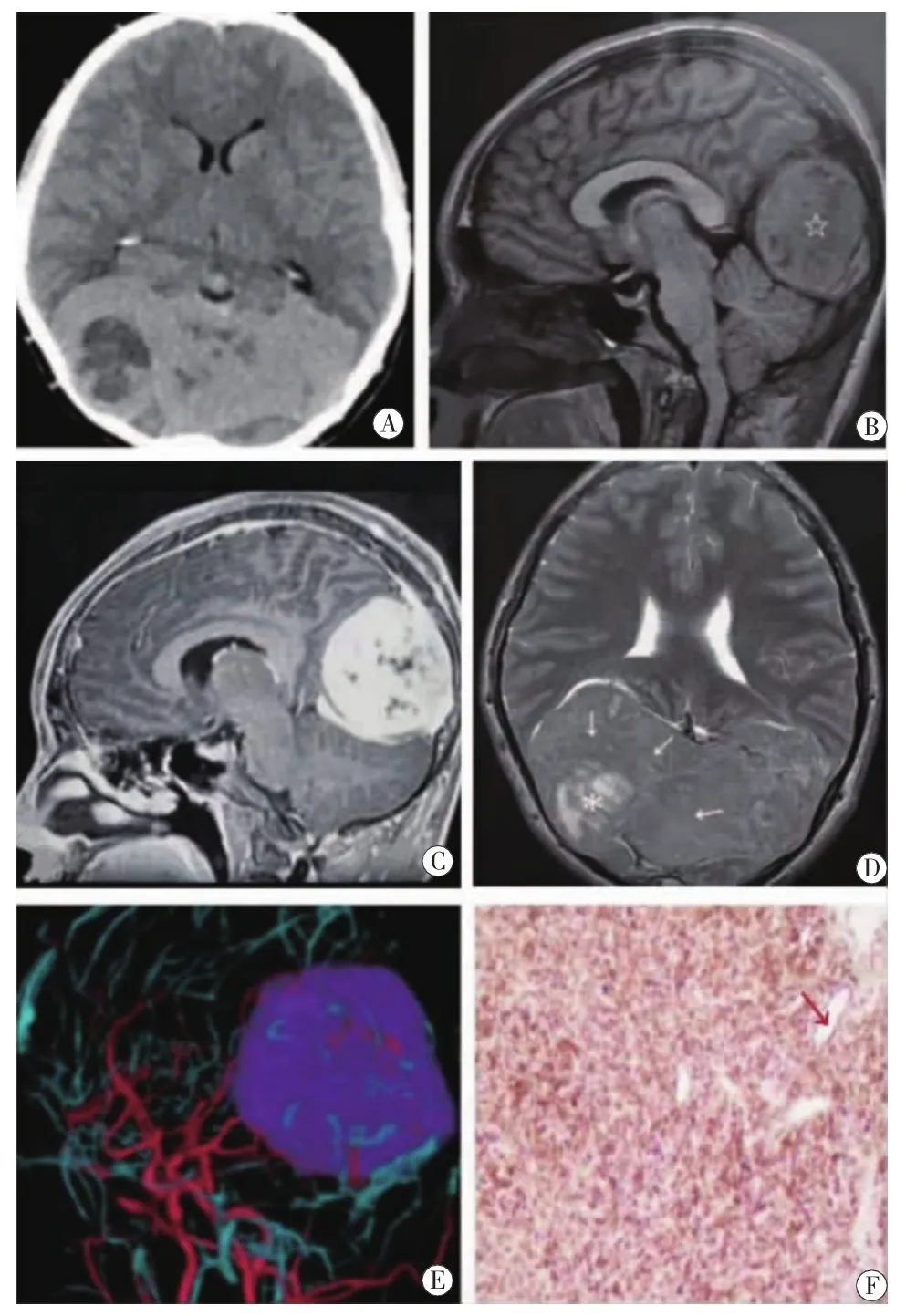
图1 影像资料 A.头颅CT示颅内顶枕部见一团块状稍高密度影,形态欠规则,边界尚清,内可见不规则片状低密度影。B.MRI平扫示顶枕叶团块状异常信号影 (☆),T1WI矢状面以等信号为主。C.MRI增强扫描后病灶不均匀强化,实质部分显著强化,内可见囊变坏死区不强化,边界较清。D.T2WI横断面病灶以等信号(白色箭头)为主,内混杂高信号影(*),呈典型“阴阳征”表现。E.CT血管成像:肿块血供十分丰富,其内见多发迂曲扩张血管影,上矢状窦顶枕部受压闭塞,直窦受压移位。F.组织病理(免疫组化,×100):间质血管丰富(红色箭头),Bcl-2(+)。
2 讨论
ISFT最早在巴西由CARNEIRO于1996年报道[1],临床表现主要与肿瘤的占位效应和颅内压增高相关,非特异性头痛为常见症状,本例患者主要表现为头晕、头痛。
ISFT的影像学表现呈多样化,与肿瘤细胞分布、出血、坏死、液化、黏液变性等病理特点相关,CT平扫大多呈不均匀低密度,增强扫描与肿瘤的血管、纤维含量、细胞分布疏密程度相关,若肿瘤内出现明显坏死、黏液变性,可表现为典型的“地图样”强化。MRI检查时ISFT在T1WI上大多呈低信号,T2WI信号与肿瘤病理特点相关,致密的胶原纤维表现出低信号,瘤细胞密集区可表现为略高信号,肿瘤的黏液变性、坏死及血管间质区则表现为高信号,典型的特征以低信号为主,内见稍高、低混杂信号影,形成“阴阳征”,本病例中T2WI序列上病灶大部分呈低信号,内混杂高信号影,为典型“阴阳征”表现。CT及磁共振可以评估肿瘤大小、质地、周围毗邻关系、血供情况等,而确诊则需要依据病理学,免疫组化对SFT的诊断具有重要意义。
ISFT的临床及影像学表现常不能明确诊断,需依靠病理及免疫组化进一步证实。2007年,被WHO中枢神经系统肿瘤归于脑膜肿瘤中的间叶肿瘤[2],2016年WHO中枢神经系统肿瘤新版分类突破了既往传统,将孤立性纤维瘤与血管外皮细胞瘤调整为一类肿瘤,并设立三个级别:I级,含多量的胶原成分、相对较低的细胞密度和梭形细胞,类似于之前所定义的孤立性纤维瘤;Ⅱ级,含更多的梭形细胞、较少胶原伴肥大的细胞和“鹿角”样血管结构,类似于之前所定义的血管外皮细胞瘤;Ⅲ级,核分裂象显著,表现每10个高倍视野具有≥5个有丝分裂的肿瘤细胞,与间变性血管外皮细胞瘤相对应[3]。ISFT病理学特点 :肿瘤细胞分布有明显的稀疏区和细胞密集区,瘤细胞大小不一,多为梭形,核卵圆形,染色质不均匀,核异型性较明显,少见核分裂象,成片密集的瘤细胞围绕着“鹿角”样扩张的血管,免疫组化常表现为 CD34(+)、STAT6(+)、Bcl-2(+)、CD99(+)、Vimentin(+)、S100(-)、EMA(-)、PR(-)、SSTR2A(-)[4]。通常认为,当Ki-67>5%或肿瘤内出现富细胞区、细胞多形性、出血坏死、明显的核异质性及显著的有丝分裂时,即可考虑诊断为恶性ISFT。值得注意的是,恶性ISFT趋向于低表达或不表达CD34,而高表达P53、S100和Ki-67[5],本例患者 CD34(-),Ki-67 约 10%,肿瘤与上矢状窦、直窦分界不清,基本符合恶性ISFT诊断。
ISFT主要需与脑膜瘤相鉴别。脑膜瘤影像学表现平扫不规则形长 T1稍长 T2信号,宽基底与脑膜相连,增强扫描肿瘤明显强化,临近脑膜出现硬脑膜尾征。脑膜瘤病理:瘤细胞分布也可有稀疏区和细胞密集区,细胞大小相对均匀,染色质相对均匀,缺乏明显的异型性,无核分裂象,瘤细胞之间含丰富的小血管,免疫组化CD34呈阴性或灶状阳性,Bcl、STAT6 和 CD99 表达为阴性,SSTR2A、EMA、PR、S100和P53常表现阳性[6]。
ISFT多系良性病变,手术全切除是目前最好的治疗方式,放化疗主要用于恶性或复发等不能完整切除的肿瘤病变,但其疗效目前尚不明确。术前需充分评估肿瘤的部位、大小和边界情况,在保障神经、血管及脑功能的基础上,尽可能做到全切除;若浸润中枢或周围神经系统组织,可实施次全切除,但应长期随访。
综上所述,ISFT发病率极低,青少年巨大ISFT临床更是罕见,临床发病多为非特异性头痛,临床医生可能因缺乏对它的认识而极易误诊,“地图样”强化、“阴阳征”等影像学表现对该病有诊断价值,但确诊需依靠病理学,治疗上以手术为主,但因肿瘤血供十分丰富等特点,手术效果及预后可能不佳,关于IFST的诊治仍需进一步研究。
