白塞病神经系统受累临床及免疫学特征分析
2021-09-22毛玉景刘田
毛玉景 刘田
白塞病(BD)又称贝赫切特病或白塞综合征,是一种病因未明的慢性复发性血管炎性疾病,以口腔溃疡、生殖器溃疡、眼炎和皮肤病变为主要特征,并可累及全身任何大小和类型的血管[1],目前病因与发病机制尚未阐明,血清学检查显示炎性细胞因子、可趋化因子水平明显升高。白塞病累及中枢或周围神经系统时称为神经白塞病(NBD),是白塞病最为严重的临床类型,患者大多预后不良,也是残疾或死亡的主要原因之一[2]。临床上常因病史采集不详细、体格检查以及实验室检查不充分或缺乏对该病的认识,导致诊断和治疗延误,从而影响患者预后。基于此,本研究对北京大学人民医院近年收治的由风湿免疫科与神经内科共同确诊的33例神经白塞病患者的症状与体征、脑脊液和影像学资料进行回顾,并进行危险因素分析,并与同期住院的41例无神经系统受累表现的白塞病患者的相关临床指标进行比较,以期提高对该病的认识和早期诊断准确率。
对象与方法
一、研究对象
1.纳入标准 诊断标准参考国际神经白塞病专家顾问组(International Neuro Behcet's Advisory Group)制定的相关共识[3]。(1)符合2014年白塞病国际研究组诊断标准(ICBD)[4],即在具备复发性口腔溃疡的基础上,同时存在以下表现中至少两项:复发性生殖器溃疡、眼部损害、皮肤表现或针刺试验阳性。(2)有神经系统受损临床表现,如头痛、脑卒中样发作、大小便障碍、共济失调等。(3)以下指标中至少具备1项:局灶性神经系统受损体征(临床诊断)、神经影像学检查提示中枢神经系统实质受累或脑静脉窦血栓形成(CVST)、间断性脑脊液白细胞计数增高或压力增高。(4)已排除其他可能的疾病,例如神经系统感染或其他风湿免疫性疾病等。(5)本研究经北京大学人民医院道德伦理委员会审核批准(批准文号:2019PHA045),患者及其家属对研究项目知情同意并签署知情同意书。
2.排除标准 (1)血常规或者肝肾功能明显异常。(2)白塞病发病前合并有高血压、糖尿病等基础疾病。(3)合并妊娠、肿瘤、慢性乙型病毒性肝炎等疾病。
3.一般资料 选择2013年1月至2019年1月在我院风湿免疫科住院治疗且诊断明确的的白塞病患者共74例,男性45例,女性29例;年龄15~77岁,平均(40.24±15.24)岁;病程0~44年,中位病程5.00(2.00,16.25)年。其中,复发性口腔溃疡占91.89%(68/74)、生殖器溃疡50%(37/74)、皮肤病变51.35%(38/74)、关节病变36.49%(27/74)、眼炎44.59%(33/74)、消化系统病变28.38%(21/74)、循环系统病变13.51%(10/74)。根据患者是否有神经系统受累表现分为神经白塞病组(NBD组,33例)和非神经白塞病组(非NBD组,41例)。
二、研究方法
1.临床资料收集 (1)临床表现:包括复发性口腔溃疡、生殖器溃疡、皮肤病变、关节病变、眼炎、消化系统病变、神经系统病变等。(2)血清学免疫指标:采用Monitor-100型Vital全自动血沉仪(意大利ELACTA LAB公司)检测红细胞沉降率(ESR,魏氏法);通过IMMAGE-800特定蛋白分析系统(美国Beckman Coulter公司),分别以颗粒增强免疫透射比浊法、单向免疫扩散法检测血清免疫球蛋白定量(IgG、IgA、IgM)和补体(C3、C4),速率比浊法测定血清C-反应蛋白(CRP)。(3)影像学指标:采用美国GE公司生产的Discovery 750 MRI扫描仪分别行横断面T1WI和T2WI序列、DWI和冠状位FLAIR成像,重点观察端脑和(或)间脑连接体、脑干受累情况。根据临床表现和神经影像学检查,中枢型白塞病共分为3型,即实质型(p-NBD),以中枢神经系统炎性实质病变为主征,可进一步分为急性p-NBD和慢性进展型p-NBD;非实质型(np-NBD),表现为以脑静脉系统血栓形成(CVT)为主的颅内血管病变;混合型,上述两种表现兼有。(4)脑脊液检查:检测项目包括颅内压、白细胞计数、蛋白定量、葡萄糖,伴有发热的患者同时完善病原学检查。
2.治疗及预后评价 (1)治疗原则:①激素。急性和(或)亚急性实质型神经白塞病患者,首选足量甲泼尼龙1~2 mg(/kg·d)静脉滴注,出院后改为序贯醋酸泼尼松口服,1个月后以每10~15天减5~10 mg逐渐减量,疗程3~6个月;危重症患者则采取甲泼尼龙冲击治疗,500~1000 mg(×3 d)静脉滴注,根据疗效可重复给药;单纯颅内高压而无脑实质或者周围神经病变者,以中等剂量醋酸泼尼松0.50~1.00 mg(/kg·d)口服,每10~15天减5~10 mg,疗程1~2个月。②免疫抑制剂。首次发病患者一经确诊即开始免疫抑制剂治疗,疗程2~3年。首选药物为环磷酰胺,诱导缓解期每周1次(0.40 g)或每2周1次(0.60 g)静脉滴注,维持期以50 mg/d口服;亦可以选择硫唑嘌呤2~3 mg(/kg·d)、吗替麦考酚酯1.50~2.00 g/d、甲氨蝶呤7.50~25.00 mg/晚口服。③生物制剂。主要适用于发病时即表现为严重脑实质受累且经激素和免疫抑制剂治疗无效,或复发性、慢性进行性脑实质受累患者。所用药物包括阿达木单抗40 mg,每2周皮下注射1次;英夫利昔单抗首次应用和第2、6周时的剂量均为5 mg/kg,然后减至每8周3 mg/kg皮下注射;托珠单抗8 mg/kg静脉滴注,每4周1次。④其他治疗。对于同时伴有黏膜、消化系统或关节受累者,在上述治疗基础上可联合沙利度胺50~100 mg/d、美沙拉嗪1.50 g/d或来氟米特10~20 mg/d、秋水仙碱1.50 mg/d等对症药物治疗。(2)预后评价:出院初期每月复诊1次,病情稳定超过6个月者每3个月复诊1次。住院期间临床症状减轻、影像学异常信号减少或吸收、颅内压降至正常或下降≥20%、脑脊液指标趋于正常参考值范围者,视为临床好转;出院后复诊时无明显症状或体征、影像学检查显示病灶缩小或消失、各项实验室指标基本正常,视为病情稳定。于药物治疗12个月时进行预后评价,分为完全缓解(神经系统症状及影像学病灶完全消失、生活能够自理)和部分缓解(神经系统症状和影像学异常明显好转、激素剂量减少>50%、生活基本自理)。
3.统计分析方法 采用SPSS 21.0统计软件进行数据处理与分析。呈正态分布的计量资料以均数±标准差(±s)表示,采用两独立样本的t检验;呈非正态分布的计量资料以中位数和四分位数间距[M(P25,P75)]表示,行Mann-WhitneyU检验;计数资料以相对数构成比(%)或率(%)表示,行χ2检验;影响因素分析采用单因素和多因素前进法Logistic回归分析,选入与剔除变量标准为α入=0.05,α出=0.10。以P≤0.05为差异具有统计学意义。
结 果
一、总体发病情况
NBD组患者于白塞病首发症状出现0~42年、平均(86.52±35.71)个月后发病,不同病变所占比例分别为复发性口腔溃疡占90.91%(30/33),生殖器溃疡39.39%(13/33),皮肤病变57.58%(19/33,包括结节性红斑12/19例、非糖皮质激素反应性痤疮4/19例、假性毛囊炎3/19例、皮肤脓疱1/19例),关节病变27.27%(9/33),眼炎36.36%(12/33,葡萄膜炎11例、视网膜血管炎1例),消化系统病变45.45%(15/33,肠道溃疡8例、食管及胃部溃疡7例),循环系统病变约占21.21%(7/33,颈动脉瘤1例、腹主动脉瘤1例、主动脉弓升主动脉瘤1例、下肢静脉血栓形成3例、下肢静脉血栓合并肺栓塞1例)。与非NBD组相比,两组性别、年龄、发病年龄、病程、复发性口腔溃疡、生殖器溃疡、皮肤病变、关节病变、眼炎、循环系统病变差异无统计学意义(P>0.05);但NBD组消化系统病变发生率(P=0.003),血清C3(P=0.020)、C4(P=0.001)水平均高于非NBD组且差异具有统计学意义,而血清红细胞沉降率(ESR)、C-反应蛋白(CRP)、IgG、IgA和IgM等免疫学指标组间差异无统计学意义(均P>0.05,表1)。因抗内皮细胞抗体(AECA)、人类白细胞抗原B51(HLA-B51)等数据不完整,故未纳入统计分析。
二、神经系统受累表现
1.症状与体征 NBD组患者主要表现为头痛[48.48%(16/33)],一侧肢体麻木、无力或活动障碍[15.15%(5/33)],构音障碍[12.12%(4/33)],恶心、呕吐[9.09%(3/33)],共济失调[9.09%(3/33)],四肢麻木[9.09%(3/33)]或大小便障碍[3.03%(1/33)]。共30例患者行MRI检查,呈异常影像者占80%(24/30),表现为单个不规则或融合斑片状病灶,呈长T1、等T1信号或长T2信号,FLAIR成像为高信号(图1);3例行CT检查者中1例可见双侧基底节区多发微小梗死灶,余2例未见异常。共17例患者进行脑脊液检查,约占51.52%(17/33)。7例颅内高压(190~210 mm Hg,1 mm Hg=0.133 k Pa)患者中5例常规、生化指标于正常参考值范围,且影像学检查无脑实质病变,2例淋巴细胞计数[(7.66~8.54)×106/L]明显增多,影像学可见脑实质病灶分别位于双侧额叶、双侧脑室后角旁(1例),以及脑干、小脑、基底节区大面积梗死灶(1例);10例颅内压正常者,影像学提示脑实质病变(脑干2例、大脑半球8例),淋巴细胞计数[(8.92~17.54)×106/L]明显增多,蛋白定量[>0.40 g/L(8例)]和葡萄糖[<2.50 mmol/L(2例)]水平异常。
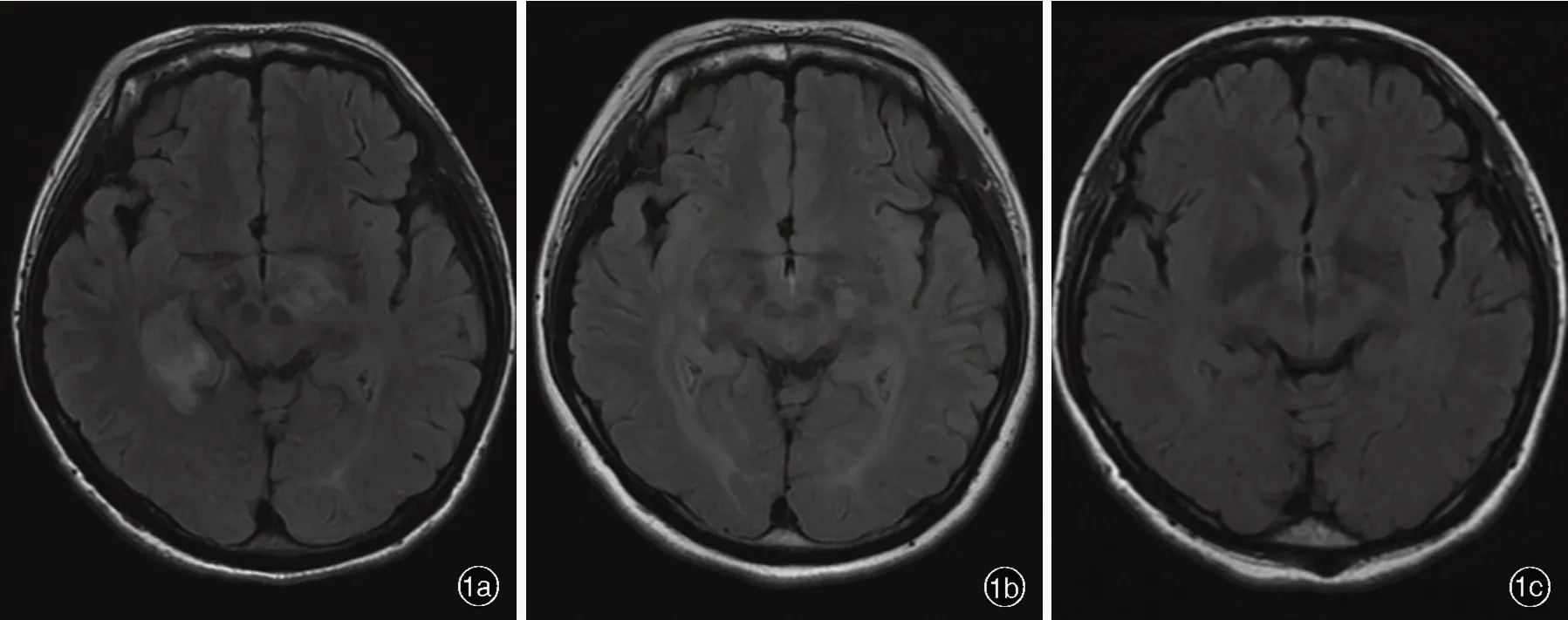
图1 女性患者,25岁,神经白塞病病史2年。治疗前后头部横断面FLAIR成像所见 1a 治疗前右侧颞叶、左侧丘脑等区域大小不等不规则片状异常信号,呈高信号,其中最大病灶为22.70 mm×19.90 mm 1b 阿达木单抗治疗4个月仍显示高信号,但范围明显缩小,为14.50 mm×10.20 mm 1c 治疗1年3个月上述区域异常高信号消失Figure 1 Female,25 years old,with a medical history of 2 years.Axial FLAIR findings before and after treatment Before treatment,irregular sheet-like abnormal signal lesions of varying sizes were seen in the right temporal lobe and left thalamus,it was high signal in FLAIR sequence lesions.The largest lesion size was 22.70 mm×19.90 mm(Panel 1a).Cranial MRI was reexamined after 4 months of adalimumab treatment,and the lesion area was significantly smaller than before,the lesion was 14.50 mm×10.20 mm(Panel 1b).Reexamined after 1 year and 3 months of treatment,and the lesion was almost completely absorbed(Panel 1c).
2.影像学特点 NBD组中枢神经系统实质型病变者约占69.70%(23/33)、非实质型15.15%(5/33)、混合型(实质与非实质兼有)6.06%(2/33);周围神经系统病变仅占9.09%(3/33)。中枢神经系统实质型损害主要分布于脑干、大脑半球、小脑及脑膜,可单独存在亦可合并共存,如大脑与脑干同时受累(1例)或大脑、小脑及脑干同时受累(1例),但脑膜受累者均合并大脑半球损害(4例)。(1)脑干受累:约占18.18%(6/33),以中脑、脑桥损害为主;亦可见脑桥左后部及延髓左前部斑片状信号影(1例),临床表现为延髓麻痹症状,以及脑神经和锥体束受损体征。(2)大脑半球受累:发生率为51.52%(17/33),以脑白质、脑室周围、丘脑和基底节区明显脱髓鞘、梗死或出血性病变为主,临床呈卒中样发作、人格异常、锥体外系症状或大小便障碍。(3)小脑受累:仅占9.09%(3/33),主要表现为小脑性共济失调。(4)脑膜受累:占12.12%(4/33)。非实质型病变患者(5例)主要表现为颅内高压症状如头痛、恶心、呕吐等,但脑脊液常规及生化指标无异常;混合型病变(2例)呈脑实质损害合并颅内压升高特点;3例(19.09%)周围神经系统损害患者(3例)以肢体麻木、无力为主要表现。
三、治疗及预后
1.治疗原则 NBD组患者均予糖皮质激素治疗,起始剂量相当于甲泼尼龙(54.51±20.63)mg/d,其中3例脑干受累急性期患者同时接受甲泼尼龙500 mg(×3 d)冲击治疗。33例中20例(60.61%)应用免疫抑制剂,包括环磷酰胺[36.36%(12/33)]、硫唑嘌呤[15.15%(5/33)]或吗替麦考酚酯[9.09%(3/33)];在此基础上,伴口腔溃疡者联合应用沙利度胺(7例占21.21%),合并关节炎或关节肿痛患者辅以白芍总苷(7例占21.21%)、来氟米特或秋水仙碱,胃肠道溃疡者可与美沙拉嗪联用,重症者则需联合应用生物制剂(5例占15.15%),所选药物为阿达木单抗(3例)、英夫利昔单抗(1例)或托珠单抗(1例)。
2.预后 本组患者中位住院时间36(23,48)d,18例(54.55%)神经系统症状基本消失、影像学病灶范围缩小>50%;11例神经系统症状部分减轻、影像学病灶范围缩小达20%~50%,其中2例因脑干受累(1例)或脑干、大脑、小脑多发病灶(1例)而接受阿达木单抗治疗;另有3例患者因甲泼尼龙治疗后神经系统症状及影像学表现无改善,分别予以阿达木单抗、英夫利昔单抗和托珠单抗治疗。7例颅内高压患者,治疗后5例降至正常值范围、2例下降>20%;12例脑脊液白细胞计数升高患者均有所下降,9例降至正常水平。临床缓解率达87.88%(29/33)。除1例脑干多发病变患者因合并颅内感染致多器官衰竭死亡,其余32例均获得12.00~83.75个月随访,平均(26.83±7.24)个月,病情稳定者占84.85%(28/33)、完全缓解63.64%(21/33)、部分缓解21.21%(7/33)、复发12.12%(4/33)。有7例患者(部分缓解3例、复发4例)遗留脑实质损害,包括面部、肢体麻木(2例),肢体活动障碍(3例),头痛(4例),头晕(3例)及记忆力减退(1例)。
四、危险因素分析
以是否罹患神经白塞病作为因变量,性别、年龄、发病年龄、病程、复发性口腔溃疡、生殖器溃疡、皮肤病变、关节病变、眼炎、消化系统病变、循环系统病变、ESR、CRP、IgG、IgA、IgM、C3、C4为自变量,进行单因素Logistic回归分析。结果显示:消化系统病 变(P=0.005,OR=4.861)、C3(P=0.028,OR=1.002)和C4(P=0.003,OR=1.011)水平升高是罹患神经白塞病的主要危险因素(表2,3);将单因素分析结果中符合纳入与剔除标准的影响因素,以及文献报道可能与神经白塞病有密切关系的眼炎纳入多因素Logistic回归分析,提示消化系统病变(P=0.017,OR=4.373)和C4水平升高(P=0.043,OR=1.009)为神经白塞病的危险因素(表4)。

表2 罹患神经白塞病影响因素变量赋值表Table 2.Variable assignment table of influencing factors for suffering from neuro-Bechet's disease
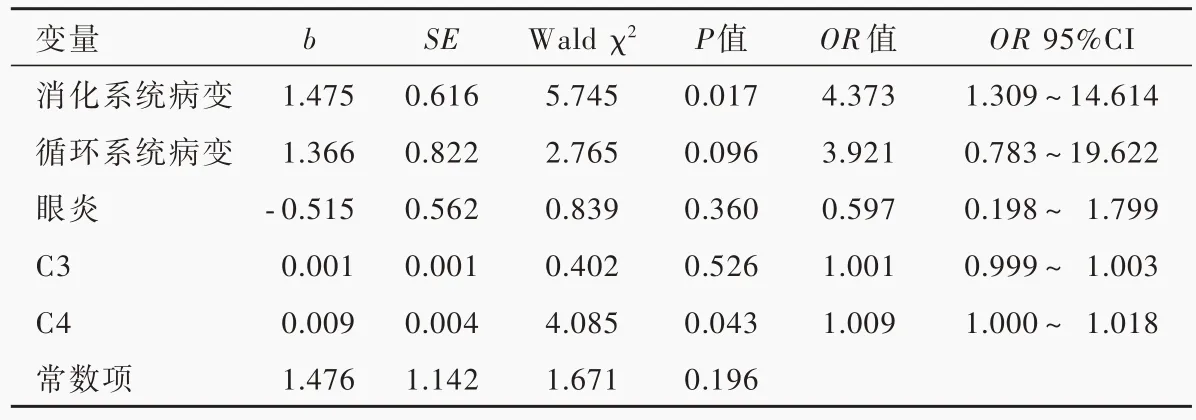
表4 神经白塞病影响因素的多因素前进法Logistic回归分析Table 4.Multivariate Logistic regression analysis of influencing factors for neuro-Bechet's disease
讨 论
白塞病是一种以口腔溃疡、生殖器溃疡和眼炎三联征为临床特征,并多系统受累的慢性血管炎性疾病。按照受累脏器不同可分为血管型、神经型、胃肠型等,神经型系指中枢或周围神经系统受累;而中枢神经系统受累者可进一步分为脑实质受累和非脑实质受累,前者主要累及脑干、脊髓和大脑半球,患者大多预后不良,后者则以静脉窦血栓和颅内动脉瘤等为主[5-6]。
神经白塞病的患病率为1.3%~59.0%,其间的差异可能与不同研究采用的设计类型、疾病定义、种族、地域、神经病学专业程度和治疗方案不同有关[7]。绝大多数神经白塞病患者于白塞病症状出现数月或数年内发病,好发于男性,男∶女比例约为2.8∶1,男性患者预后较差、死亡风险更高[5];高发年龄为20~40岁,多于白塞病发病后1~10年发病,平均发病年龄为31.5岁,部分患者以神经系统症状为首发表现[7-8]。本研究NBD组男性为20例、女性13例,男∶女之比约为1.54∶1,发病年龄10~69岁,平均(32.94±12.44)岁,神经系统症状与体征出现在白塞病首发症状后的0~42年,平均为(86.52±35.71)个月,其中1例以头痛为首发症状,与文献报道相符。神经白塞病主要侵犯中枢神经系统,仅少数病例以周围神经系统受累为主[7],本研究NBD组有3例患者呈多发性周围神经病变,其余30例均为中枢神经系统受累。神经白塞病临床表现具有多样性,因中枢神经系统受累部位不同而表现各异,但以头痛和锥体束损害症状最为常见[9],较少累及脊髓[10],本研究NBD组头痛发生率为48.48%(16/33),MRI提示存在明显脊髓病变者仅1例。
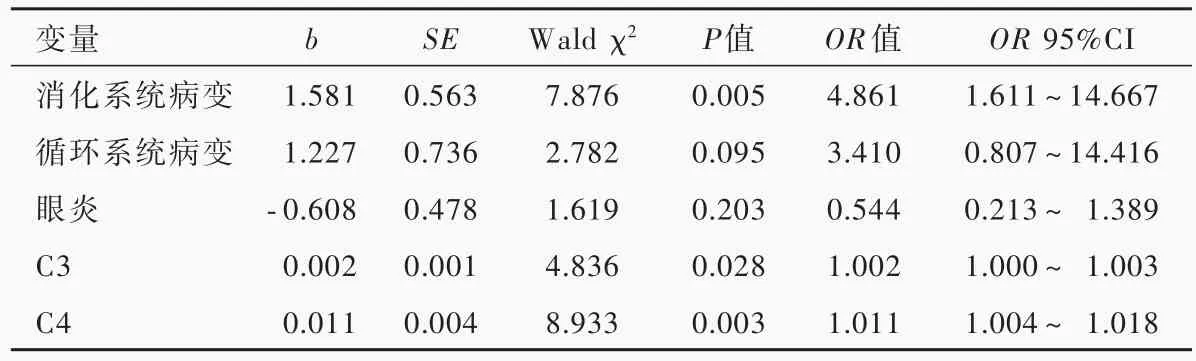
表3 神经白塞病影响因素的单因素Logistic回归分析Table 3.Univariate Logistic regression analysis of influencing factors for neuro-Bechet's disease
MRI是目前诊断神经白塞病神经系统损害最为敏感的方法,表现为T1WI等或低信号、T2WI和FLAIR成像高信号,CT对神经白塞病的敏感性和特异性远低于MRI;本研究NBD组仅3例急诊患者行CT检查,2例未见明显异常、1例显示双侧基底节区多发腔隙灶(可能血管周围间隙增宽),其余30例入院后均经MRI检查发现中枢神经系统损害征象,脑实质病灶主要分布在脑干、基底节和脑室周围。Farahangiz等[11]经对58例神经白塞病患者头部MRI观察发现,脑实质型神经白塞病患者的头部病灶以脑室周围、浅层脑白质、中脑和脑桥常见。有研究显示,从首诊白塞病至出现神经系统受累症状的中位时间约为6年,脑实质型、非脑实质型、混合型和周围神经系统病变患病率分别为61.04%(47/77)、28.57%(22/77)、6.49%(5/77)和3.90%(3/77);与非脑实质型患者相比,脑实质型患者眼部受累更为常见,脑实质病变严重程度依次为脑干[72.34%(34/47)]、小脑[44.68%(21/47)]和间脑[38.30%(18/47)][12]。本研究NBD组脑实质型占69.70%(23/33)、非脑实质型15.15%(5/33)、混合型6.06%(2/33)、周围神经系统型9.09%(3/33);其中6例累及脑干,病灶主要位于中脑和脑桥,仅1例MRI显示延髓受累,17例累及大脑半球,以白质、脑室周围、丘脑和基底节区病变程度较为严重,与文献报道基本一致。笔者认为,神经白塞病病灶分布特点可能与大脑半球中线区静脉引流侧支循环较少有关。本研究NBD组有1例患者病程中发生蛛网膜下腔出血,但该患者并不存在蛛网膜下腔出血的相关危险因素,其病因考虑与白塞病有关,文献检索鲜有报道,故尚无相关循证医学证据。脑脊液检查对神经白塞病的诊断和疾病活动性的判断至关重要,脑实质型患者以蛋白定量或白细胞计数增多为主,但颅内压常于正常参考值;而以颅内高压为主要表现的病例一般仅表现为压力升高,极少出现蛋白定量或白细胞计数增多,本研究NBD组患者入院后共17例行脑脊液检查,其中脑实质型和非脑实质型颅内压升高患者脑脊液检查所存在的差异性也证实了这一点,由于样本量较小,尚需进一步扩大病例数加以证实。目前认为,白塞病脑实质损害机制与脑小血管受累有关,而颅内压升高是由于凝血机制异常引起的脑静脉或静脉窦血栓形成所致[13-14]。根据既往文献报道,约有40%的颅内压升高患者MRV检查可见颅内静脉窦血栓形成[13,15],提示对于以颅内高压为主要表现的神经白塞病患者应尽早施行MRV筛查,明确是否存在颅内静脉窦血栓,本研究尚缺乏此方面的临床数据。
经与同期住院的非神经白塞病患者比较发现,NBD组患者消化系统病变发生率和血清补体水平较高,但有关发病年龄、性别、口腔溃疡、生殖器溃疡、皮肤损害、关节炎、眼部受累,以及血清炎症指标CRP、ESR及免疫球蛋白等数据二者并无明显差异;多因素Logistic回归提示,消化系统病变、血清C4水平升高可能为神经白塞病之危险因素。目前针对神经白塞病危险因素的临床研究较少,Houman等[16]认为,神经白塞病生殖器溃疡发生率高于非神经白塞病,较少合并胃肠道病变,二者眼部受累无显著差异;但Ideguchi等[17]观察的病例中神经白塞病较非神经白塞病患者更易合并眼部损害,较少发生生殖器溃疡,与Houman等[16]的结果相反;Yan[18]等亦支持脑实质型神经白塞病患者眼部受累更为普遍的观点。各项研究之间存在的差异可能与人种、地域,以及样本大小有关,有待大样本随机对照临床试验的验证。
目前尚无关于神经白塞病治疗的Ⅰ级证据,主要依据观察性研究,其治疗可分为两个阶段,即急性发作期和预防复发[19]。按照欧洲抗风湿病联盟(EULAR)2018年白塞病诊断与治疗推荐意见[20]:脑实质型患者急性期首选大剂量糖皮质激素治疗,危重症患者则须采取激素冲击疗法,本研究NBD组有3例病情严重者接受激素冲击疗法,同时辅助环磷酰胺、硫唑嘌呤、吗替麦考酚酯等免疫抑制剂治疗,治疗期间避免使用环孢素类抗生素,本研究有20例患者使用免疫抑制剂治疗。近年随着生物制剂的广泛应用,危重症患者尚可选用抗肿瘤坏死因子-α(TNF-α)单克隆抗体如英夫利昔单抗、阿达木单抗等,2018年EULAR指南指出,抗TNF-α单克隆抗体应作为重症或难治性脑实质型患者的一线治疗药物[20]。据刘金晶等[21]报告,10例行英夫利昔单抗治疗的重症或(和)难治性神经白塞病患者,有1例完全缓解、8例部分缓解;本研究NBD组接受抗TNF-α单克隆抗体治疗的4例患者中1例完全缓解、3例部分缓解,均有效。神经白塞病患者大多预后不良,重大血管疾病或中枢神经系统受累为其主要致死原因[22-23],本研究NBD组即有1例患者死于多发性脑干病变合并颅内感染。神经白塞病患者经积极的治疗仍可获得较好预后,但病情进展者预后不良。
综上所述,神经白塞病是白塞病的少见临床表现,症状与体征复杂多样,以中枢神经系统受累常见,较少出现周围神经病变,对于表现为消化系统病变、血管受累和血清补体水平升高的白塞病患者,应警惕神经白塞病。治疗原则以糖皮质激素联合免疫抑制剂或生物制剂治疗为主,早期诊断、规范化治疗可使大多数患者获得良好预后。
利益冲突无
