ACT001通过抑制P65磷酸化降低胶质母细胞瘤细胞程序性死亡蛋白配体1的表达
2021-09-22张锦浩刘沛东张辰李佳博任枭陈露露孙锦章王旭亚张亮杨学军
张锦浩 刘沛东 张辰 李佳博 任枭 陈露露 孙锦章 王旭亚 张亮 杨学军
胶质瘤是临床最常见的颅内原发性中枢神经系统肿瘤,其中以多形性胶质母细胞瘤(GBM)恶性程度最高,约占原发性中枢神经系统恶性肿瘤的47.1%[1]。尽管以保护神经功能为前提的最大范围手术切除肿瘤,联合术后同步放化疗和替莫唑胺序贯化疗,以及肿瘤电场治疗(TTF)[2-3]的应用可以改善预后,但遗憾的是,胶质母细胞瘤患者5年生存率仅为5.5%,其中位生存期也仅为14.6个月[4],主要是由于中枢神经系统特有的血-脑屏障结构和胶质母细胞瘤特殊的免疫抑制微环境所致。有研究显示,免疫检查点如细胞程序性死亡蛋白1(PD1)及其配体(PDL1)[5]、T细胞免疫球蛋白黏蛋白分子-3(TIM-3)[6]在胶质母细胞瘤中呈高表达,且与不良预后密切相关。因此,免疫治疗仍是改善胶质瘤患者预后的重要策略。从白菊分离出来的小白菊内酯(PTL)具有广泛的抗炎症和抗肿瘤作用[7],但其在酸性和碱性条件下不稳定,水溶性差,口服生物利用率低[8],通过改进其化学结构获得的含笑内酯(MCL)及其衍生物二甲氨基含笑内酯(DMAMCL)富马酸盐即ACT001,具有相对分子量低、稳定性强、易溶于水、毒性作用小、血-脑屏障通透性高等优点,可抑制胶质瘤的生长[9-10]。业已证实,PTL可以显著抑制核因子-κB(NF-κB)和信号转导与转录激活因子3(STAT3)信号转导通路活性[11]。NF-κB作为转录因子,通过直接调控下游基因表达或与其他信号转导通路交联作用,在肿瘤的发生发展过程中发挥重要的作用,已知其在乳腺癌和结肠癌中通过转录后调节以调控PDL1的表达[12-13]。鉴于此,本研究探究ACT001是否能够通过抑制胶质母细胞瘤细胞NF-κB信号转导通路活性,下调PDL1表达,改善免疫抑制微环境,进而抑制胶质母细胞瘤进展。
材料与方法
一、实验材料
1.细胞来源 人胶质瘤细胞系U87购自中国科学院上海生命科学研究院细胞资源中心,在天津医科大学总医院神经病学研究所液氮中常规保存。
2.试剂与设备 (1)药品与试剂:ACT001由南开大学药学院提供,DMEM培养基和胎牛血清均购自美国Gibco公司,CCK-8试剂盒为上海东仁化学科技公司产品,Lipofectamine RNAiMAX转染试剂购自美国Thermo公司,小干扰RNA(siRNA)由苏州吉玛基因股份有限公司提供,P65和兔抗人单克隆抗体(1∶200)为美国CST公司产品,Alexa Fluor 594标记的驴抗兔荧光IgGⅡ抗(1∶1000)由美国Invitrogen公司提供,体积分数为1%的TritonX-100溶液、RIPA裂解液[按1∶100比例加入蛋白酶抑制剂苯甲基磺酰氟(PMSF)和磷酸酶抑制剂]和BCA蛋白定量试剂盒均购自北京索莱宝科技有限公司,Trizol溶液为美国Ambion公司产品,实时定量聚合酶链反应(qRT-PCR)试剂盒(Master Mix试剂盒)和逆转录试剂盒为美国Promega公司产品,Ⅰ抗工作液包括兔抗人P65和磷酸化P65(p-P65)单克隆抗体(1∶1000)购自美国CST公司、兔抗人PDL1单克隆抗体(1∶1000)购自美国Abcam公司、内参照物小鼠抗人β-肌动蛋白(β-actin)单克隆抗体(1∶1000)购自北京中杉金桥生物技术有限公司,辣根过氧化物酶(HRP)标记的山羊抗鼠和山羊抗兔IgGⅡ抗(1∶3000)购自北京中杉金桥生物技术有限公司。(2)仪器与设备:含5%二氧化碳的37℃恒温培养箱由德国Heraeus公司提供,Synergy 2多功能酶标仪由美国BioTek公司提供,IX73倒置相差荧光显微镜为美国Olympus公司产品,凝胶成像分析系统购自美国BD公司。
二、实验方法
1.生物信息学分析 肿瘤基因组学图谱计划(TCGA)数 据 从 其 官 网(https://cancergenome.nih.gov/)下载,包含695例胶质瘤患者和5例正常对照者的转录组测序(RNA-seq)结果及其中605例胶质瘤患者的总生存期(OS);中国脑胶质瘤基因组学图谱计划(CGGA)数据从其官网(http://www.cgga.org.cn/)下载,包含325例胶质瘤患者的RNA-seq测序结果及其中222例患者的总生存期。采用R语言数据分 析 软 件(R version 4.0.2,https://www.R-project.org/)分析TCGA和CGGA数据库中胶质瘤病理分级和预后与P65和PDL1 mRNA表达量的关系,其中,图 形 绘 制 使 用ggplot程 序 包(https://ggplot2.tidyverse.org),生存分析使用survival程序包(https://CRAN.R-project.org/package=survival)和survminer程序 包 (https://CRAN.R -project.org/package=survminer),统计分析使用ggsignif程序包(https://CRAN.R-project.org/package=ggsignif)。
2.CCK-8法检测细胞增殖活性 将U87细胞接种于96孔板,细胞接种数目为2000个/孔,每组置设6个平行孔,置于含5%二氧化碳的37℃恒温培养箱中接种12 h,抽干原培养基,更换为含不同浓度ACT001的培养基100μl,ACT001终浓度分别为5、10、20、40、80、160和320μmol/L;同时设置空白对照组(无U87细胞)和正常对照组(含U87细胞但不滴加ACT001)。各组细胞均置于细胞培养箱中培养48 h,每孔加入CCK-8溶液10μl,静置2 h后于酶标仪上测定450 nm处光密度值(OD值),计算细胞抑制率,细胞抑制率(%)=[(正常对照孔OD450nm-实验孔OD450nm)/(正常对照孔OD450nm-空白对照孔OD450nm)]×100%,再采用GraphPad软件(http://www.graphpad.com/)绘制细胞抑制率与ACT001浓度的标准曲线,并计算ACT001半数抑制浓度(IC50)。
3.免疫荧光法检测P65蛋白在U87细胞中的定位变化 经50μmol/L ACT001处理的U87细胞和正常对照组U87细胞培养48 h后,去除培养基,磷酸盐缓冲液(PBS)快速冲洗5 min(×3次),滴加体积分数为4%的多聚甲醛溶液固定10 min,磷酸盐缓冲液摇洗5 min(×3次),加入体积分数为1%的TritonX-100溶液室温通透10 min,磷酸盐缓冲液摇洗5 min(×3次),滴加体积分数为5%的山羊血清于37℃封闭1 h,弃血清,加入兔抗人P65单克隆抗体(1∶200),4℃过夜孵育,次日弃Ⅰ抗,磷酸盐缓冲液冲洗5 min(×3次)后加入Alexa Fluor 594标记的驴抗兔荧光IgGⅡ抗(1∶1000),避光湿盒孵育1 h后,弃Ⅱ抗,磷酸盐缓冲液冲洗5 min(×3次)后滴加4’,6-二脒基-2-苯基吲哚(DAPI),室温静置5 min,以抗荧光衰减剂封片,避光条件下于倒置相差荧光显微镜下观察,呈红色荧光的细胞即为P65蛋白的定位。
4.siRNA转染U87细胞 首先将U87细胞接种于6孔板,细胞接种数目为(80~100)×103个/孔,当细胞密度达60%~80%时进行转染。转染前,先将6孔板中完全培养基更换为无血清培养基,置于细胞培养箱中培养30 min,每孔准备2支1.50 ml无菌EP管,一支加入100μl无血清培养基+6μl Lipofectamine RNAiMAX转染试剂(A管),另一支加入100μl无血清培养基+150 pmol siRNA(B管)。将A管的转染试剂培养基混合物滴加至B管的siRNA培养基混合物,混匀,室温静置15~20 min后立即转染;将200μl混合物分别滴加至各自6孔板,混匀,P65 siRNA由苏州吉玛基因股份有限公司进行设计合成,P65干扰序列1(si-P65-1组)为5'-GAUGAAGACUUCUCCUCCATT-3'、P65干扰序列2(si-P65-2组)为5'-CAGAUACAGACGAUCGUCATT-3'、 无 义 序 列 (si-NC 组 ) 为 5'-UUCUCCGAACGUGUCACGUTT-3',转染12 h后更换为完全培养基继续培养48 h。
5.实时定量聚合酶链反应检测P65蛋白敲低效率 经siRNA转染的U87细胞置于含5%二氧化碳的37℃恒温培养箱中培养48 h,Trizol溶液提取RNA,按照逆转录试剂盒的说明逆转录为cDNA,行qRT-PCR,PCR引物序列为,P65正向引物序列:5'-AAGATCTGCCGAGTGAACCG-3'、反向引物序列:5'-GCCTGGTCCCGTGAAATACA-3',内参照物甘油醛-3-磷酸脱氢酶(GAPDH)正向引物序列:5'-GGTGGTCTCCTCTGACTTCAACA-3'、反 向 引 物 序列:5'-GTTGCTGTAGCCAAATTCGTTGT-3'。反应体系共20μl,主要包括cDNA 1μl、正向和反向引物各为1μl、2×Master Mix 10μl、DEPC水7μl。反应条件为95℃预变性3 min,循环1次;95℃15 s,60℃1 min,共循环40次。以GAPDH为内参照物计算P65蛋白相对表达量,计算公式为:相对表达量=2-(ΔCT实验组目的RNA-ΔCT对照组目的RNA)。
6.Western blotting法检测目的蛋白相对表达量 经25和50μmol/L ACT001处理的U87细胞以及正常对照组U87细胞培养48 h后,RIPA裂解液(按1∶100比例加入蛋白酶抑制剂PMSF和磷酸酶抑制剂)提取总蛋白,按照BCA蛋白定量试剂盒测定总蛋白浓度后,行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),采用聚偏二氟乙烯(PVDF)转膜以及牛奶封闭后,滴加Ⅰ抗工作液,包括兔抗人P65、p-P65和PDL1单克隆抗体以及内参照物小鼠抗人β-actin单克隆抗体(均1∶1000),4℃孵育过夜,滴加辣根过氧化物酶标记的山羊抗鼠和山羊抗兔IgGⅡ抗(1∶3000)。凝胶成像分析系统采集P65、p-P65和PDL1条带结果,并采用Image J软件进行量化分析,以β-actin作为内参照物,计算目的蛋白的相对表达量。
7.统计分析方法 采用SPSS 20.0统计软件进行数据处理与分析。呈正态分布的计量资料以均数±标准差(±s)表示,采用单因素方差分析,两两比较行LSD-t检验。以P≤0.05为差异具有统计学意义。
结 果
生物信息学分析显示,正常对照者P65和PDL1 mRNA表达量极低,胶质瘤患者P65和PDL1 mRNA表达量增加且随肿瘤病理分级的升高而呈上升趋势,差异有统计学意义(均P<0.05,图1);胶质瘤患者中P65和PDL1高表达组生存率和生存期均低于低表达组且差异具有统计学意义(均P<0.05,图2)。
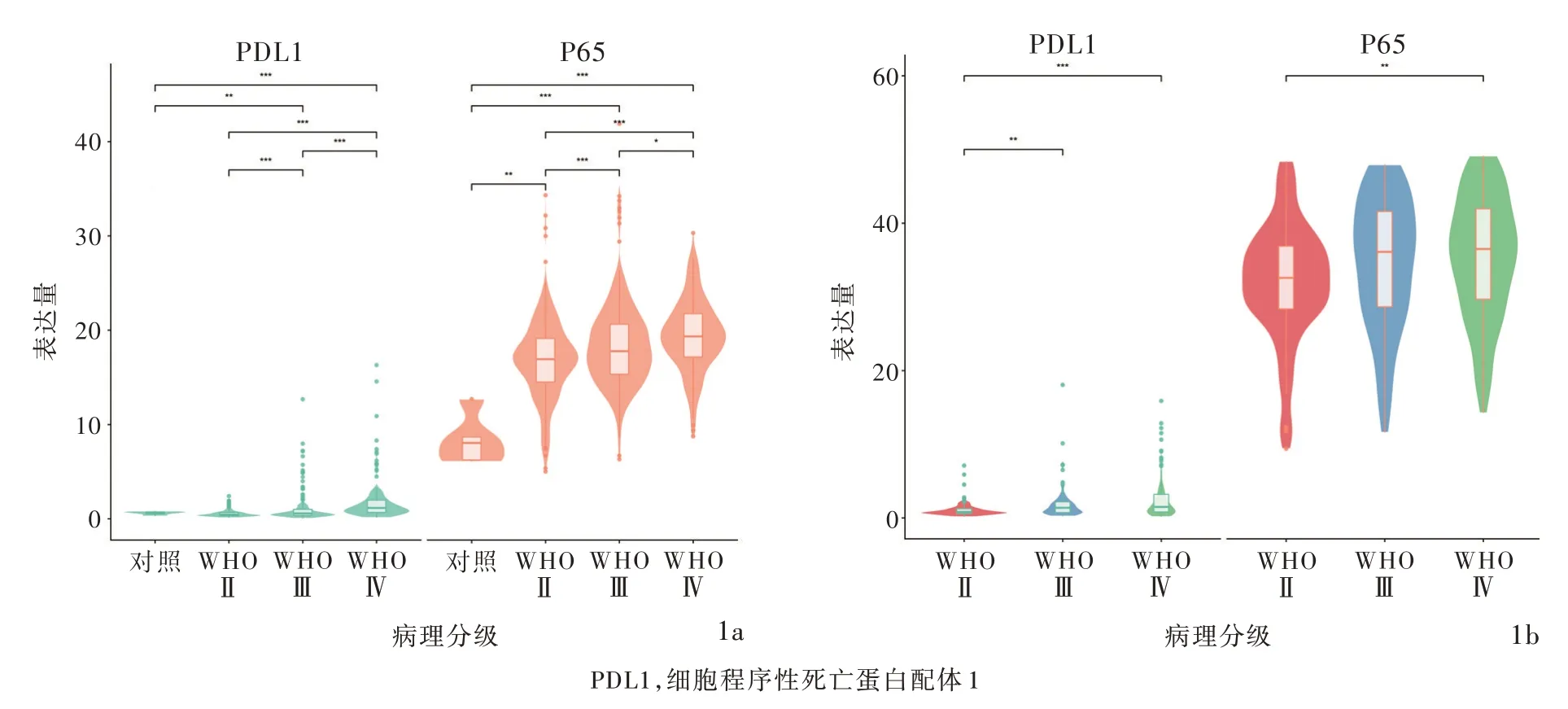
图1 生物信息学分析结果 1a TCGA数据库中正常对照者P65和PDL1 mRNA表达量极低,胶质瘤患者P65和PDL1 mRNA表达量增加且随肿瘤病理分级的升高而呈上升趋势 1b CGGA数据库中胶质瘤患者P65和PDL1 mRNA表达量随肿瘤病理分级的升高而增加Figure 1 Bioinformatics analysis results The mRNA expression levels of P65 and PDL1 in TCGA database were extremely low in normal controls,but increased in glioma patients and showed an upward trend with the increase of tumor pathological grade(Panel 1a).Gliomas with higher pathological grade showed higher P65 and PDL1 expression in CGGA database(Panel 1b).
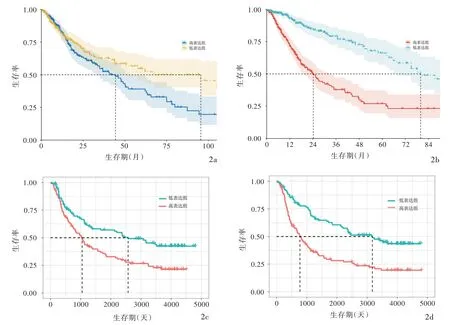
图2 生物信息学分析结果 2a TCGA数据库中胶质瘤患者P65 mRNA高表达组生存率和生存期均低于低表达组(P=0.05)2b TCGA数据库中胶质瘤患者PDL1 mRNA高表达组生存率和生存期均低于低表达组(P=0.000)2c CGGA数据库中P65 mRNA高表达组生存率和生存期均低于低表达组(P=0.001)2d CGGA数据库中PDL1 mRNA高表达组生存率和生存期均低于低表达组(P=0.000)Figure 2 Bioinformatics analysis results In TCGA database,the survival rate and survival time in the group with high P65 mRNA expression in glioma patients were lower than those in the group with low expression(P=0.05,Panel 2a).In TCGA database,the survival rate and survival time in the group with high PDL1 mRNA expression in glioma patients were lower than those in the group with low expression(P=0.000,Panel 2b).In CGGA database,the survival rate and survival time of the group with high P65 mRNA expression were lower than those of the group with low expression(P=0.001,Panel 2c).In CGGA database,the survival rate and survival time of the group with high PDL1 mRNA expression were lower than those of the group with low expression(P=0.000,Panel 2d).
细胞增殖活性检测结果显示,经不同药物浓度ACT001(5、10、20、40、80、160和320μmol/L)处理后,U87细胞抑制率分别为(9.01±4.75)%、(17.03±2.91)%、(28.50±4.85)%、(45.50±5.15)%、(67.67±8.46)%、(83.02±5.79)%和(94.33±1.59)%,从而最终得出ACT001对U87细胞的半数抑制浓度为42.98μmol/L(图3)。

图3 细胞抑制率与ACT001浓度的标准曲线显示,随着ACT001药物浓度的升高,U87细胞抑制率逐渐升高Figure 3 CCK-8 results suggested that ACT001 inhibited the proliferation of U87 cells in a dose-dependent manner.
免疫荧光染色显示,与正常对照组相比校,经50μmol/L ACT001处理的U87细胞P65蛋白入核减少,表明ACT001主要通过减少P65蛋白入核以抑制NF-κB信号转导通路活性(图4)。
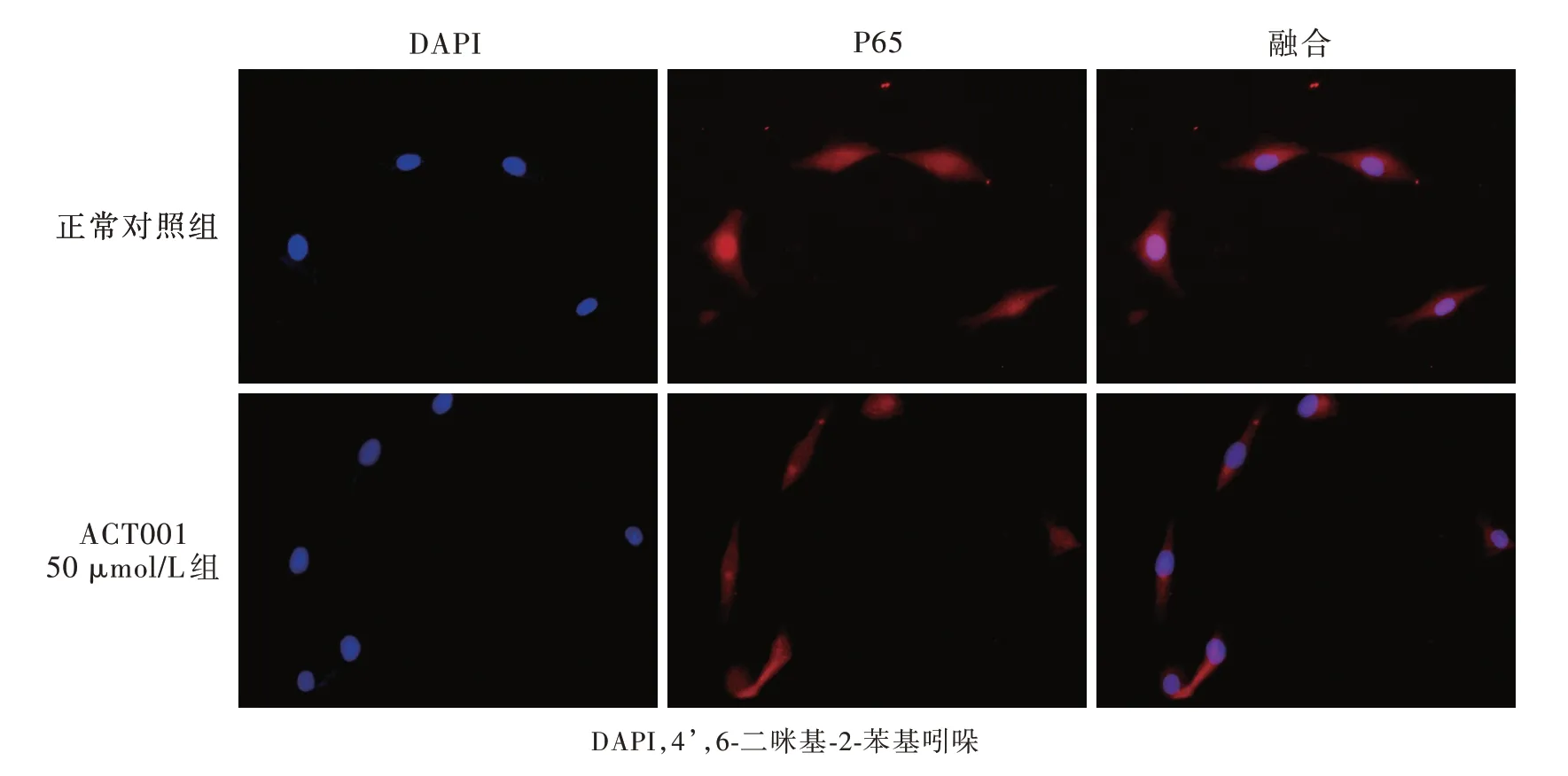
图4 倒置相差荧光显微镜显示,正常对照组和ACT001 50μmol/L组P65蛋白的表达定位变化,经50μmol/L ACT001处理后P65蛋白入核减少 免疫荧光染色 ×400Figure 4 Inverted phase contrast fluorescence microscopy showed the P65 expression and localization in U87 glioma cells in control group and ACT001 50μmol/L group:the nuclear translocation was reduced in the ACT001 50μmol/L group.Immunofluorescence staining ×400
qRT-PCR反应显示,不同siRNA转染组U87细胞P65 mRNA表达量差异具有统计学意义(P=0.000,表1)。两两比较结果显示,si-P65-1组(t=13.290,P=0.000)和si-P65-2组(t=12.730,P=0.000)P65 mRNA表达量低于si-NC组。si-P65-1组与si-P65-2组差异无统计学意义(t=0.852,P=0.427),表明si-P65-1组和si-P65-2组较si-NC组敲低P65蛋白的效果显著。
表1 不同siRNA转染组U87细胞P65 mRNA表达量的比较(±s)Table 1.Comparison of P65 mRNA expression in U87 cells transfected with different siRNA(±s)

表1 不同siRNA转染组U87细胞P65 mRNA表达量的比较(±s)Table 1.Comparison of P65 mRNA expression in U87 cells transfected with different siRNA(±s)
组别 例数P65 mRNAF值P值si-NC组31.000 si-P65-1组30.152±0.007164.2000.000 si-P65-2组30.166±0.031
Western blotting法显示,不同siRNA转染组U87细胞P65(P=0.000)、p-P65(P=0.000)和PDL1(P=0.002)相对表达量差异具有统计学意义(表2)。两两比较显示,si-P65-1组和si-P65-2组P65(P=0.000,0.000)、p-P65(P=0.000,0.000)和PDL1(P=0.004,0.003)相对表达量低于si-NC组,si-P65-1组与si-P65-2组之间差异无统计学意义(均P>0.05;表3,图5),表明减少U87细胞P65磷酸化水平,可以抑制PDL1的表达。不同浓度药物处理组U87细胞P65相对表达量差异无统计学意义(P=0.904),然而,p-P65(P=0.000)和PDL1(P=0.000)的相对表达量差异均具有统计学意义(表4),其中,ACT001 25μmol/L组和50μmol/L组p-P65(P=0.000,0.000)和PDL1(P=0.000,0.000)相对表达量均低于正常对照 组 ,ACT001 50μmol/L组p-P65(P=0.006)和PDL1(P=0.046)相对表达量亦低于25μmol/L组(表5,图6),表明ACT001对P65的表达无明显影响,但抑制P65磷酸化和PDL1表达,且呈现药物浓度依赖性。
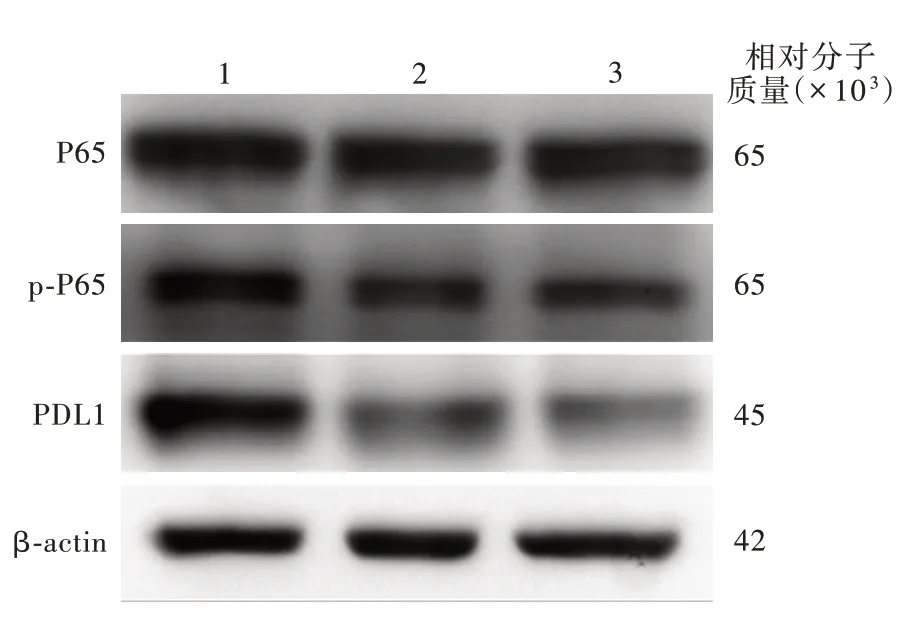
图6 Western blotting法结果显示,ACT001 25μmol/L组和50μmol/L组p-P65和PDL1相对表达量均低于正常对照组且呈药物浓度依赖性,而P65相对表达量无明显变化Figure 6 Western blotting showed the relative expression of p-P65 and PDL1 in the ACT001 treatment groups were lower than those in the control group in a dose-dependent manner,while the relative expression of P65 showed no difference.
表4 不同浓度药物处理组U87细胞P65、p-P65和PDL1蛋白相对表达量的比较(±s)Table 4.Comparison of the relative expression of P65,p-P65 and PDL1 in U87 cells of different treatment groups

表4 不同浓度药物处理组U87细胞P65、p-P65和PDL1蛋白相对表达量的比较(±s)Table 4.Comparison of the relative expression of P65,p-P65 and PDL1 in U87 cells of different treatment groups
组别 例数P65p-P65PDL1正常对照组(1)31.0001.0001.000 ACT00130.979±0.0860.720±0.0200.571±0.048 25μmol/L组(2)ACT00130.957±0.1390.607±0.0230.444±0.041 50μmol/L(3)F值0.102269.700128.800 P值0.9040.0000.000
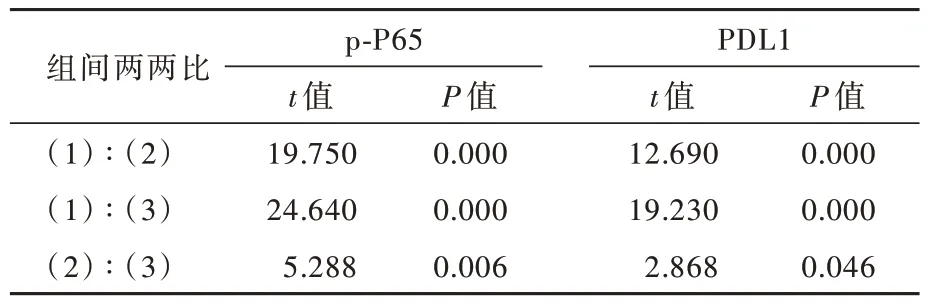
表5 不同浓度药物处理组U87细胞P65、p-P65和PDL1相对表达量的两两比较Table 5.Pairwise comparison of the relative expression of P65,p-P65 and PDL1 among different treatment groups

图5 Western blotting法显示,si-P65-1组和si-P65-2组P65、p-P65和PDL1相对表达量均低于si-NC组Figure 5 Western blotting showed the relative expression of P65,p-P65 and PDL1 in si-P65-1 and si-P65-2 groups were lower than those in si-NC group.
表2 不同siRNA转染组U87细胞P65、p-P65和PDL1相对表达量的比较(±s)Table 2.Comparison of the relative expression of P65,p-P65 and PDL1 in U87 cells transfected with different siRNA(±s)
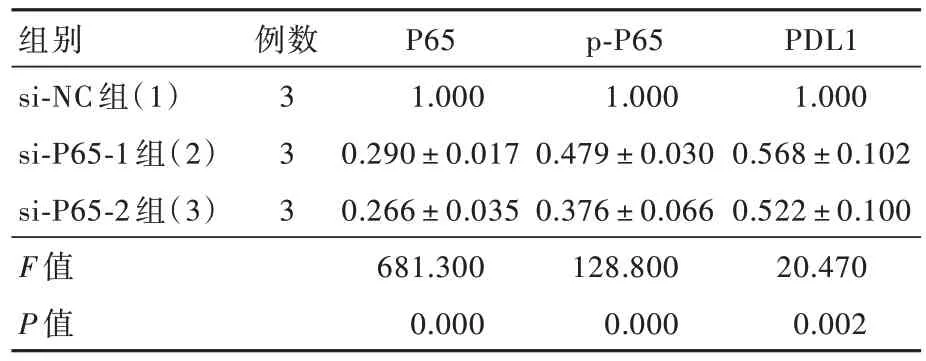
表2 不同siRNA转染组U87细胞P65、p-P65和PDL1相对表达量的比较(±s)Table 2.Comparison of the relative expression of P65,p-P65 and PDL1 in U87 cells transfected with different siRNA(±s)
p-P65,phospho-P65,磷 酸化P65;PDL1,programmed cell death protein ligand 1,细胞程序性死亡蛋白配体1。The same for tables below
组别 例数P65p-P65PDL1 si-NC组(1)31.0001.0001.000 si-P65-1组(2)30.290±0.0170.479±0.0300.568±0.102 si-P65-2组(3)30.266±0.0350.376±0.0660.522±0.100 F值681.300128.80020.470 P值0.0000.0000.002

表3 不同siRNA转染组U87细胞P65、p-P65和PDL1相对表达量的两两比较Table 3.Pairwise comparison of the relative expression of P65,p-P65 and PDL1 among groups transfected with different siRNA
讨 论
胶质瘤尤其是胶质母细胞瘤恶性程度高、预后差,许多针对胶质母细胞瘤的靶向药物均未能有效延长患者的中位生存期,独特的免疫抑制微环境发挥重要作用。胶质母细胞瘤细胞表达的免疫检查点PDL1通过与肿瘤微环境中T淋巴细胞表达的PD1结合,诱导T淋巴细胞凋亡,最终导致肿瘤细胞免疫逃逸。此外,胶质母细胞瘤还通过调节白细胞介素-10(IL-10)信号转导通路以促进正常单核细胞的PDL1表达[14-15]。本研究对来自TCGA和CGGA数据库的胶质瘤患者进行生物信息学分析,发现PDL1 mRNA表达量随胶质瘤病理分级的升高而呈上升趋势,且高表达组生存率和总生存期均低于低表达组。免疫检查点PDL1在胶质瘤免疫抑制微环境中发挥重要作用,本研究进一步通过实验证明,ACT001通过降低胶质母细胞瘤细胞PDL1的表达,以改善肿瘤免疫抑制微环境。
NF-κB作为转录因子,通过直接调控下游基因的表达或与其他信号转导通路的交联作用,在肿瘤的发生发展过程中发挥极其重要的作用[16]。NF-κB转录因子家族包括NF-κB1(P50)、NF-κB2(P52)、RelA(P65)、RelB和cRel,且这些亚基之间可以形成多种同二聚体和异二聚体,其中P50/P65是最常见的二聚体。多数情况下,P50/P65二聚体通过与胞质 中 核 因 子-κB抑 制 蛋 白(IκB)抑 制 因 子 家 族(IκBα、IκBβ和IκBε)中的任一结合,而被锚定在胞质中以无活性状态存在;多种刺激如细菌脂多糖(LPS)或肿瘤坏死因子 α(TNF-α),使IκB激酶激活致IκB的丝氨酸磷酸化,引起IκB降解,继而导致P50/P65二聚体磷酸化并移位入核,再与特定基因的启动子区结合,参与其转录调控。激活的NF-κB信号转导通路在胶质瘤的进展、迁移、多药耐药以及肿瘤相关免疫逃逸中发挥极其重要的作用[17]。NF-κB信号转导通路还通过与其他信号转导通路如STAT3、Notch和P53信号转导通路的交联作用,间接影响肿瘤进展[16,18]。本研究生物信息学分析亦显示,P65 mRNA表达量随胶质瘤病理分级的升高而呈上升趋势,且其发挥活性的是磷酸化形式即p-P65;Western blotting法显示,不同siRNA转染组U87细胞P65、p-P65和PDL1相对表达量差异有统计学意义,其中,si-P65-1组和si-P65-2组P65、p-P65和PDL1相对表达量均低于si-NC组,表明减少U87细胞P65磷酸化水平,可以抑制PDL1的表达。
ACT001作为一种新型抗肿瘤药物,业已完成中国和澳大利亚的胶质瘤Ⅰ期临床试验。目前由天津医科大学总医院牵头,正在天津医科大学总医院、中国医学科学院北京协和医院、首都医科大学附属北京天坛医院等7所医院开展ACT001单药以及ACT001联合替莫唑胺治疗复发胶质母细胞瘤的Ⅱ期临床试验。本研究为一项体外实验,细胞增殖活性检测显示,经不同药物浓度ACT001(5、10、20、40、80、160和320μmol/L)处理后,U87细胞抑制率分别为(9.01±4.75)%、(17.03±2.91)%、(28.50±4.85)%、(45.50±5.15)%、(67.67±8.46)%、(83.02±5.79)%和(94.33±1.59)%,从而得出ACT001对U87细胞的半数抑制浓度为42.98μmol/L。免疫荧光染色显示,经50μmol/L ACT001处理的U87细胞P65蛋白入核减少,表明ACT001通过减少P65蛋白入核以抑制NF-κB信号转导通路活性。Western blotting法显示,不同浓度药物处理组U87细胞p-P65和PDL1相对表达量差异有统计学意义,其中,ACT001 25μmol/L组和50μmol/L组p-P65和PDL1相对表达量低于正常对照组,ACT001 50μmol/L组p-P65和PDL1相对表达量亦低于25μmol/L组,表明ACT001不仅可以抑制胶质瘤细胞的增殖,还可以通过抑制P65的磷酸化及核转位,从而抑制PDL1的表达,以改善胶质瘤的免疫抑制微环境。我们课题组的前期研究显示,ACT001可以抑制STAT3的磷酸化[19-20]。提示ACT001可以作为一种多靶点药物治疗胶质母细胞瘤,从而为ACT001最终应用于临床提供理论依据。
Lim等[12]和Liu等[13]针对乳腺癌和结肠癌的研究显示,NF-κB(P65)作为转录因子,通过结合Cops5基因启动子,调控COP9信号小体5(CSN5)的表达。CSN5控制约1/5的蛋白质降解过程,通过从Cullin RING E3泛素连接酶(CRLs)骨架移除激活蛋白NEDD8,使 其 失 去 活 性[21]。Lim等[12]业 已 证 实CSN5可以调控PDL1的去泛素化,减少其降解。因此,ACT001是否通过抑制胶质母细胞瘤细胞P65的磷酸化,降低CSN5表达量,从而增加PDL1的泛素降解,将是我们进一步的研究方向。
本研究通过体外实验证实,ACT001可以抑制P65的磷酸化,下调胶质母细胞瘤细胞PDL1的表达,从而改善肿瘤免疫抑制微环境。后续将建立GL261脑胶质瘤细胞C57BL/6小鼠颅内原位种植模型,验证ACT001对P65、CSN5和PDL1表达的调控。
利益冲突无
