N-取代四氢异喹啉衍生物的合成及杀多子小瓜虫研究
2021-09-22姚嘉赟张成赛尹文林蔺凌云潘晓艺刘忆翰夏炎春沈锦玉
姚嘉赟,张成赛,尹文林,蔺凌云,潘晓艺,曹 铮,刘忆翰,夏炎春,沈锦玉
( 1.浙江省淡水水产研究所,浙江省鱼类健康与营养重点实验室,农业农村部淡水渔业健康养殖重点实验室,浙江 湖州 313001; 2.吉林农业大学 动物科技学院,吉林省动物微生态制剂工程研究中心,吉林 长春 130118 )
多子小瓜虫(Ichthyophthiriusmultifiliis),属纤毛门、寡膜纲、膜口目、凹口科、小瓜虫属[1]。其生活史分为滋养体、包囊体和掠食体3个阶段。滋养体主要寄生在宿主体表,当滋养体发育成熟并离开鱼体后,分泌一层透明而有弹性的物质将自身包裹形成包囊,再经有丝分裂形成掠食体,掠食体出包囊后又可感染其他鱼体[2]。多子小瓜虫几乎可以感染所有淡水鱼类,给世界范围的水产养殖业造成重大经济损失[3-4]。
疫苗被认为是一种防治多子小瓜虫病的有效手段,大量研究结果表明,甲醛或者冰冻处理多子小瓜虫幼虫灭活疫苗具有一定的免疫保护力[5],但目前还不能解决多子小瓜虫离体培养这一难题,难以获得大量的抗原,因而缺乏实际的可操作性。孔雀石绿(四甲基代二氨基三苯甲烷)和硝酸亚汞被认为是较为有效的杀虫物质,但因其致癌性目前已被禁用[6]。甲醛[7]、硫酸铜[8]、过氧化氢[9]、过氧乙酸[10]、过碳酸钠[11]、溴硝醇[12-13]、高铁酸钾[14]等被用于控制多子小瓜虫病,虽有一定功效,但长期使用也会带来环境污染、药物残留、虫体产生耐药性等一系列问题。因此,寻找治疗多子小瓜虫病行之有效、环境友好型的药物迫在眉睫。姚嘉赟等[15-16]用活性追踪方法从博落回和小果博落回中分离获得3种苯菲啶异喹啉类化合物血根碱、二氢血根碱和二氢白屈菜红碱,药效结果显示,3种物质对多子小瓜虫具有较强的杀灭作用。同时,构效关系研究初步表明其核心药效基团主要为四氢异喹啉。因此,笔者以苯乙醇为起始原料,对醇基的α位碳上的氢进行取代,然后经还原、酰化或磺酰化保护氨基,关环,皮克特—施彭格勒反应,脱去保护基团等反应合成3种N-取代四氢异喹啉衍生物,研究其杀虫功能,以期研制开发新型的杀虫药物。
1 材料与方法
1.1 N-取代四氢异喹啉衍生物的合成及鉴定
以对位被不同取代基取代苯乙醇为起始原料,对醇基的α位碳上的氢进行取代,经还原、酰化或磺酰化保护氨基,关环,皮克特—施彭格勒反应,脱去保护基团等反应合成3种四氢异喹啉类衍生物:化合物1(R=CH3NH1-)、化合物2(R=C2H6NH1-)、化合物3[R=CH3(CH2)2NH1-],并对其进行分离、纯化和结构鉴定,合成过程见图1。

图1 N-取代四氢异喹啉衍生物的合成过程Fig.1 Synthetic process of N-substituted-tetrahydroisoquinoline derivatives1.R=CH3NH1-; 2.R=C2H6 NH1-; 3.R=CH3(CH2)2NH1-.
1.2 体外杀虫药效试验
1.2.1 虫体的收集
将严重感染多子小瓜虫的翘嘴红鲌(Erythroculterilishaeformis)饲养于实验室的阶梯式养殖水槽中,在养殖水槽的底部放入大量自制的虫体玻璃收集器,待鱼体上的多子小瓜虫游出鱼体,沉入水体底部的玻璃收集器后,收集虫体。一部分虫体放入22 ℃的培养箱中进行培养,获取多子小瓜虫掠食体进行杀虫试验。另一部分吸取收集后放入24孔细胞培养皿,进行体外包囊药物试验。
1.2.2 药物对多子小瓜虫掠食体的体外杀虫试验
将合成的所有药物用二甲基亚砜进行溶解,进而根据预试验的结果配制不同质量浓度的药物,化合物1的质量浓度为6、8、10、12、14、16、18、20 mg/L,化合物2的质量浓度为10、12、14、16、18、20、22、24 mg/L,化合物3的质量浓度为10、13、16、19、22、25、28、31 mg/L,吸取150 μL的药物于24孔细胞培养皿中。收集多子小瓜虫掠食体,并放置在烧杯中进行稀释,使其密度约200个/μL,待药物加入24孔细胞培养皿后于每个药物孔中加入0.5 μL的虫体,并用枪头进行混匀。试验设置一个空白药物对照组和一个二甲基亚砜对照组(前期试验表明药物中所添加的最高含量二甲基亚砜对多子小瓜虫掠食体没有毒性)。每个药物质量浓度设置3个平行。用药后观察多子小瓜虫的死亡情况,统计每个药物质量浓度下的4 h死亡率,进而计算杀虫率(R,%):
R=n1/n×100%
式中,n1为用药组死亡虫数(个),n为对照组虫数(个)。
1.2.3 药物对多子小瓜虫包囊的体外杀虫试验
根据药物对掠食体的杀灭质量浓度范围配制不同,并进行杀虫预试验,初步确定药物对包囊的杀虫质量浓度范围,设定3种化合物的使用质量浓度为10、20、30、40 mg/L。吸取150 μL的药物于24孔细胞培养皿中。收集多子小瓜虫包囊,并放置在烧杯中进行稀释,使其密度约为60个/μL,待药物加入细胞培养皿后于每个药物孔中加入0.5 μL的虫体,并放置于22 ℃的恒温恒湿培养箱中,培养20~36 h后,统计各药物质量浓度组的包囊死亡数量和孵化的幼虫数量。试验设置一个空白药物对照组和一个二甲基亚砜对照组(前期试验表明药物中所添加的最高含量二甲基亚砜对多子小瓜虫掠食体没有毒性)。每个药物质量浓度设置3个平行。
1.3 2-甲胺基-1,2,3,4-四氢异喹啉-1-甲腈对翘嘴红鲌的急性毒性试验
因化合物1(2-甲胺基-1,2,3,4-四氢异喹啉-1-甲腈)对多子小瓜虫的体外杀虫效果最强,故而研究其对翘嘴红鲌的安全性。急性毒性试验按照文献[14-15]的方法进行,试验鱼暂养7 d后先进行毒性预试验,初步确定药物的毒性试验质量浓度,并按等对数间距设计7个质量浓度:81.00、72.25、64.00、56.25、49.00、42.25、36.00 mg/L,以下不添加药物为对照组。试验控制水温(25±1) ℃,试验期间不投饲,及时捞出死鱼,每个药物质量浓度试验设置3个平行。
根据12、24、48、96 h平均死亡率,利用直线内插法求出半致死质量浓度(LD50),再计算安全质量浓度(SC):
SC=(24 h LD50×0.3)/(24 h LD50/48 h LD50)3
1.4 数据处理
用SPSS 16.0处理药效数据,以平均数±标准误表示,采用方差分析进行差异显著性分析。
2 结 果
2.1 合成产物的结构鉴定
对上述合成的3种化合物进行质谱、核磁共振氢谱、核磁共振碳谱等波谱技术进行化学结构鉴定,进而确定化合物合成成功。
化合物1:
电喷雾离子源质谱:m/z—148.5 [M-CN]+;UV(MeOH)—λmax211 (4.42) nm,244(3.91) nm; IR:υmax(KBr, cm-1)—2220(w, C≡N),1145(s, C-N)。核磁共振氢谱(CD3Cl, TMS)δ: 6.24(1H, d-like,J=8.5 Hz, H-1′), 7.357(7H, m), 5.67(1H, s, H-1), 3.34(1H, td,J=12.0, 4.0 Hz, H-3a), 3.53(1H, dd,J=12.0, 6.5 Hz, H-3b), 3.12(1H, ddd,J=15.8 12.3, 6.0 Hz, H-4a), 2.67(1H, br dd,J=15.8, 2.5 Hz, H-4b)。核磁共振碳谱(CD3Cl)δ: 144.3(C-1′), 115.6 (C≡N), 52.5 (C-1), 46.3 (C-3), 28.8(C-4), 133.2(C-5), 126.8 (C-6), 131.2 (C-7), 126.4 (C-8), 113.7(C-8a)。确定该化合物为2-甲胺基-1,2,3,4-四氢异喹啉-1-甲腈。
化合物2:
电喷雾离子源质谱:m/z—163.8 [M-CN]+;UV(MeOH)—λmax211(4.83) nm,250(4.41) nm;IR:υmax(KBr, cm-1)—2225(w, C≡N),1152(s, C-N)。核磁共振氢谱 (CD3Cl, TMS)δ: 7.23~7.33(5H, m), 6.71(3H, m), 5.54(1H, s, H-1), 3.69(1H, m, H-3a), 3.49 (1H, m, H-3b), 3.23(1H, ddd,J=16.0, 11.2, 6.0 Hz, H-4a), 2.88 (1H, dt-like,J=6.0, 4.2 Hz, H-4b)。核磁共振碳谱(CD3Cl)δ: 152.4 (C-1′), 149.8 (C-2′), 117.3(C≡N), 52.3(C-1), 44.1(C-3), 28.6 (C-4), 131.4 (C-5), 125.3 (C-6), 133.8 (C-7), 127.1 (C-8), 114.2(C-8a)。确定该化合物为2-乙胺基-1,2,3,4-四氢异喹啉-1-甲腈。
化合物3:
电喷雾离子源质谱:m/z—176.7 [M-CN]+;UV (MeOH)—λmax251 (4.61) nm;IR:υmax(KBr, cm-1)—2225 (w, C≡N),1148(s, C-N);核磁共振氢谱 (CD3Cl, TMS)δ:7.29 (6H,m), 6.99 (2H, m), 5.47(1H, s, H-1), 3.71 (1H, m, H-3a), 3.48 (1H, m, H-3b), 3.16 (1H, m, H-4a), 2.94(1H, dd,J=6.5, 3.0 Hz, H-4b);核磁共振碳谱(CD3Cl) δ: 147.0(C-1′), 128.7 (C-2′), 130.5 (C-3′), 117.5 (C≡N), 52.8 (C-1), 45.2 (C-3), 29.7 (C-4), 132.3 (C-5), 126.1 (C-6), 134.2 (C-7), 126.8 (C-8), 113.9 (C-8a)。确定该化合物为2-异丙基胺基-1,2,3,4-四氢异喹啉-1-甲腈。
2.2 N-取代四氢异喹啉衍生物对多子小瓜虫掠食体的杀灭作用
合成的3种化合物在10~31 mg/L内对多子小瓜虫掠食体均具有一定的杀灭作用(图2)。而杀虫效果最好的为化合物1(2-甲胺基-1,2,3,4-四氢异喹啉-1-甲腈),其质量浓度为20.0 mg/L时,在4 h即可杀灭100%幼虫,其4 h的半数致死质量浓度为11.6 mg/L,其次是化合物2 (2-乙胺基-1,2,3,4-四氢异喹啉-1-甲腈),其质量浓度为24.0 mg/L时杀灭率为100%,其4 h的半数致死质量浓度为 15.1 mg/L。杀虫效果最差的为化合物3 (2-异丙基胺基-1,2,3,4-四氢异喹啉-1-甲腈),其质量浓度为31.0 mg /L时杀灭率为100%,其4 h的半数致死质量浓度为18.2 mg/L。

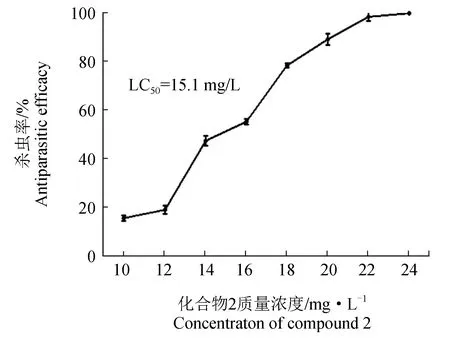

图2 化合物1~3对多子小瓜虫掠食体的杀灭作用(4 h)Fig.2 Anti-parasitic efficacy of compounds 1—3 against I. multifiliis theronts in 4 h exposure
体外杀虫试验结果还显示,3种N-取代四氢异喹啉衍生物对多子小瓜虫掠食体具有一定的细胞结构破坏作用,多子小瓜虫掠食体在接触药物4 h后,其表面纤毛不可见,细胞缩小,部分细胞破碎胞质流出。而对照组结构完好,纤毛运动正常,胞内器官明显,虫体运动及活力正常(图3)。

图3 异喹啉衍生物作用多子小瓜虫掠食体后的显微结构(20×)Fig.3 Microstructures of I. multifiliis theronts treated with etrahydroisoquinoline derivatives (20×)a.药物作用4 h后; b.正常多子小瓜虫掠食体.a.theronts treated with drug for 4 h; b.normal theronts.
2.3 N-取代四氢异喹啉衍生物对多子小瓜虫包囊体的杀灭作用
3种N-取代四氢异喹啉衍生物对多子小瓜虫包囊的杀灭作用见表1。合成的3种化合物在所测的质量浓度范围内对多子小瓜虫的包囊均具有杀灭或抑制作用。杀虫效果最好的为化合物1,其质量浓度为40.0 mg/L时,在6 h即可杀灭100%包囊,其次是化合物2,其质量浓度为40.0 mg/L时杀灭率为70.0%。杀虫效果最差的为化合物3,其质量浓度为40.0 mg/L时杀灭率为63.3%。由此可知,随着N-取代基团碳链的延长其杀虫效果不断降低。

表1 化合物1~3对多子小瓜虫包囊的成活和孵化影响(6 h)Tab.1 The survival and hatching of I. multifiliis tomonts exposed to compounds 1—3 for 6 h
2.4 2-甲胺基-1,2,3,4-四氢异喹啉-1-甲腈对翘嘴红鲌的急性毒性试验
2-甲胺基-1,2,3,4-四氢异喹啉-1-甲腈对翘嘴红鲌的急性毒性试验结果见表2,由直线内插法计算可得,2-甲胺基-1,2,3,4-四氢异喹啉-1-甲腈对翘嘴红鲌的24 h的半致死质量浓度为66.57 mg/L,48 h的半致死质量浓度为62.78 mg/L,96 h的半致死质量浓度为51.0 mg/L。根据公式计算可得,其安全质量浓度为16.75 mg/L。

表2 2-甲胺基-1,2,3,4-四氢异喹啉-1-甲腈对翘嘴红鲌的急性毒性Tab.2 The acute toxicity of 2-methylamino-1,2,3,4-tetrahydrois-oquinoline-formonitrile to topmouth culter E. ilishaeformis
3 讨 论
3.1 异喹啉衍生物的杀虫构效关系
异喹啉及异喹啉的衍生物是一类重要的医药化工中间体,它被广泛应用于各种重要医用药物。姚嘉赟等[16-18]已获得多种具有杀指环虫和多子小瓜虫的异喹啉类生物碱。分析各类异喹啉类生物碱的结构可以发现,绝大部分该类生物碱均存在异喹啉或者异喹啉衍生物的基本框架结构。因此,异喹啉这个基本框架极有可能是杀虫的主要药效基团,故而笔者以苯乙醇为起始原料合成了3种异喹啉类衍生物,体外杀虫药效结果也显示了预期的设想,这从侧面证实了异喹啉有可能是杀虫的主要药效基团。同时,体外杀虫试验结果还显示,随着N-取代基团碳链的延长其杀虫效果明显降低。Wen等[19]研究也表明,侧链糖基的数量影响着杀多子小瓜虫的药效结果,糖基数量越多其杀虫效果越差。
3.2 异喹啉衍生物的杀虫活性
体外试验结果表明,3种异喹啉衍生物可造成多子小瓜虫虫体细胞结构的破坏、纤毛脱落以及胞质外流,这与孔雀石绿作用于多子小瓜虫的现象基本相同[20]。近期的研究结果表明,异喹啉类生物碱对细胞毒性的作用位点主要是细胞的线粒体,它可诱导HL-60细胞的凋亡,其对细胞的诱导凋亡作用主要是通过线粒体的多诱导凋亡途径实现[21]。线粒体在调控细胞凋亡以及凋亡和坏死性细胞死亡造成的功能性损失方面起着重要的作用[22]。这可能是本研究中3种化合物杀虫的作用机理之一。芦程等[23]研究表明,异喹啉生物碱血根碱对指环虫的杀虫机理是其对虫体内的抗氧化系统造成损害,进而导致虫体体表结构损坏,合胞体、分泌颗粒、线粒体减少,体壁顶部质膜损坏,进而造成基板致密结构变得稀疏,形成许多孔洞,进而造成虫体破裂。而本试验中,异喹啉衍生物对多子小瓜虫掠食体用药6 h后造成其胞质外流、细胞破碎,其作用机理也可能是改变了虫体的抗氧化系统,但其具体的作用位点、作用模式和作用机制还需进一步研究。
综上所述,笔者以苯乙醇为起始化合物合成了3个N-取代四氢异喹啉类化合物,这3种化合物对多子小瓜虫幼虫和包囊均有较好的杀灭效果,且随着N-取代基团碳链的延长其杀虫效果不断降低,这可为将来该类杀虫化合物的合成提供一定的借鉴作用。
4 结 论
以苯乙醇为原料合成3种N-取代四氢异喹啉衍生物,其中,2-甲胺基-1,2,3,4-四氢异喹啉-1-甲腈杀多子小瓜虫活性最强,且该化合物对鱼类的毒性较低,具有较好的开发潜力。
