网箱养殖大黄鱼内脏白点病病原菌分离鉴定及致病性研究
2021-09-22徐春霞
徐春霞
( 福建省闽东水产研究所,福建 宁德 352100 )
大黄鱼(Pseudosciaenacrocea),属鲈形目、石首鱼科、黄鱼属,为我国传统四大海产鱼类之一。作为目前我国最大的大黄鱼育苗和养殖基地,福建省宁德市的大黄鱼产量约占全国大黄鱼养殖产量的70%[1],根据2019年福建省渔业统计年鉴,2019年宁德市人工养殖大黄鱼总量达1.64×105t,养殖网箱近33万个,养殖面积近2450 hm2,稳居全国首位,为宁德市带来巨大的经济效益。然而随着养殖规模的扩大及环境的恶化,大黄鱼养殖病害频发,成为制约其产业发展的主要瓶颈。尤其是近些年暴发的流行性细菌性疾病——内脏白点病,在发病期间病鱼腹部胀大,内脏出现白色结节,累计死亡率高,给大黄鱼养殖产业造成巨大的经济损失[2]。已有诸多学者[3-14]对大黄鱼内脏白点病进行病原分离鉴定和致病性研究,鉴定出的病原菌有铜绿假单胞菌(Pseudomonasaeruginosa)[3]、恶臭假单胞菌(P.putida)[4-9]、变形假单胞菌(P.plecoglossicida)[10-15],但目前学术界对大黄鱼内脏白点病病原菌的鉴定结果仍存在分歧。为避免采样过程中造成的污染以及病原菌人工培养分离过程中的偏差等问题,笔者首次采用宏基因组测序对患病大黄鱼内脏组织中菌落变化进行比较,并采用生态模拟的方式自患病大黄鱼内脏中分离病原菌,进行全基因组序列分析,最后对病原菌的致病性和耐药性进行研究,旨在增进对大黄鱼内脏白点病的认识,为网箱养殖大黄鱼内脏白点病的早期预防和治疗提供基础数据。
1 材料与方法
1.1 试验用鱼
2018年4月,海区水温17.8 ℃,自宁德市三沙湾大湾渔排选取网箱养殖的大黄鱼,平均体质量为150 g,无菌条件下-18 ℃运抵实验室进行组织病理观察、宏基因测序以及病原菌分离。
2019年9月,海区水温27.7 ℃,自富发水产公司大湾渔排随机选取大黄鱼10尾并解剖,在确保没有内脏白点的情况下挑选出健康、活力好的大黄鱼500尾,平均体质量为45 g,活水运输到实验室,暂养14 d,其间正常喂食,作为攻毒试验用鱼。
1.2 材料与试剂
NaCl、甘油(国药集团化学试剂有限公司),2216E液体培养基、2216E琼脂(青岛海博生物技术有限公司),营养琼脂粉(上海蓝季科技发展有限公司),脑心浸液培养基(英国麦康凯公司),API-20E鉴定试剂盒(法国梅里埃公司),TaKaRa细菌DNA提取试剂盒(日本宝日生物技术有限公司),抗生素药品纸片(杭州天和微生物试剂有限公司),通用型组织固定液(赛维尔生物科技有限公司)。
1.3 仪器与设备
Nano drop 2000分光光度计(美国赛默飞世尔科技公司),BX51生物显微镜(日本奥林巴斯公司),TG16-WS台式高速离心机(上海卢湘仪离心机仪器有限公司),TU-100恒温金属浴(上海一恒科技有限公司),SW-CJ-1FD洁净工作台(苏州安泰空气技术有限公司),DNP-9272恒温培养箱(上海精宏实验设备有限公司),THZ-C-L台式冷冻恒温振荡器(太仓市强乐实验设备有限公司),Select cyclerⅡ梯度PCR仪(美国Select BioProducts)。
1.4 病理组织学观察
活体解剖濒死病鱼,观察其内脏组织病变情况并拍照保存,对病变组织取样保存,进行组织病理观察。分别取鲜活病鱼和健康鱼的肝脏、肾脏和脾脏组织,用含4%多聚甲醛通用型组织固定液进行组织固定后送武汉塞维尔生物科技有限公司进行普通包埋和石蜡切片。样品组织经过70%~100%乙醇逐级脱水处理,二甲苯透明,石蜡包埋,切片机切片,切片脱蜡至水,苏木精—伊红染色等步骤,进行显微镜镜检和图像采集。
1.5 宏基因测序
对大黄鱼进行解剖观察,选取4尾内脏结节症状明显的大黄鱼和1尾无结节症状的大黄鱼,无菌条件下取脾脏、肾脏、肝脏以及肠道组织。同时,抽取200 mL所在养殖区域的海水,通过0.22 μm滤膜对海水中细菌进行固定。将滤膜与上述组织分别存放于冷冻管中,干冰条件下委托生工生物工程(上海)股份有限公司进行宏基因测序。
1.6 病原菌分离
无菌条件下将10 g患病大黄鱼的脾脏和肾脏组织破碎后溶于990 mL生理盐水,经梯度稀释后将样品接种于脑心浸液培养基和2216E固体培养基中,分别将样品置于16 ℃和30 ℃培养48 h。根据菌落形态,挑取单菌落进行培养,将纯化后的细菌溶于15%甘油,于-80 ℃保存备用。
1.7 16S rDNA序列扩增及鉴定
参考Takara试剂盒说明书,对纯化后的潜在病原菌进行DNA提取。以DNA为模板,使用Taq酶,上游引物P1: 5′-AGAGTTTGATCCTGGCTCAG-3′和下游引物P2: 5′-GGTTACCTTGTTA CGACTT-3′建立50 μL扩增体系。
PCR反应条件为:94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火1 min,72 ℃延伸1 min,30个循环;72 ℃延伸10 min后4 ℃保存。PCR扩增产物用1%琼脂糖凝胶电泳检测确认后送测序公司进行测序,获得的测序结果在美国国立生物技术信息中心进行BLAST比对分析。
1.8 感染试验
试验前随机解剖10尾大黄鱼进行细菌分离,在确保无潜在感染风险的情况下,挑选健康、有活力的大黄鱼作为人工感染试验用鱼。病原菌分离共获得优势菌株10株,经序列鉴定和生化鉴定为同一种菌,故从10株潜在病原菌中选取1株菌株,命名为ND2018,接种于2216E液体培养基中,并在30 ℃条件下培养12 h。将培养好的菌液于3000 r/min条件下离心5 min,将去除上清液的菌液用生理盐水洗脱,制成密度1×103~1×107cfu/mL的菌悬液备用。
试验共设5个试验组和1个对照组,每组桶装海水800 L与健康大黄鱼15~35尾。采用腹腔注射法进行感染试验,试验组设置5组菌液密度,分别为1×107、1×106、1×105、1×104、1×103cfu/mL,对照组采用无菌生理盐水(0.75% NaCl),注射剂量均为0.2 mL/尾。水温控制在18~20 ℃,其间充氧、不投饵、日常清污、换水,连续观察10 d,记录大黄鱼的死亡与发病情况,对死亡大黄鱼进行解剖观察,并再次进行病原菌分离鉴定。
1.9 病原菌全基因测序及分析
取ND2018单个菌落过夜培养。5 mL菌液9000 r/min离心10 min,去除上清液后将样品在干冰条件下委托百迈克生物科技公司进行全基因组测序。基因组数据组装后通过CLC Genomics Workbench 20.0.2软件读取。
1.10 病原菌理化特性试验
参考文献[8]对菌株ND2018进行生理生化鉴定。挑取新鲜的待测单个菌落制成菌悬液加入到试剂条中,根据API-20E生化鉴定试剂盒说明书,将试剂条置于28 ℃培养,24 h进行颜色变化记录,48 h后对颜色变化进行比对和确定。试验结果通过梅里埃API鉴定软件进行分析。
1.11 病原菌药敏试验
参考文献[12]对病原菌进行纸片扩散法药敏试验,取100 μL过夜培养的菌株ND2018菌液与2216E软琼脂(0.8%琼脂)充分混匀,倒入事先制备好的平板,待冷却凝固后贴上不同的药敏纸片,30 ℃培养36 h后参考临床实验室标准化协会抗微生物药物敏感性试验执行标准判定敏感性。
2 结果与分析
2.1 组织病理
观察发病的网箱养殖大黄鱼,病鱼体表无明显症状,偶见溃疡、腹部肿胀,解剖有黄绿色腹水,脾脏、肾脏和肝脏可见明显白色肉芽肿组织结节,直径1.0~2.0 mm(图1)。与正常大黄鱼相比,患病大黄鱼的内脏组织均出现明显病变症状:病鱼肝脏出现炎症反应,大量炎性细胞浸润,将病原菌团包围形成近圆形病灶部位,病灶附近可见大量空泡(图2a);脾脏组织被严重破坏,炎症细胞将病原菌与大量坏死细胞包围形成大小不等的结节,经苏木精—伊红染色为深紫色,髓窦内沉积大量含铁血黄素(图2b);肾脏病变严重,肾小球崩解,肾小管上皮细胞界限模糊、排列紊乱、失去原有结构,部分区域出现病原菌与坏死细胞混合形成的圆形结节(图2c),放大1000倍,可见大量短杆状细菌(图2d)。由此可见,大黄鱼内脏出现结节是由细菌所致。
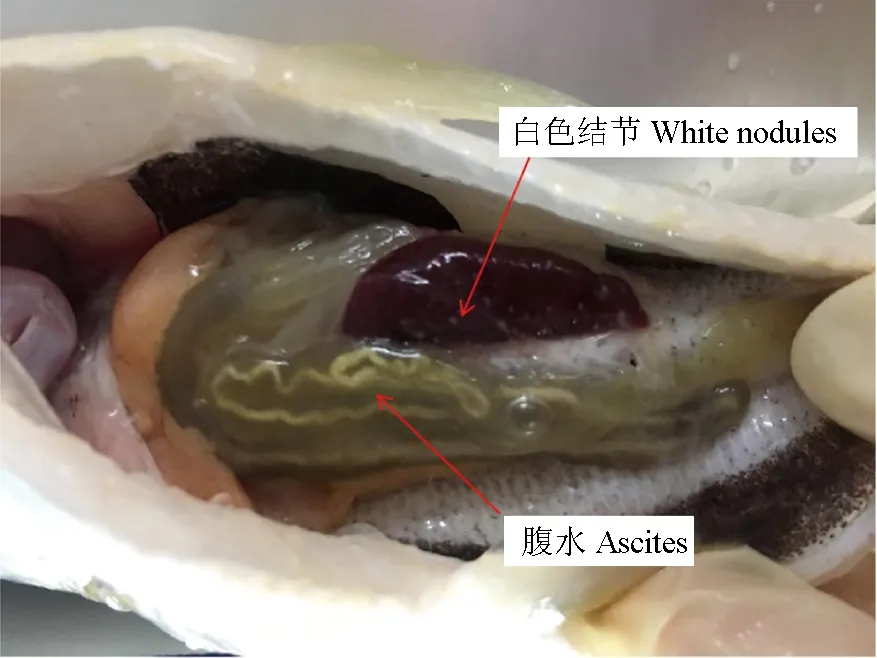
图1 患病大黄鱼内脏白点症状Fig.1 Symptoms of visible white nodules in diseased large yellow croaker P. crocea
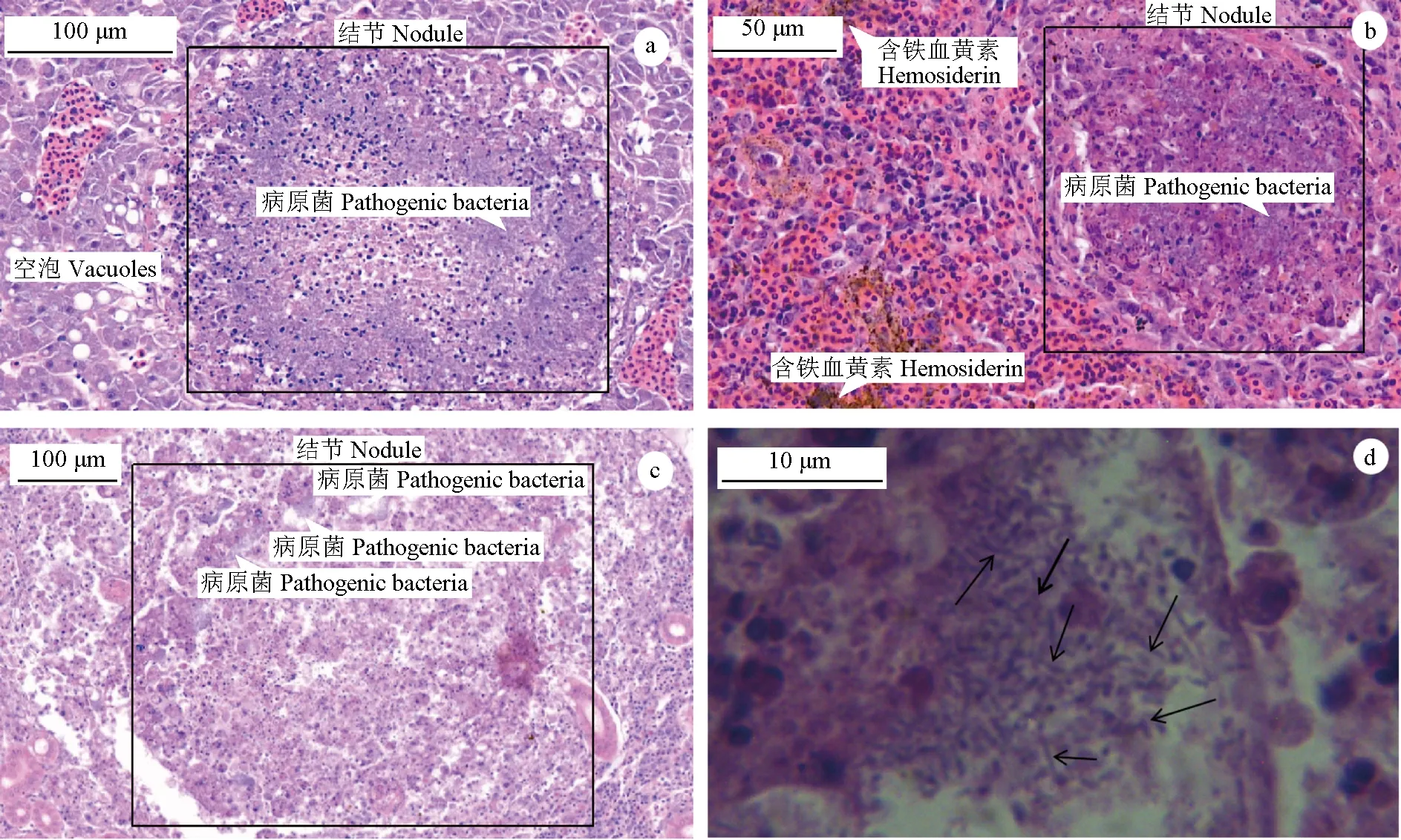
图2 病鱼内脏组织病理变化Fig.2 Pathological changes in visceral tissues in diseased large yellow croaker P. croceaa.病鱼肝脏结节; b.病鱼脾脏结节及含铁血黄素沉积; c.病鱼肾脏结节; d.1000×显微镜下病原菌(箭头所示).a.nodule in liver; b.hemosiderin deposition and nodule in spleen; c.nodule in kidney; d.bacteria inside in flamed tissue under a microscope (arrow) (×1000).
2.2 宏基因测序结果
采用宏基因组测序技术,对健康大黄鱼和发病大黄鱼不同内脏组织以及养殖海水的菌群分布进行对比分析,结果见图3。网箱养殖健康大黄鱼的菌落主要以青枯菌属(Ralstonia)细菌为主,而发病的大黄鱼主要以假单胞菌属(Pseudonomas)细菌为主。这两类菌群均与养殖海水的主要菌群[伯克霍尔德菌(Burkholderia)]存在显著性差异。由此初步判定网箱养殖大黄鱼内脏白点病的病原菌为假单胞菌属细菌。
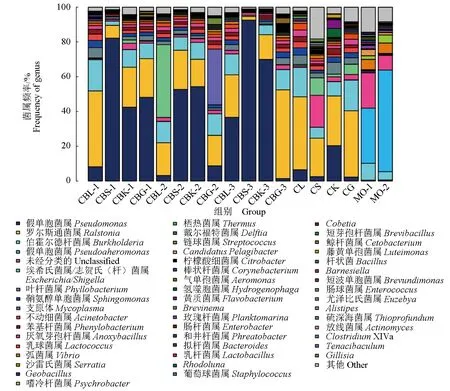
图3 患病、健康大黄鱼以及外界海水的菌群分布Fig.3 Bacterial distribution among diseased and healthy large yellow croaker P. crocea and in sea waterCBL.病鱼的肝脏; CBS.病鱼的脾脏; CBK.病鱼的肾脏; CBG.病鱼的肠道; CL.健康鱼的肝脏; CS.健康鱼的脾脏; CK.健康鱼的肾脏; CG.健康鱼的肠道; MO.自然海水滤膜.CBL.liver of diseased fish; CBS.spleen of diseased fish; CBK.kidney of diseased fish; CBG.gut of diseased fish; CL.liver of healthy fish; CS.spleen of healthy fish; CK.kidney of healthy fish; CG.gut of healthy fish; MO.filter membrane of natural sea water in farming area.
2.3 菌株分离
通过直接培养大黄鱼白色结节病变组织,分离纯化共获得10株菌株。经16S rDNA测序后鉴定该10株菌株与恶臭假单胞菌、变形假单胞菌、荧光假单胞菌(P.fluorescens)、蒙氏假单胞菌(P.monteilii)的同源性均超99%。将上述10株菌株的基因序列进行互相多重对比,结果显示,其同源性均高达99%以上,且10株菌株理化特性结果一致(菌株理化特性见2.6),说明10株分离菌株可能为同一种细菌。
2.4 攻毒试验
用腹腔注射法将菌株ND2018注射到健康大黄鱼体内观察10 d(表1)。试验前期(攻毒1~2 d),死亡的大黄鱼经解剖发现,内脏均未见白色结节,这些鱼类的死亡可能由应激反应所致,因此,该部分非正常死亡数据未计算到结果中。攻毒后期(3~10 d)死亡大黄鱼经解剖发现,内脏组织相继出现白色结节症状,该症状同自然海区网箱养殖大黄鱼发病症状相似,且从病鱼脾脏、肾脏中再次分离的细菌经16S rDNA分子鉴定与菌株ND2018一致。对照组与低密度感染组(1×103cfu/mL)中大黄鱼死亡率与结节出现率相近,死亡率分别为86.0%与84.2%,结节出现率分别为7.1%与10.5%。当菌液感染密度提高时,大黄鱼结节出现比例也增高。菌液密度为1×104cfu/mL时,大黄鱼死亡率为73.3%,结节出现率为20.0%,死亡大黄鱼中结节症状的比例自攻毒8 d起开始增加。当菌液密度高于1×104cfu/mL时,随着密度的增加,死亡大黄鱼出现结节症状的时间更早,结节比例增加更快,大黄鱼存活天数更短。1×105cfu/mL时,大黄鱼死亡率为91.0%,结节出现率为39.4%,结节比例从攻毒6 d起开始增加;1×106cfu/mL时,大黄鱼死亡率为91.2%,结节出现率为53.0%,结节比例从攻毒5 d起开始增加;1×107cfu/mL时,大黄鱼死亡率为100%,结节出现率为63.3%,结节比例从攻毒4 d起开始增加。大黄鱼死亡率与结节出现率均与菌液密度呈显著正向相关,由此可以判定菌株ND2018是大黄鱼内脏白点病的病原菌。
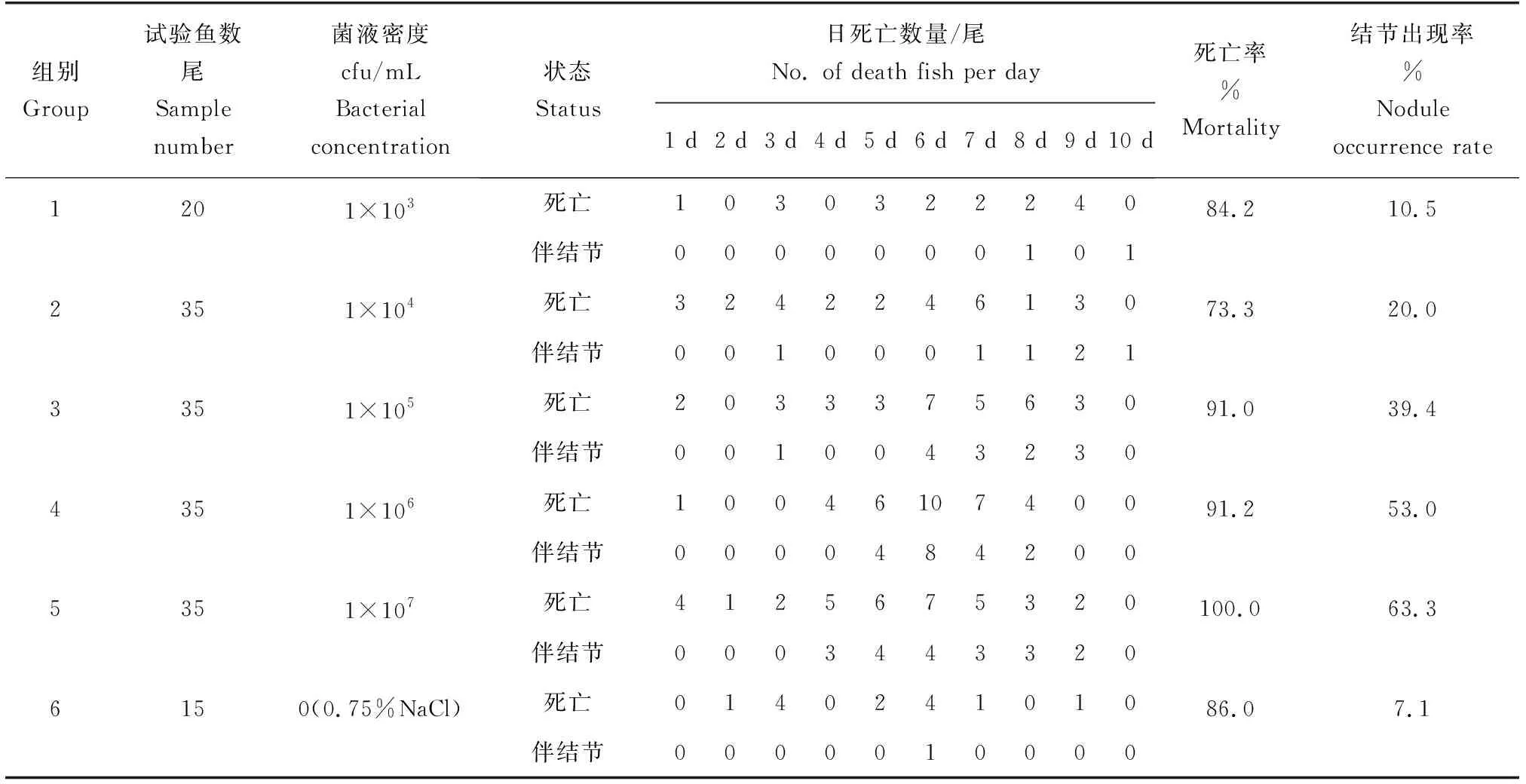
表1 分离菌株ND2018人工感染试验Tab.1 Artificial infection test of isolated strain ND2018
2.5 全基因测序鉴定
为进一步确定引起大黄鱼内脏白点病的病原菌,本试验基于三代测序技术平台,对菌株ND2018进行鉴定。测序结果得到菌株ND2018序列全长约为5.5 Mb,G+C含量为62.7%。与Huang等[16-17]发布的变形假单胞菌NB2011、NZBD9全基因序列的同源性均达到99.9%。同时利用Nr非冗余蛋白质数据库分析得出,菌株ND2018与变形假单胞菌的同源性最高(图4)。因此,可以说明菌株ND2018为变形假单胞菌。
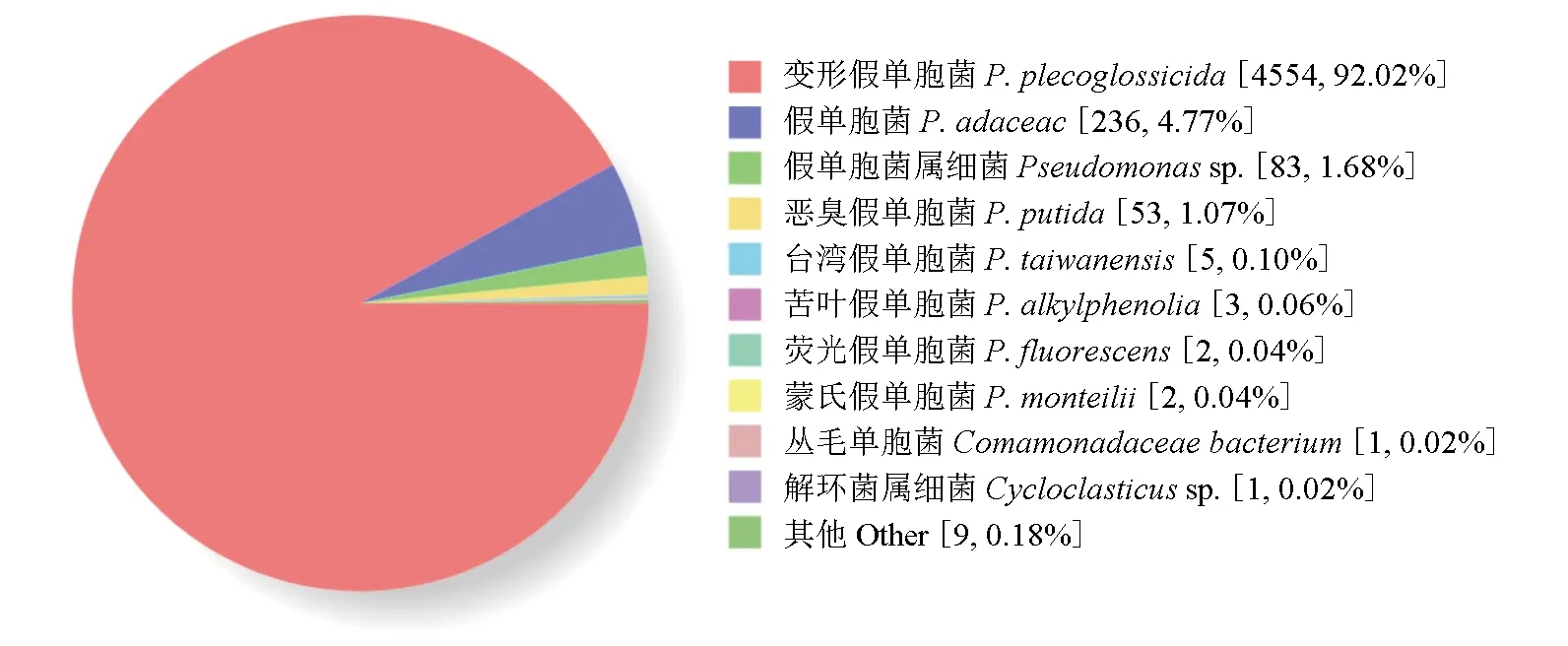
图4 菌株ND2018的Nr数据库同源物种分布Fig.4 Nr homologous species distribution of strain ND2018
2.6 理化特性
利用API方法对变形假单胞菌ND2018进行生理生化反应分析。试验结果显示(表2),变形假单胞菌ND2018利用柠檬酸钠盐,精氨酸水解酶呈阳性,羟基丁酮产生乙酰甲基甲醇反应呈阳性,氧化酶呈阳性,硝酸盐还原呈阳性,半乳糖苷酸、鸟氨酸、吲哚等反应呈阴性。这些代谢能力均符合假单胞菌属细菌的生化代谢特性。经法国梅里埃API-20E鉴定软件分析,分离菌株与荧光假单胞菌或恶臭假单胞菌的阳性率为94.1%。

表2 变形假单胞菌ND2018的生理生化特性Tab.2 Biochemical and physiological characteristics of strain ND2018
2.7 药敏试验
变形假单胞菌ND2018药敏试验涉及糖肽类、脂肽类、磺胺类、氯霉素类、氨基糖苷类、氟喹诺酮类、青霉素类、四环素类、大环内酯类、硝基呋喃类、安沙霉素类、香豆素类共12类26种抗生素,其中包括国务院兽医行政管理部门批准的水产用兽药。结果显示,变形假单胞菌ND2018对氨基糖苷类的新霉素、卡那霉素,硝基呋喃类的呋喃唑酮,氟喹诺酮类的环丙沙星,磺胺类的复方磺胺,以及脂肽类的多黏菌素B敏感,对利福平等20种抗生素耐药(表3)。变形假单胞菌ND2018对同类中的不同抗生素药物敏感性存在差异,如氟喹诺酮类对菌株的抑菌圈直径均大于药敏片自身直径(7.0 mm),其中环丙沙星抑菌圈直径最大,但根据标准抑菌圈直径判定,变形假单胞菌ND2018只对环丙沙星敏感,对恩诺沙星、氧氟沙星等其他氟喹诺酮类耐药。
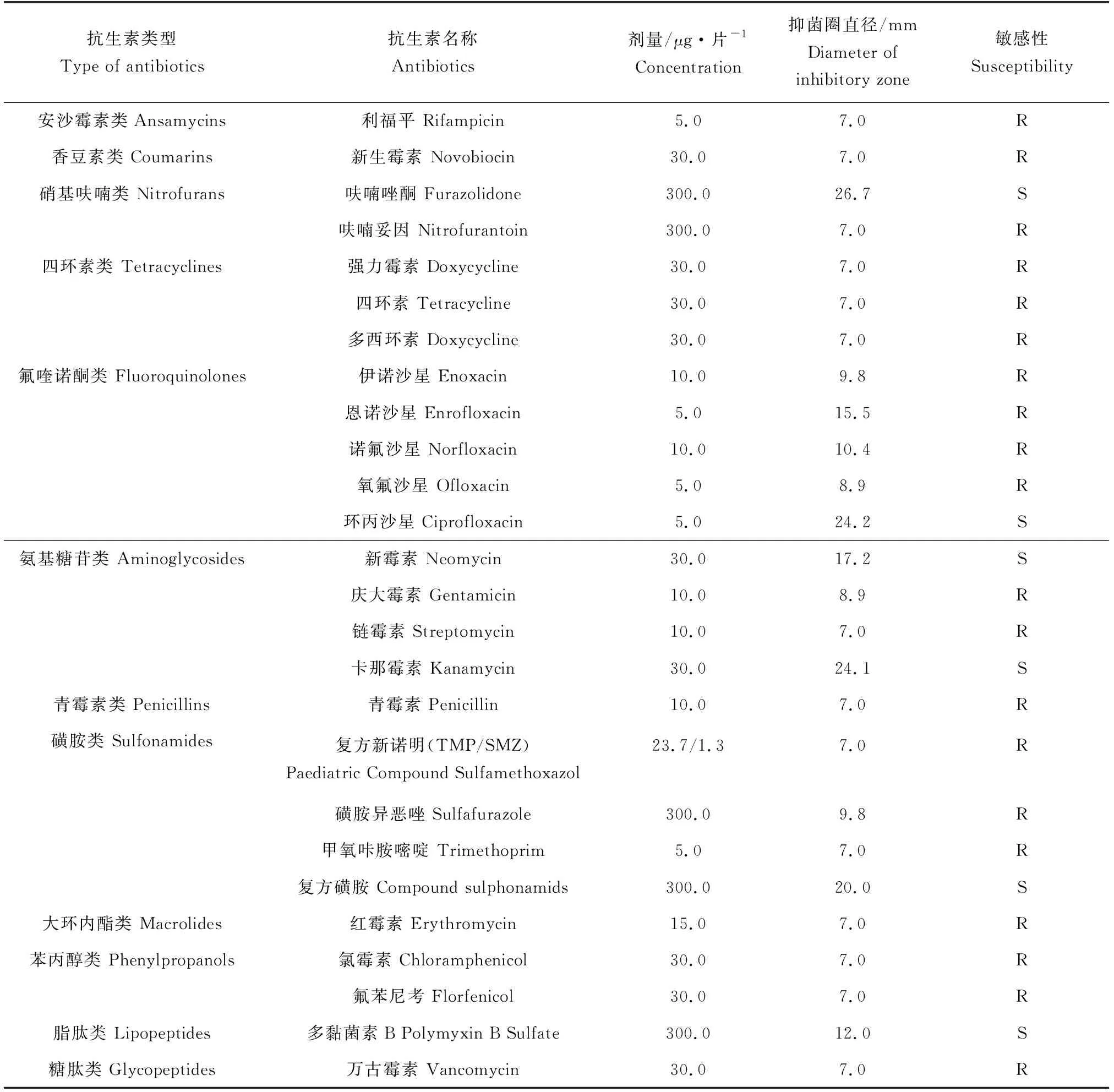
表3 变形假单胞菌ND2018的药物敏感性试验结果Tab.3 Antibiotic susceptibility test of strain ND2018
3 讨 论
3.1 网箱养殖大黄鱼内脏白点病病原菌鉴定
近年来,我国东海海域大黄鱼养殖屡现内脏白点病,其高死亡率导致大黄鱼产业损失惨重[18]。因此,分离鉴定引起大黄鱼内脏白点病的病原菌对大黄鱼养殖产业有一定保护作用。许多学者对大黄鱼内脏白点病进行了病原菌分离鉴定,但分离鉴定结果存在一定分歧。早期研究认为其病原菌为铜绿假单胞菌[2],后期研究一部分认为是恶臭假单胞菌[4-9],另一部分研究认为其病原菌为变形假单胞菌,因其最早是从香鱼(Plecoglossusaltivelis)中分离鉴定的一个新种,故又称杀香鱼假单胞菌(P.plecoglossicida)[10-15]。本试验首次利用宏基因组测序技术,避免采样过程中造成的污染以及病原菌人工培养分离过程中的偏差等问题,增加了大黄鱼内脏白点病病原菌鉴定结果的可靠性。同时,通过全基因测序对菌株ND2018进行鉴定,确定其为变形假单胞菌,结合传统鉴定方法(如16S rRNA和生理生化反应等),提高了鉴定结果的准确性。
3.2 病原菌的毒力结果分析
试验组与对照组死亡率较高,均出现无结节症状死亡情况,这可能是由于其他应激反应导致的非正常死亡,不能直接判定为病原菌导致的死亡。但是随着菌液密度的升高,试验组中大黄鱼出现结节症状的比例显著增加,结节出现率与菌液密度呈显著正相关。因此即使存在非病原菌导致的死亡现象,仍能说明攻毒用菌是大黄鱼内脏白点病的病原菌。本试验通过计算结节出现率代替死亡率作为细菌致病性判定标准,避免了系统误差,增加了数据的可信度。值得注意的是,大黄鱼内脏白点病发病时间随着菌液密度的升高逐步缩短,高密度组在早期就出现大规模死亡现象,1×106cfu/mL和1×107cfu/mL试验组中大黄鱼分别在攻毒的第4天和第5天开始出现大规模死亡现象,且结节出现率高于50.0%。而104cfu/mL试验组在攻毒第9天时才出现大规模死亡情况,低密度试验组(1×103cfu/mL)出现死亡情况不明显,说明病原菌密度是影响大黄鱼内脏白点病的关键,随着时间推移,鱼体内病原菌大量繁殖,密度增加,病原菌突破宿主防线,病鱼内脏出现肉芽肿结节,致病性得到体现。
本试验对照组中出现零星白色结节症状病鱼,与低密度试验组(1×103cfu/mL)的结节出现率相当,由此推测部分攻毒试验所用的健康大黄鱼体内携带有低密度(不表现致病性)的变形假单胞菌,此推测与宏基因组测序结果相吻合。宏基因组测序结果显示,自然海水与健康大黄鱼体内也有变形假单胞菌分布,进一步推测变形假单胞菌为条件致病菌,广泛分布于自然海水和健康大黄鱼内脏中。在一定条件下,当鱼体免疫力下降,菌群失衡,变形假单胞菌大量暴发,在密度达到1×104cfu/mL以上时,毒力增强,内脏出现白色结节,致病性得到体现,而当病原菌密度较低时,不表现出致病性,可以同宿主共生。从试验前期采集样本和数据情况看,大黄鱼内脏白点病多暴发于冬末春初,由于养殖海域水温低(14~18 ℃)[2],大黄鱼摄食能力降低,鱼体免疫力减弱,导致变形假单胞菌大量生长,通过血液循环进入脾脏、肾脏和肝脏等器官,组织病理观察发现,受病原菌入侵的靶器官组织结构病变严重,组织崩解,含铁血黄素沉积,大量变形假单胞菌在细胞间积聚,入侵细胞内部,造成鱼体生理代谢紊乱,最终导致鱼体无法维持正常生命活动而死亡,该结论与张丹枫等[19]的研究结论一致。
3.3 病原菌的理化特性与耐药性结果分析
本试验分离的变形假单胞ND2018与近年来不同学者分离的病原菌相似[10-15],但在理化特性与耐药性上存在差异。理化特性上与许斌福等[8]分离的变形假单胞菌H2013032002相比,变形假单胞ND2018多了一个羟基丁酮产生乙酰甲基甲醇指标呈阳性,与刘年锋等[15]分离的变形假单胞菌dhy201308不同的是葡萄糖氧化呈阴性,说明同一种属细菌内的不同菌株在不同生长环境中存在一定差异。这可能导致病原菌代谢情况出现突变,从而加速病原菌正向或者反向进化。病原菌获取和重组外源DNA通常会引起菌株产生耐药性。胡娇等[12]从宁德渔排分离的变形假单胞菌对庆大霉素、诺氟沙星、氧氟沙星、依诺沙星、强力霉素、链霉素、四环素等7种药物敏感;刘年锋等[15]从福州养殖网箱分离的变形假单胞菌对强力霉素、诺氟沙星、恩诺沙星、奥氟沙星与四环素敏感;相比之下,变形假单胞ND2018耐药谱最广,对强力霉素、庆大霉素、链霉素、四环素以及大部分氟喹诺酮类不敏感,其中最为显著的是氟喹诺酮类抗生素。与已有研究不同,本试验分离的菌株ND2018除了对环丙沙星敏感,对氧氟沙星、恩诺沙星、依诺沙星等氟喹诺酮类抗生素均不敏感,这说明变形假单胞菌ND2018对氟喹诺酮类抗生素产生了耐药性。原因可能为:2017年之前,氧氟沙星、诺氟沙星等氟喹诺酮类抗生素不属于水产禁用药,生产过程中大量使用致使病原菌产生耐药性。变形假单胞菌ND2018对新霉素、卡那霉素、呋喃唑酮、环丙沙星、复方磺胺以及多黏菌素B敏感,根据农业农村部制定发布的《水产养殖用药明白纸2019年1号》以及NY 5071—2002《无公害食品渔用药物使用准则》文件,呋喃唑酮、环丙沙星属于水产养殖禁药;根据《水产养殖用药明白纸2019年2号》批准水产用药名单,国务院兽医行政部门已批准的水产用药总共5类12种,而变形假单胞ND2018对其中的氟苯尼考、多西环素、恩诺沙星均不敏感,而变形假单胞菌ND2018敏感的多黏菌素B和卡那霉素又非常用水产养殖兽用药。病原菌的耐药性以及水产用药抗生素的局限性使得水产养殖动物在疾病暴发过程中用药无效,无药可用,给水产养殖产业带来巨大挑战,因此寻求能够代替抗生素治疗大黄鱼内脏白点病的健康药物迫在眉睫。
4 结 论
本试验首次通过宏基因组测序技术对患病大黄鱼内脏组织中菌落变化进行比较,并对病原菌进行全基因组序列分析,最终确定内脏白点病病原菌为变形假单胞菌。变形假单胞菌为条件病原菌,其菌液密度是导致大黄鱼内脏白点病的关键,当密度高于1×104cfu/mL时,病原菌突破宿主防线,病鱼内脏出现肉芽肿白色结节,即患内脏白点病。定期对大黄鱼体内变形假单胞菌进行定量分析,适时对细菌增长进行干预,可为大黄鱼内脏白点病早期预防提供新方案。药敏试验结果显示,变形假单胞菌ND2018对水产常用药氟苯尼考、多西环素、恩诺沙星等产生耐药性,依赖抗生素对内脏白点病进行防控效果不佳,同时抗生素药物残留影响水产品质量安全,给水产养殖产业带来巨大挑战。因此在水产养殖过程中应注重科学防范,改善养殖环境,提高鱼体免疫力,同时要深入开发新药物,减少病害治疗中抗生素的使用,走健康可持续养殖道路。
