上皮细胞转化序列2在甲状腺乳头状癌中的表达研究
2021-09-19权明明陈珍珍王毅超
权明明 陈珍珍 王毅超
甲状腺癌是内分泌系统常见的恶性肿瘤之一,它常见的病理类型有4种,分别为乳头状癌、滤泡状癌、髓样癌、未分化癌,其中甲状腺乳头状癌是最常见的病理类型[1]。虽然甲状腺乳头状癌是预后良好的恶性肿瘤,但临床上仍有部分甲状腺乳头状癌患者预后欠佳[2]。上皮细胞转化序列2(epithelial cell transforming 2,ECT2)基因是上皮细胞转化序列基因的一种,已经证实其是一种原癌基因,在多种恶性肿瘤组织中高表达[3-4]。临床上对于ECT2基因在甲状腺癌中的表达研究报道不多。基于此,本研究分析ECT2在甲状腺乳头状癌的表达情况,以期为甲状腺乳头状癌早期诊断提供分子生物学依据,现报道如下。
1 材料和方法
1.1 材料
1.1.1 组织样本 甲状腺乳头状癌组织及结节性甲状腺肿组织均取自2020年5至12月于台州市中心医院手术切除的标本,且所有标本获取均经患者知情同意,患者术前均未行化疗、放疗、内分泌治疗,病理结果均经2位病理科医生判读。甲状腺乳头状癌组织标本35例,患者男 5 例,女 30 例,年龄 32~57(44.5±1.92)岁;结节性甲状腺肿组织标本32例,患者男7例,女25例,年龄31~67(48.7±1.37)岁。两种组织标本患者性别、年龄比较差异均无统计学意义(均P>0.05)。术后所有标本一半立即存入-80℃冰箱,一半立即置于甲醛溶液中固定,取材体积均约5 mm×5 mm×5 mm。本研究经医院医学伦理委员会批准(批件号:2021L02-16)。
1.1.2 主要试剂和仪器 ECT2基因引物由上海捷瑞生物工程有限公司合成,Trizol RNA提取试剂购自美国Invitrogen 公司(批号:15596026);Real Maste rMix(SYBR Green)试剂盒购自日本 TakaRa公司(批号:RR066A);ECT2抗体购自美国Cell Signaling Technology公司(批号:1627591),DAB显色试剂盒购自美国BD公司(批号:550880),PCR 仪为美国 ABI公司产品(型号:Stepone),垂直电泳槽及转膜槽为北京六一仪器厂产品。
1.2 方法
1.2.1 ECT2 mRNA表达水平检测 采用RT-PCR法。设计ECT2基因引物,取存于-80℃冰箱中的甲状腺乳头状癌组织及结节性甲状腺肿组织,剪碎,每例标本重约 80 mg,采用 Trizol提取细胞中总RNA,用紫外分光光度计测定RNA的浓度和纯度,要求A260/A280=1.8~2.0,并在1%琼脂糖凝胶电泳中显示出清晰的28 S和18 S两条rRNA带,证明提取的RNA完整。cDNA合成反应体系:取 2 g RNA ,加 2 μl×RT mix(终浓度为 1×),2 μl dNTP混合液(终浓度为 0.25 mmol/L/dNTP),2 μl Oligo-dT15(终浓度为 1 μmol/L),1 μl逆转录酶,加 RNase Free ddH2O 至终体积20 μl,于 37℃孵育 60 min。采用SYBR Green荧光染料,参照试剂盒说明完成RT-PCR,反应条件为:预变性95℃ 1.5 min,95℃ 15 s、65℃30 s、68 ℃ 30 s 40个循环;最后 95 ℃ 15 s,60 ℃ 1 min,95℃15 s收集荧光信号,进行熔解曲线分析,以结节性甲状腺肿组织为参照,反应结束由系统自动计算相对定量结果。
1.2.2 ECT2蛋白表达定性检测 采用免疫组化法。分别取甲醛溶液浸泡的甲状腺乳头状癌组织及结节性甲状腺肿组织,置于恒温烤箱中60℃烘烤20 min,将组织玻片依次放入二甲苯溶液浸泡15 min脱蜡,再经不同梯度乙醇(100%乙醇,95%乙醇,80%乙醇,70%乙醇)和ddH2O各5 min水化。将合适的抗原修复缓冲液(枸橼酸钠缓冲液pH 6.0)加入高压锅内煮沸,将组织切片置于抗原修复沸水缓冲液中进行高压修复抗原,电炉加热10 min后去除热源,打开高压锅锅盖,利用凉水冷却10 min,冷却完成后PBS洗涤2遍,各5 min。因组织切片中可能含有大量的具有活性的过氧化物酶,本研究选择滴加3%的双氧水室温静置10 min以去除内源性过氧化物酶,以防对组织结构和细胞形态产生不良影响,反应结束后PBS洗涤2次各5 min。取出并擦干组织切片,滴加10%的山羊血清封闭液在玻片上,室温封闭0.5~1 h,以减少非特异性结合造成的染色。结束后PBS洗涤2遍,各5 min。一抗孵育:取出玻片并擦去多余液体,滴加实验所需的ECT2抗体(1∶200),置于湿盒中4℃冰箱孵育过夜。第2天取用前需先甩干,并用PBS充分洗涤3次,每次5 min。二抗孵育:洗净后每片滴加50 μl辣根过氧化物酶标记的羊抗兔IgG抗体,在室温孵育30~60 min,PBS洗涤,每次5 min,重复共3次。DAB显色:滴加现配的DAB显色剂,于显微镜下掌握染色程度,可用自来水冲洗终止反应。复染:苏木精复染1~2 min,并用PBS洗净。脱水透明:依次放入不同梯度乙醇各5 min脱水,最后放置于二甲苯溶液各5 min进行透明处理。封片:用滴管吸取中性树胶进行封片操作,待玻片树胶凝固后,显微镜观察结果并拍照分析目的蛋白表达情况。免疫组化结果判断标准:以阳性细胞所占视野内细胞总数的百分比和细胞着色强度进行计分,根据阳性细胞所占百分比按<5%、5%~<25%、25%~<50%、50%~<75%和≥75%依次计分为 0、1、2、3和 4分,所记得分≤1分为阴性表达,≥2分为阳性表达。
1.2.3 ECT2蛋白表达定量检测 采用Western blot法。分别取-80℃冰箱中的甲状腺乳头状癌组织及结节性甲状腺肿组织,每例约80 mg,加入组织蛋白提取液,冰上研磨,蛋白提取按试剂说明书进行,吸取上清液。每例标本取20 μl用BCA法测蛋白浓度,根据蛋白质曲线计算电泳所需蛋白,配置10%浓缩胶和5%的分离胶,上样量每孔为 50 μg,标准蛋白 Marker为 5 μl,80~120 V电泳,恒压10 V 1 h转膜至硝基纤维膜上,5%脱脂奶粉封闭2 h,加入一抗2 ml(ECT2抗体浓度1∶1 000)4℃冰箱过夜,加入二抗(辣根过氧化物酶标记的山羊抗兔IgG抗体,浓度为1∶5 000)室温静置 1.5 h,ECL发光液滴加。暗室曝光显影定影,计算机软件分析蛋白表达水平。
1.3 统计学处理 采用SPSS 22.0统计软件,每个实验至少进行3次重复实验。计量资料以表示,组间比较采用两独立样本t检验;计数资料以频数和构成比表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 甲状腺乳头状癌组织与结节性甲状腺肿组织ECT2 mRNA表达水平比较 相对于结节性甲状腺肿组织,ECT2 mRNA在甲状腺乳头状癌组织中的表达水平为2.4327±0.0127,两者比较差异有统计学意义(P<0.05)。即甲状腺乳头状癌组织ECT2 mRNA表达上调。
2.2 甲状腺乳头状癌组织与结节性甲状腺肿组织ECT2蛋白表达阳性率比较 甲状腺乳头状癌组织与结节性甲状腺肿组织ECT2蛋白表达情况见图1(插页)。甲状腺乳头状癌组织与结节性甲状腺肿组织ECT2蛋白表达阳性率分别为 57.1%(20/35)、6.3%(2/32),甲状腺乳头状癌组织表达阳性率明显高于结节性甲状腺肿组织,差异有统计学意义(P<0.05)。
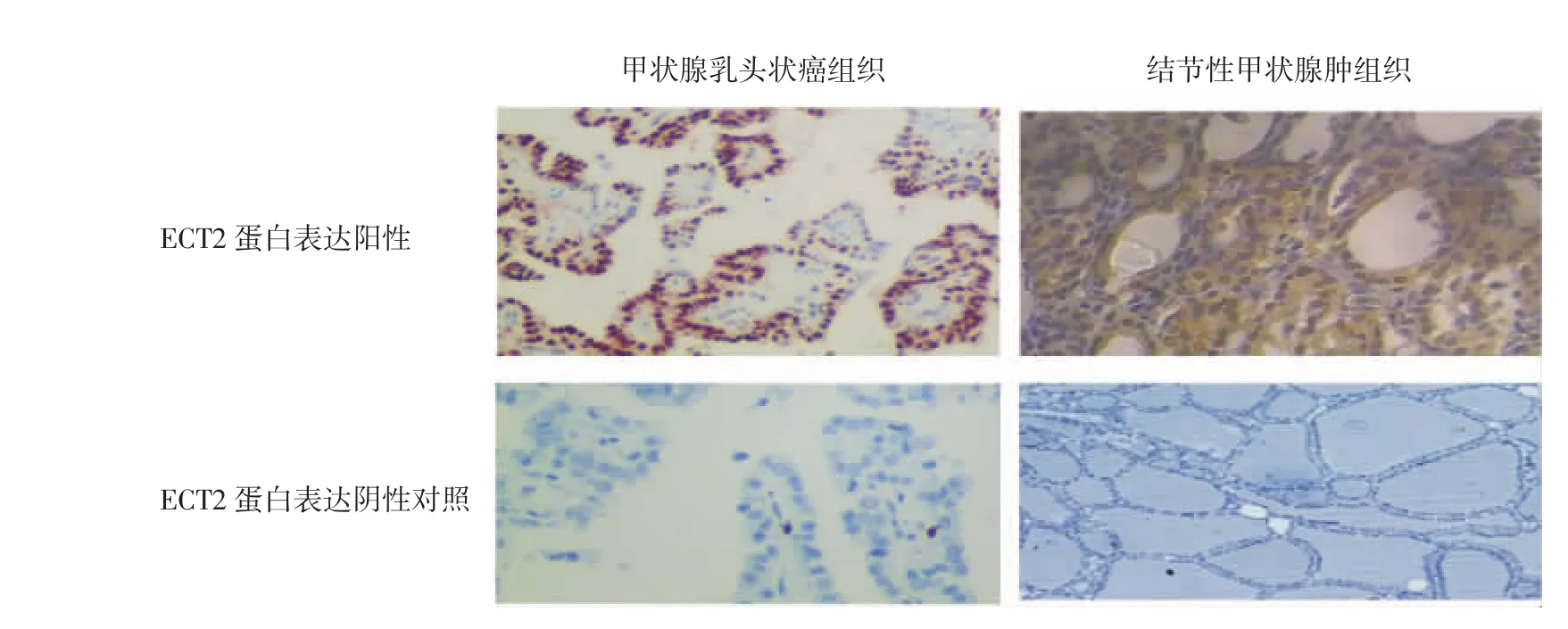
图1 甲状腺乳头状癌组织与结节性甲状腺肿组织上皮细胞转化序列2(ECT2)蛋白表达定性观察(免疫组化染色,×40)
2.3 甲状腺乳头状癌组织与结节性甲状腺肿组织ECT2蛋白表达水平比较 甲状腺乳头状癌组织与结节性甲状腺肿组织ECT2蛋白表达水平分别为1.6542±0.0159、0.4826±0.0513,两者比较差异有统计学意义(P<0.05)。即相对于结节性甲状腺肿组织,甲状腺乳头状癌组织ECT2蛋白表达水平上调,见图2。

图2 甲状腺乳头状癌组织与结节性甲状腺肿组织上皮细胞转化序列2(ECT2)蛋白表达电泳图比较(1、2:甲状腺乳头状癌组织;3、5:结节性甲状腺肿组织;4:内参蛋白)
3 讨论
近年来,甲状腺癌发病率逐年提高,尤其是甲状腺乳头状癌发病率日益增高,甲状腺癌发病率约占恶性肿瘤发病率的1%,发达国家高于发展中国家[5-7]。甲状腺乳头状癌发病机制尚不明确,可能与癌基因突变、碘剂量、电离辐射、遗传等因素有关,并且甲状腺乳头状癌的发病与多个基因相关。
ECT2基因是一种鸟苷酸交换因子,研究证实其与多种恶性肿瘤发病相关,在人类染色体定位于3q26,进化上高度保守,已经被确定为原癌基因。ECT基因N端有两个同源结构域XCCR1和Clb6,在细胞周期调控及免疫应答上发挥作用,通过对细胞周期的调控,可以动态控制肿瘤的生长[8-11]。ECT2基因在恶性肿瘤发展中起重要作用,在一项对肺癌的研究中,高表达的ECT2与肺癌转移的晚期和更深的肿瘤侵袭相关[10]。此外,ECT2高表达的肺癌患者总生存期明显短于ECT2低表达的肺癌患者,Cox回归分析显示,ECT2表达是总生存期的独立预后指标[12]。在胃癌中也有类似的发现,ECT2在胃癌中表达量明显高于对照组,高表达ECT2的胃癌,其增殖能力及侵袭能力也逐步增强,并且这种上调与肿瘤的上皮间质转化相关[9]。在胰腺癌组织中,与对照组相比ECT2蛋白同样高表达,ECT2的表达量与胰腺癌的恶性程度、病例分期密切相关,数据分析表明ECT2基因是胰腺癌的独立预后因子[13]。在一项关于乳腺癌的研究中发现采用免疫组化、细胞迁移、异种移植方法检测ECT2在乳腺癌中的表达情况,ECT2在物理上与泛素特异性蛋白酶USP7相互作用,并在功能上促进USP7分子间自结合,支持将ECT2/USP7作为乳腺癌干预的潜在靶点[14]。而在另外一项研究中,采用构建慢病毒ECT2过表达和干扰质粒用于体外检测。采用CCK-8等方法评价ECT2表达对三阴性乳腺癌细胞系的影响,ECT2是乳腺癌细胞生长的主要驱动因子,在调节三阴性乳腺癌生长中起着重要作用。PTX治疗在沉默ECT2后显著改善疗效。这一发现提示,抑制ECT2的表达可促进乳腺癌治疗的新方案,并为开发新的靶向药物替代紫杉醇治疗乳腺癌提供理论依据[15]。同样一项关于乳腺癌的研究中证实ECT2是乳腺癌不良预后的因子[16-17]。关于一项肝细胞癌的研究中,ECT2高表达被发现是肝细胞肝癌的独立预后危险因素,发现ECT2过表达增加了肝癌细胞的迁移和增殖,ECT2可能通过增强有氧糖酵解和抑制免疫细胞功能来促进M2巨噬细胞的极化。ECT2可作为肝细胞肝癌的候选诊断和预后生物标志物[18]。
本研究结果表明ECT2在甲状腺乳头状癌组织及结节性甲状腺肿组织均表达,结果采用相对定量方法计算,ECT2基因在甲状腺乳头状癌组织相对于结节性甲状腺肿组织的表达量为2.4327±0.0127,差异有统计学意义。免疫组化法检测结果显示,在甲状腺乳头状癌组织表达阳性率明显高于结节性甲状腺肿组织。这结果提示,ECT2在甲状腺乳头状癌高表达,其在甲状腺乳头状癌的发生、发展中起癌基因作用。关于ECT2基因研究,已经证实在多种恶性肿瘤中高表达,其具体高表达的机制尚无法解释。有研究表明ECT2基因在脑胶质瘤中是通过泛素化发挥作用[19],而ECT2基因作为癌基因在甲状腺乳头状癌中如何发挥作用,是否与泛素化有关,值得进一步研究。也有研究证实ECT2基因在雌激素受体阳性乳腺癌及非小细胞肺癌中均是预后不良的独立因子[20-21]。笔者团队拟下一步在细胞水平、动物水平进一步使用siRNA进行调控,以期进一步研究ECT2基因发挥癌基因的机制,为甲状腺乳头状癌的早期诊断、早期干预抑或肿瘤标志物提供客观的分子生物学依据。
