血小板内皮聚集受体1影响血小板功能和血栓形成的研究进展
2021-09-19李占军孙建军
李占军,冬 颖,周 佳,孙建军
(1.内蒙古化工职业学院,内蒙古 呼和浩特 010057;2.内蒙古医科大学附属医院 药剂科)
血小板是巨核细胞的细胞质脱落而形成的无核血细胞,它在正常止血过程中起着关键作用,同时也是促成血栓相关疾病的重要因素。随着人们生活水平的不断提高,动脉粥样硬化的临床发病率逐年上升,患有这些疾病的患者表现出较强的血小板活性,导致脉管系统的血栓前状态,增加心脑血管事件的复发率[1]。然而,血小板活性不仅仅能够影响正常的血栓形成和止血,而且还能产生相应的炎症反应,是动脉粥样硬化的始动因素之一[2],血小板通过活化、粘附、聚集、血小板相关因子释放和凝血系统的激活等方式在动脉粥样硬化血栓形成和发展的过程中起着重要作用[3]。
1 抗血小板药物疗效差异引发血小板基因多态性研究
目前,阿司匹林和氯吡格雷双联抗血小板治疗方案已广泛应用于心、脑血管疾病的一级和二级预防,已被国内外指南所推荐[4~6]。一项纳入了13.5万患者,275项随机对照试验的大型荟萃分析显示[7],抗血小板药物能显著降低不良心血管事件的发生率。然而,在抗血小板药物治疗期间血小板聚集性显示出较大的个体差异。部分患者不能从抗血小板药物如阿司匹林和(或)氯吡格雷中获得足够的血小板抑制,出现治疗中血小板高反应性(high ontreatment platelet reactivity,HTPR),导致不良临床缺血事件的发生,而另一部分患者对抗血小板药物表现出过度响应,出现治疗中血小板低反应性(low on-treatment platelet reactivity,LTPR),导致出血事件的发生[8]。基因组相关研究已经证实血小板多个基因位点与心血管疾病易感性和血小板功能相关,血小板相关基因多态性与抗血小板药物的疗效有着密切的联系,研究和发现其作用和机制可用于指导新的治疗和诊断分析的发展。
2 PEAR1影响血小板功能的表达方式
血小板内皮聚集受体1(platelet endothelial aggregation receptor-1,PEAR1)基因是近期发现的调控血小板功能的重要基因,PEAR1相关的基因多态性在多个独立的研究中经证实与血小板激动剂的响应有关[9],与血小板功能及血栓性疾病的发生发展有着密切的联系。它在2005年被发现,是一种含有1034个氨基酸的跨膜蛋白,主要在巨核细胞、血小板和内皮细胞上表达。PEAR1包含胞外EMI结构域(蛋白-蛋白相互作用区域),15个类似表皮生长因子的重复序列及胞质内多个酪氨酸和脯氨酸残基组成[10]。在血小板聚集期间,细胞质内的酪氨酸磷酸化使PEAR1活化,来自相邻血小板的免疫球蛋白E受体的α亚基(FcεR1α)蔟集PEAR1,也是一个启动PEAR1磷酸化的过程[11]。目前,PEAR1存在两种活化方式,一种通过血小板-血小板相互接触活化PEAR1,另一种则是PEAR1诱导Src依赖的受体磷酸化,磷酸二酰肌醇3-激酶(phosphatydilinositol 3-kinase,PI3K)p85亚基的活化及随后的蛋白激酶B(protein kinase B,Akt)的磷酸化,进而加强纤维蛋白原受体(αIIbβ3)的活化,形成了稳定的血小板聚集体[12]。PEAR1通过PI3K/PTEN通路负调控巨核细胞的增殖[13],减弱PEAR1表达能增加内皮细胞的增殖和新生血管的生成[14]。
3 PEAR1影响血小板功能的研究进展
3.1 PEAR1表达程度对血小板生成具密切影响的相关研究
Alexandre Kauskot等研究[12]探索健康人群血小板PEAR1的功能。研究发现通过多种激动剂诱导血小板聚集期间,PEAR1在细胞膜上表达和酪氨酸磷酸化增加。静息态的血小板中,在细胞质内PEAR1尾部发现c-Src和Fyn复合物,当它磷酸化时,磷酸化的PEAR1导致渐进的PI3K和Akt持续的磷酸化,与p85 PI3K偶联并逐渐位移到血小板细胞骨架上,整合素活化信号被放大,进而形成稳定的血小板聚集体,全部信号瀑布能被SFK抑制剂PP1和PI3K抑制剂LY294002所阻断。同时,该团队[13]还研究了PEAR1在血小板形成过程中的作用。他们监测和操控体外分化的人CD34+造血干细胞和在斑马鱼体内PEAR1的表达情况。PEAR1基因低表达导致PTEN表达降低2倍,同时调控PI3K-Akt通路相关基因的表达。斑马鱼蛋白印迹结果揭示PEAR1的低表达提升了Akt的磷酸化水平,同时使PTEN的转录下调。研究提示在巨核细胞中减弱PEAR1的表达会促进巨核细胞的增殖,间接增强了巨核细胞和血小板的生成。
3.2 影响PEAR1表达的信号通路研究
此外,Christophe等[15]发现硫酸葡聚糖能直接活化PEAR1引起浓度依赖的血小板聚集。阻断PEAR1受体,选择性Syk抑制剂能完全消除硫酸葡聚糖诱导的血小板聚集,并且用Pear1小鼠模型验证。结果表明硫酸葡聚糖诱导的血小板聚集通过Pear1/c-Src/PI3K/Akt和CLEC-2/Syk信 号 通 路 独 立完成的。
同时,PEAR1基因在内皮细胞上表达。Christophe等研究[14]发现在培养的内皮细胞中慢病毒敲弱PEAR1可增强内皮细胞增殖,显著刺激内皮细胞的迁移,反过来通过Akt/PTEN依赖的p21/CDC2信号通路增强体外基质胶上管腔的形成,此实验用Pear1敲除小鼠实验模型验证。结果证实PEAR1基因在内皮细胞的表达对体内、体外的血管生成有着负调控的关系。这些发现也说明PEAR1是一种新型的血管生成的调节器。
信号酪氨酸激酶受体通过活性的促细胞分裂蛋白激酶(MAPKs)和PI3K/Akt这2个通路完成内皮细胞增殖。Christophe等[14]发现PEAR1低表达不影响Erk1/2的磷酸化。同时Pear1敲除小鼠的肉芽肿组织的蛋白印迹分析结果表明Pear1正调控mCD31、mAkt-P和mCdc2,PEAR1主要通路(见图1)。
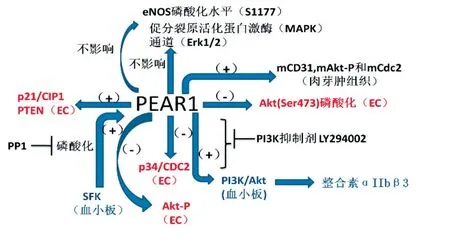
图1 PEAR1基因主要的信号通路Fig.1 The main signal pathway of PEAR1
3.3 PEAR1表达对血小板功能的影响存在争议
多个全基因组关联研究(Genome-Wide-Association-Studies,GWAS)发现在健康人群和心血管疾病患者人群PEAR1单核苷酸多态性(SNPs)能改变血小板聚集能力,这种变化与PEAR1表达有关[16~21]。这些研究结果表明PEAR1参与了血栓形成和血小板功能。但是,有些研究表明PEAR1基因多态性没有影响血小板聚集性和临床结局[23]。
阿司匹林被国内外指南所推荐广泛应用于心肌梗死和卒中的一级和二级预防[4,5],能有效的降低15%~20%的心血管事件的发生率[5],同时,阿司匹林联合氯吡格雷的治疗方案已经成为急性冠脉综合征(acute coronary syndrome,ACS)行经皮冠状动脉介入(percutaneous coronary intervention,PCI)抗血小板药物治疗的基石[4]。但在临床实践中发现服用阿司匹林和氯吡格雷的患者仍出现复发的缺血事件,这主要由于药物对血小板聚集的抑制不足所导致[8],而这种对药物的响应多取决于基因的多态性。
一些研究报道了人群PEAR1基因与血栓栓塞性疾病存在一定的联系。Juraj Sokol等研究[25]纳入23例有流产史的粘性血小板综合征的女性患者,42例健康女性作为对照组,评估PEAR1基因2个SNP(rs12041331,rs12566888)和GAS6基因4个SNPs(rs7400002,rs1803628,rs8191974,rs9550270)与粘性血小板综合征的关系。研究发现PEAR1基因2个SNPs(rs12041331,rs12566888)和GAS6基因1个SNP(rs9550270)在有流产史的粘性血小板综合征的患者中有较高的发病率。而且发现PEAR1 c.-9-4663G>T基因多态性的T等位基因对胎儿有一定的保护作用。研究提示GAS6和PEAR1基因多态性可能与患有粘性血小板综合征孕妇的流产风险相关。Yingyun Fu等的研究纳入101例肺栓塞患者和匹配的132例健康人群,对其进行PEAR1基因型检测,结果发现PEAR1基因rs778026543突变组与健康对照组之间出现差异(P<0.001),但在rs1952294和rs822442中没有差异。
J.Enrique等[17]最早发现PEAR1基因在激动剂诱导的血小板聚集中起着重要的作用,PEAR1基因多态性与阿司匹林的抗血小板活性相关。随后,多个研究表明PEAR1基因多态性与阿司匹林治疗的疗效相关[19]。JD Backman等[20]近期的研究发现PEAR1在血小板聚集性的影响可以通过治疗剂量的阿司匹林改变,但不是剂量依赖性的。同时,还有研究发现阿司匹林联合氯吡格雷在冠心病患者行PCI术后的血小板功能与PEAR1基因多态性密切相关[16,21]。但是也有研究表明在冠心病和缺血性卒中患者服用阿司匹林期间,PEAR1基因多态性与阿司匹林抗血小板的疗效不相关。
4 总结与思考
从PEAR1被发现为调控血小板功能的重要基因已十五年,全球学者对PEAR1表达与血小板功能的影响做了大量的验证性试验,多数学者认为减弱PEAR1的表达会使血管内皮细胞增殖等使得血栓形成的可能性增加。但也有部分学者的研究结果认为PEAR1的表达没有影响血小板的聚集,对抗血小板的治疗结果没有影响。因此仍然需要对PEAR1基因多态性与血小板功能的关系做更深入的研究,这类结果对血栓性疾病的药物治疗将产生深远影响。
