肉桂精油对食源性肠炎沙门氏菌和单增李斯特菌的抑菌作用
2021-09-18洪小利严媛林玲淼朱军莉黄建锋
洪小利,严媛,林玲淼,朱军莉*,黄建锋
1(浙江工商大学 食品与生物工程学院,浙江省食品安全重点实验室,浙江 杭州,310018) 2(浙江省方圆检测集团股份有限公司,浙江 杭州,310018)
沙门氏菌、单增李斯特菌(Listeriamonocytogenes)等致病菌是引起食源性疾病的重要病原菌,其中肠炎沙门氏菌(Salmonellaenteritidis)属于革兰氏阴性肠道杆菌[1]。日、美等发达国家发生的食物中毒事件中40%~80%是由禽沙门氏菌引起的,其中主要病原菌为肠炎沙门氏菌[2]。单增李斯特菌为革兰氏阳性短杆菌,是一种人畜共患病的病原菌[3],感染后主要表现为败血症、脑膜炎和单核细胞增多。该菌适应环境的能力极强,在4 ℃的环境中仍可生长繁殖,是冷藏食品威胁人类健康的主要病原菌之一[4]。
肉桂精油是从干燥肉桂皮中提取所得的挥发油,是一种常见的香料,酚类、醛类和酮类是肉桂精油的主要活性成分,其中顺反式肉桂醛的含量最高[5]。其作为香料已经广泛应用于食品以及日用品行业[6]。肉桂精油作为天然抑菌防腐剂在金黄色葡萄球菌、假单胞菌和大肠杆菌中有良好的抑菌活性[7-8]。
肉桂精油对多种食源性致病菌表现良好的抑菌活性[7-9],然而对食品介质中致病菌的繁殖影响报道较少。鉴于此,本研究以肠炎沙门氏菌和单增李斯特菌为研究对象,分析肉桂精油对二者的体外抑菌特点及群体感应活性干扰,评价其对牛肉汁中2种致病菌耐受性和品质的影响,以期为开发新型安全高效的植物源性抑菌剂以及扩大植物精油的应用提供参考。
1 材料与方法
1.1 材料与试剂
肠炎沙门氏菌ATCC 13076、单增李斯特菌ATCC 19115,中国菌种保藏中心;肉桂精油,吉安市国光香料厂;D4540-100ML二甲基亚砜(dimethyl sulfoxide,DMSO),美国Sigma公司;市售牛肉,杭州高沙农贸市场;胰蛋白胨大豆琼脂(tryptic soy agar,TSA)、胰蛋白胨大豆肉汤(trypticase soy broth,TSB)、平板计数琼脂(plate count agar,PCA)、木糖赖氨酸脱氧胆酸盐琼脂(xylose lysine desoxycholate,XLD)、PALCAM琼脂,青岛海博生物技术有限公司。
1.2 仪器与设备
VICTOR X酶标仪,美国Perkin Elmer公司;UV-1800紫外分光光度计,日本SHIMADZU公司;FE38-Standard台式电导率仪,上海右一仪器有限公司;SIGMA3-30K冷冻高速离心机,美国Sigma公司;ME204E电子天平,梅特勒-托利多仪器(上海)有限公司;JS-680D全自动凝胶成像分析仪,上海培清科技有限公司。
1.3 试验方法
1.3.1 最小抑菌浓度和最小杀菌浓度
将肉桂精油溶于DMSO,配成质量浓度为20 mg/mL的溶液,采用二倍稀释法测定最小抑菌浓度(minimum inhibitory concentration,MIC)和最小杀菌浓度(minimum bactericidal concentration,MBC)[10]。将过夜活化的肠炎沙门氏菌和单增李斯特菌菌液以5 lgCFU/mL接种量分别接种于含有0.025~1.60 mg/mL肉桂精油的TSB培养基,37 ℃静置培养,每4 h取样计数细菌浓度和平板涂布计数[11]。
1.3.2 时间-杀灭曲线
参考FERRO等[12]的方法并稍作修改。以5 lgCFU/mL接种量分别接种于20 mL终浓度为MIC、2 MIC、4 MIC、6 MIC、8 MIC或MBC肉桂精油的TSB培养基,不添加精油为对照组。培养0、4、8、12、16、20、24 h取1 mL菌悬液,合适稀释后,涂布计数。
1.3.3 细菌上清液的电导率
参考艾启俊等[13]的方法,并适当修改。取过夜培养的菌液于TSB培养基中,使细菌浓度约为8 lg CFU/mL。加入一定量肉桂精油,使终浓度为MIC、2 MIC、MBC,对照组不添加肉桂精油,将细菌分别培养0、3、6、9 h后,4 000 r/min离心5 min,测定上清液电导率。
1.3.4 细胞内核酸与蛋白质泄漏
参考HUANG等[14]的方法略修改。取过夜培养的菌液在8 000 r/min离心10 min,收集菌体,用磷酸缓冲盐溶液(phosphate buffer saline,PBS)重悬并离心,重复上述操作2次,最终将菌体重悬于PBS中。取重悬菌液分别加入肉桂精油使得终浓度为MIC、2 MIC、MBC,以不添加为对照组,培养一定时间后取样离心,于260和280 nm下测定上清液OD值。
1.3.5 结晶紫染色观察细菌生物被膜
参考顾春涛等[15]的方法,并适当修改。取过夜活化的菌液接种至TSB肉汤,使2种致病菌浓度约为4 lgCFU/mL,取2 mL含菌TSB肉汤加入至24孔板中,每孔加1片灭菌的玻璃片。同时添加肉桂精油使得终浓度为1/8 MIC、1/4 MIC、1/2 MIC,混合,以不添加为对照组,于37 ℃静置培养24 h。取出玻璃片,用灭菌PBS洗脱3遍后,玻片上黏附的被膜菌用0.1%结晶紫染色1 min后,水洗干燥,在光学显微镜下观察。
1.3.6 呋喃硼酸二酯类(autoinducer-2,AI-2)活性
参考叶晓峰等[16]的方法,并稍作修改。取过夜培养的菌液接种于TSB肉汤,添加肉桂精油使得终浓度为1/8 MIC、1/4 MIC、1/2 MIC,以添加等量DMSO为对照组,于37 ℃摇床培养12 h后,离心取上清液经0.22 μm滤膜过滤得到无菌上清液。将过夜活化的V.harveyiBB170用AB培养基以1∶5 000稀释,分别将10 μL待测的无菌上清液和90 μL稀释的BB170菌液添加至96孔酶标板。以添加等量AB培养基为空白对照。荧光酶标仪选择OPS模式检测,在30 ℃下培养,每隔0.5 h 检测1次,连续测定6 h。
1.3.7 牛肉汁中菌落数和感官评分
无菌取市售新鲜牛肉20 g,加入100 mL PBS缓冲液,无菌拍打均匀,制备成1∶5的牛肉汁。无菌接种2种致病菌使其浓度至104~105CFU/mL,并添加肉桂精油使最终质量浓度分别为0.1、0.2、0.4、0.8 mg/mL,以未添加为对照组。将接种样品置10 ℃冷藏0、24、72 h后,取样,采用PCA、XLD和PALCAM琼脂涂布计数。牛肉汁的感官评分由10名经过培训的评价员评估气味、色泽等感官变化[17]。
1.4 数据统计分析
每组样品均设3个重复组,采用Origin 8.5进行数据分析处理并作图,应用SPSS 2.0的ANOVA进行方差分析,P<0.05表示具有显著性差异。
2 结果与分析
2.1 肉桂精油对2种致病菌生长的影响
如图1所示,肠炎沙门氏菌和单增李斯特菌在37 ℃培养24 h的细菌浓度分别为8.82和9.01 lg CFU/mL。肉桂精油添加能显著抑制2种菌的生长,随着肉桂精油浓度增加,抑菌活性增强,其中肠炎沙门氏菌在0.1 mg/mL肉桂精油处理下生长受到抑制(P<0.05),而单增李斯特菌在0.2 mg/mL肉桂精油处理下细菌基本无生长(P<0.05)。同时发现肠炎沙门氏菌和单增李斯特菌在6 MIC肉桂精油处理后菌体低于2 lgCFU/mL(P<0.05),而在0.8和1.6 mg/mL浓度作用下两者均无可见菌落生长。可见,肉桂精油对肠炎沙门氏菌和单增李斯特菌的MIC分别为0.1和0.2 mg/mL,MBC分别为0.8和1.6 mg/mL。
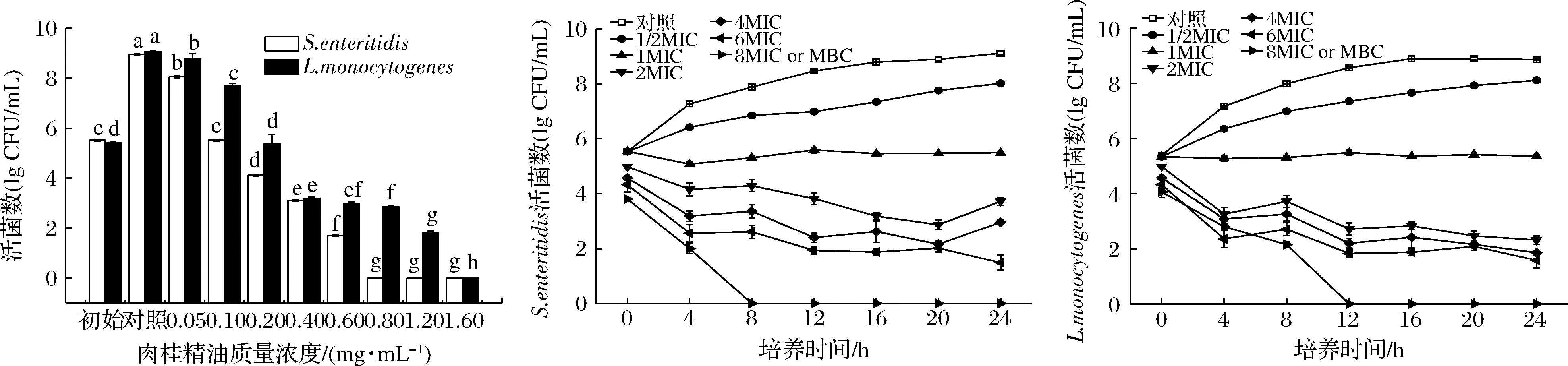
图1 肉桂精油对肠炎沙门氏菌和单增李斯特菌的MIC和杀菌曲线Fig.1 MIC and time-kill curves of cinnamon EO against S.enteritidis and L.monocytogenes 注:不同小写字母表示差异显著(P<0.05)(下同)
2种致病菌在MIC条件下,生长受到抑制,保持初始浓度5~6 lgCFU/mL,而在肉桂精油浓度高于MIC作用下细菌浓度均低于对照组,其中肠炎沙门氏菌在2 MIC和4 MIC处理24 h后细菌浓度有所上升,可能是随着时间的延长,肉桂精油的实际工作浓度略微降低,但明显低于对照组(P<0.05)。当肉桂精油浓度达到MBC时,肠炎沙门氏菌和单增李斯特菌分别在8和12 h后几乎无生长。可见,肉桂精油对肠炎沙门氏菌抑菌和杀菌活性更强。肠炎沙门氏菌的MIC和MBC值都低于单增李斯特菌,除了革兰氏阴性细菌的细胞壁较薄,更重要的原因可能是因为两者细胞壁组成不同,革兰氏阴性菌细胞壁中的脂多糖存在使得精油更容易进入菌体内。相似地发现,肉桂精油对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌和酿酒酵母的MIC值为0.1~0.4 μL/mL[8]。WEERAKKODY等[18]报道香料和香草精油影响细胞膜结构,肉桂、百里香、牛至等精油的主要抗菌成分能穿过细胞壁和破坏细胞质膜。时间-杀菌曲线也发现MBC下肠炎沙门氏菌较短时间几乎全部死亡,致死速率快于单增李斯特菌,与WU等[19]的结果类似。
2.2 肉桂精油对2种致病菌上清液电导率的影响
细菌上清液电导率的改变可以反映细胞膜渗透性的变化。由图2可知,肉桂精油处理使肠炎沙门氏菌和单增李斯特菌上清液中电导率呈现明显上升(P<0.05),其中经MIC、2 MIC和MBC肉桂精油作用9 h后肠炎沙门氏菌上清液中的电导率分别增加7.1%、11.3%和13.5% (P<0.05),单增李斯特菌上清液电导率分别增长6.4%、10.2%和12.8% (P<0.05)。结果表明,2种致病菌上清液的电导率呈现相似的增加趋势,可能是肉桂精油处理导致肠炎沙门氏菌和单增李斯特菌的细胞膜结构破坏,引起菌体细胞膜透性的改变,导致胞内K+、Ca2+、Na+等离子从细菌细胞中大量渗出。过多的电解质流失会导致细菌的死亡,与王慧敏等[20]的报道相似。
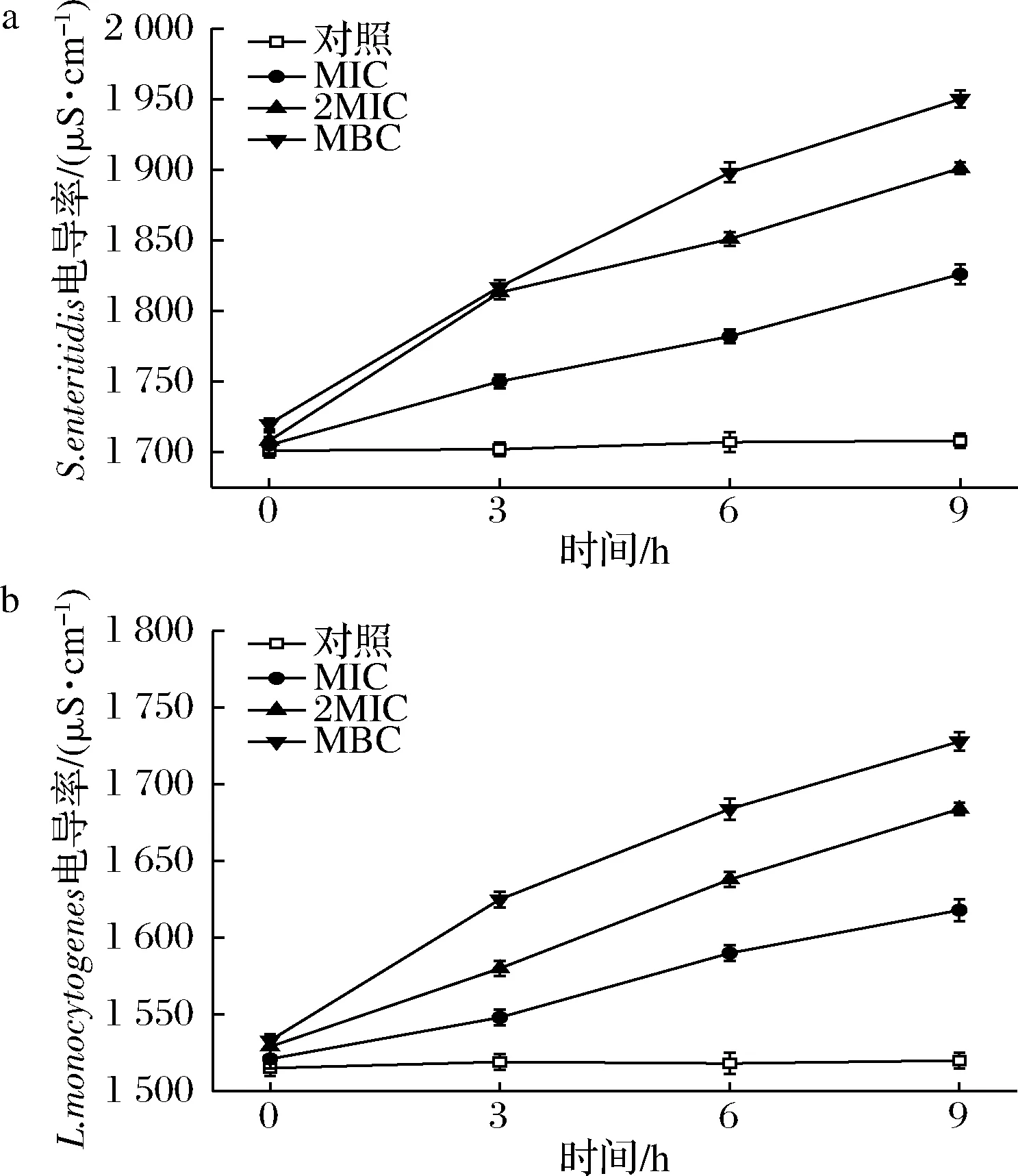
a-沙门氏菌;b-单增李斯特菌图2 肉桂精油对肠炎沙门氏菌和单增李斯特菌 上清液电导率的影响Fig.2 Effects of cinnamon EO on the conductivity of S.enteritidis and L.monocytogenes supernatant
2.3 肉桂精油对2种致病菌胞内核酸和蛋白质泄漏的影响
细菌细胞膜能够抵挡外界抑菌物质,可通过细胞内蛋白质类物质、遗传物质等的泄漏来判断细胞膜的破损。如图3所示,相对于对照组,MIC、2 MIC、MBC组肉桂精油处理后,2种致病菌上清液中OD260值显著上升,其中处理9 h后肠炎沙门氏菌上清液分别增加至0.16、0.22、0.44 (P<0.05),而单增李斯特菌增加至0.12、0.17、0.30(P<0.05)。肉桂精油处理后,2种致病菌上清液中OD280与OD260值呈现相似的上升趋势,3种浓度肉桂精油处理 9 h后肠炎沙门氏菌上清液OD280值分别增加至0.19、0.28、0.54(P<0.05),单增李斯特菌增加至0.17、0.19、0.41 (P<0.05)。结果表明,2种致病菌随着肉桂精油处理浓度增加,核酸和蛋白质泄漏量逐步增加,其中肠炎沙门氏菌泄漏量更高。提示肉桂精油破坏菌体细胞壁和细胞膜结构,导致核酸和蛋白的泄漏[21]。
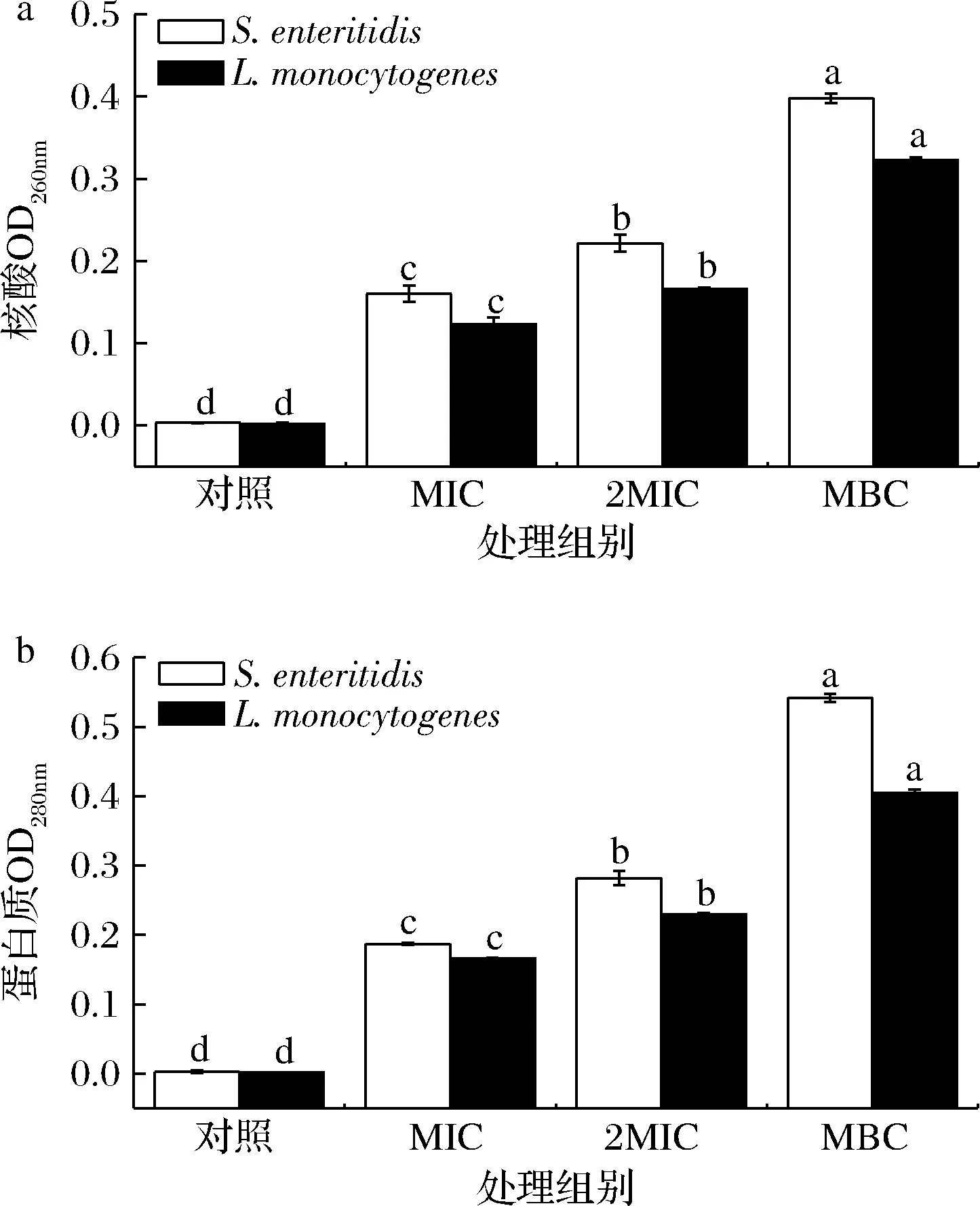
a-核酸;b-蛋白质图3 肉桂精油对肠炎沙门氏菌和单增李斯特菌细胞内 核酸及蛋白质泄漏的影响Fig.3 Effects of cinnamon EO on nucleic acids and protein leakage in S.enteritidis and L.monocytogenes
2.4 亚抑菌浓度肉桂精油对2种菌生物被膜的影响
亚抑菌浓度肉桂精油对2种菌的黏附性和生物被膜的影响如图4所示。2种致病菌培养24 h后都能致密地黏附到玻璃片上,特别是单增李斯特菌。2致病菌在1/4 MIC和1/8 MIC肉桂精油作用下黏附量显著降低,1/4 MIC肉桂精油处理下2种菌在玻璃片上稀疏,零散地分布,而1/2 MIC处理下玻片上仅见少量的细菌。可见,亚抑菌浓度肉桂精油显著降低两菌在玻璃片上黏附性和生物被膜形成,可能与其活性成分肉桂醛具有减少食品细菌的生物被膜形成有关[15]。生物被膜形成会增强致病菌对环境消毒剂的抵抗能力[22]。

图4 肉桂精油抑制肠炎沙门氏菌和单增李斯特菌的黏附Fig.4 Inhibition of cinnamon EO on adhesion of S.enteritidis and L.monocytogenes
2.5 亚抑菌浓度肉桂精油对2种菌AI-2分泌的影响
AI-2介导的群体感应是一种广泛传播的种间系统,它可以调节生物发光、生物被膜形成。如图5所示,肠炎沙门氏菌和单增李斯特菌上清液荧光强度分别达到76 705和39 194 RLUs,添加1/8 MIC、1/4 MIC、1/2 MIC浓度的肉桂精油对沙门氏菌AI-2活性的抑制率分别为11.2%、24.6%、42.8% (P<0.05),而对单增李斯特菌AI-2活性抑制率分别为6.8%、20.2%、37.6% (P<0.05)。结果显示,肠炎沙门氏菌和单增李斯特菌具有AI-2活性,且前者活性更高。亚抑菌浓度肉桂精油显著干扰2种菌AI-2的分泌,且对沙门氏菌的抑制活性更强,与抗生物被膜较一致,推测肉桂精油通过干扰群体感应AI-2系统影响生物被膜的形成。相似报道显示,香芹酚能够抑制荧光假单胞菌和金黄色葡萄球菌AI-2活性,参与抗生物被膜形成[23]。

图5 肉桂精油对肠炎沙门氏菌和单增李斯特菌 AI-2活性的影响Fig.5 Effects of cinnamon essential oil on AI-2 activity of S.enteritidis and L.monocytogenes
2.6 肉桂精油对牛肉汁中2种致病菌的抑制
进一步评价肉桂精油对冷藏牛肉汁的感官品质和2种致病菌的影响,如图6所示。牛肉汁对照组在10 ℃冷藏72 h后,菌落总数由初始的4.53 lgCFU/mL上升到9.27 lgCFU/mL,肠炎沙门氏菌和单增李斯特菌从初始接菌量约4.50 lgCFU/mL,生长到9.12和8.99 lgCFU/mL,表明2种致病菌在营养丰富的牛肉汁中生长良好。与对照组相比,肉桂精油0.1、0.2、0.4和0.8 mg/mL处理冷藏牛肉汁72 h后,菌落总数分别下降1.7、3.0、4.4和7.1 lgCFU/mL,而肠炎沙门氏菌分别减少4.0、5.3、6.9、8.0 lgCFU/mL,单增李斯特菌分别下降1.9、4.1、6.1、7.3 lgCFU/mL。添加质量浓度为0.8 mg/mL的肉桂精油后样品冷藏72 h,肠炎沙门氏菌仅存活1 lgCFU/mL,而单增李斯特菌低于2 lgCFU/mL,抑菌活性弱于TSB培养基中。与TSB相比,牛肉汁中肠炎沙门氏菌和单增李斯特菌对肉桂精油增加耐受性,单增李斯特菌尤为显著,其中肉桂精油MIC浓度下2种致病菌仍缓慢生长繁殖,在MBC浓度下72 h仍能检测肠炎沙门氏菌。对照组牛肉汁在10 ℃贮藏48 h后出现明显异味,肉汁浑浊,局部绿色,感官评分下降到3分以下。添加肉桂精油能改善牛肉汁的感官品质,0.2 mg/mL组样品在10 ℃贮藏72 h后稍有异味,感官评分为3.0,0.4 mg/mL组无明显异味,颜色淡红,感官评分为3.5,0.8 mg/mL组保持较好感官品质,评分为3.7,稍有精油气味,感官可接受。结果表明,肉桂精油能有效抑制冷藏牛肉汁中菌落总数和2种致病菌的存活,表现浓度依赖性,并改善感官品质。CALO等[24]报道食物中脂肪、蛋白质、水分、pH和酶能潜在地减少精油活性,其中高脂肪组分需要更高浓度的精油抑制细菌生长,与食物脂肪和蛋白能够吸收香料提取物有关[25]。
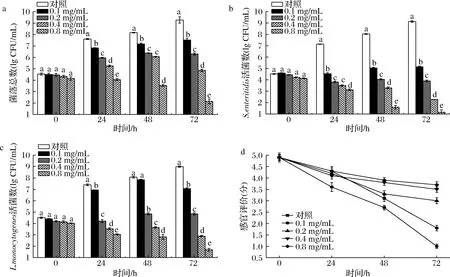
a-菌落总数;b-沙门氏菌;c-单增李斯特菌;c-感官评分图6 肉桂精油对牛肉汁中菌落总数、沙门氏菌和单增李斯特菌生长及感官评分的影响Fig.6 Effects of cinnamon EO on APC,S.enteritidis,L.monocytogenes growth and sensory score in beef juice
3 结论
研究显示,肉桂精油对肠炎沙门氏菌和单增李斯特菌的MIC分别为0.1和0.2 mg/mL,MBC分别为0.8和1.6 mg/mL。肉桂精油能明显抑制2种致病菌的生长,破坏细胞膜结构,增加细胞膜的通透性,导致细菌死亡。肉桂精油在亚抑菌浓度下能有效干扰群体感应AI-2活性,降低2种致病菌的黏附和生物被膜形成。肉桂精油还减少牛肉汁菌落总数和2种致病菌的增殖,改善牛肉汁冷藏的感官品质,表现浓度依赖性,其中对肠炎沙门氏菌抑菌活性更强。研究为植物精油应用于冷链动物性食品的储藏保鲜提供依据,对保障肉类产品安全和延长货架期具有重要意义。
