FTO在帕金森病细胞模型中调控机制作用研究
2021-09-18蔺佳
蔺佳
(1. 新乡医学院药学院,河南 新乡 453000;2. 新乡医学院第一附属医院,河南 新乡 453000)
帕金森病(Parkinson’s disease,PD)是一种临床上常见的老年神经退行性疾病,其发病特征主要是黑质的多巴胺能神经元变性和过度死亡,以及因此引起的纹状体多巴胺能神经元数量减少。肌肉强直、运动迟缓、静止性震颤及姿势步态障碍等为其主要临床表现,帕金森病的治疗目前主要是对症治疗,治疗效果也因病情的不同而有明显不同[1-3]。患者在患病后,生活质量会随着病情的加重而出现不同程度的下降,在疾病后期会发生多种并发症,甚至致残,从而导致预后不良[4]。目前认为,该病的发病机制与神经元内α-syncline的异常聚集密切相关[5]。但其详细的发病因素,尤其是非基因突变的病理因素仍不十分清楚。
众所周知,真核细胞中的RNA上有超过100种化学修饰,其中m6A是在真核生物mRNA和lncRNA中含量最为丰富的一种修饰碱基[6-7]。在哺乳动物细胞中,平均每个mRNA上约有3~5个m6A碱基。研究发现mRNA甲基化的形成是一个可逆过程,甲基转移酶和去甲基化酶共同作用调控了mRNA上m6A的含量变化[8]。其中m6A甲基转移酶是一个复合物,它主要由METTL3(methyltransferase like 3)、METTL14(methyltransferase like 14)和WTAP(Wilms tumour 1 associating protein)三部分构成[9]。RNA去甲基化酶主要有FTO(fat mass and obesity associated protein)和 ALKBH5(alkylation repair homolog 5) ,并且FTO和ALKBH5都是铁离子和α-酮戊二酸依赖型双加氧酶[10]。mRNA上的m6A碱基在胞质会被不同的“reader”蛋白读取,然后引发不同的效应。在帕金森病中,相关基因mRNA的m6A修饰状况如何,是否也存在表观转录组学层面的调控?对此问题的详细研究还较少,有许多未知需要去探索[11-12]。因此,本实验研究6-OHDA诱导的帕金森损伤神经元中m6A含量的变化,并检测了调控m6A的甲基转移酶和去甲基化酶的表达水平,探究m6A修饰在帕金森细胞模型中可能的作用。
1 材料和方法
1.1材料
1.1.1试剂和仪器 细胞总RNA所用提取试剂盒购自天根生物;实验所用胎牛血清购买自Hyclone公司;DMEM高糖培养基购自GIbico公司;所使用PCR引物均购自于上海生工,详细序列见表1;实验使用FTO siRNA的相关序列为:5′-GCAGTGTATCTGAGGAGCTCCATAA-3′;所用m6A抗体(ab2085-77)购自abcam公司。FTO抑制剂FB23-2由华盛顿大学李静副教授惠赠。
1.1.2细胞株 本实验所使用的SHSY-5Y细胞株,购自上海生化细胞所。
1.2方法
1.2.1细胞培养和分组 实验中按照双抗∶胎牛血清∶DMEM高糖培养基=1∶10∶90的比例来培养SH-SY5Y细胞,之后置于20% O2、5%CO2,37℃细胞培养箱中正常培养,隔夜换液。培养至2~3 d时使用胰蛋白酶对SH-SY5Y细胞进行消化传代(1∶4)。取处于对数生长期状态良好的细胞进行实验。设空白对照组和6-OHDA处理组,调整细胞密度为1×105个/毫升,之后每孔按照150 μl接种于96孔板,根据相关文献[8]描述,对6-OHDA组以0.025 mg/ml的6-OHDA孵育24 h进行损伤诱导处理,各浓度设置6个副孔,然后取样进行相关实验。对于FB23-2处理过程,则将0.1 μM的FB23-2再收集细胞进行相关实验。
1.2.2CCK8实验检测细胞活力 取处于对数生长期的SH-SY5Y细胞进行实验。之后调整细胞密度,设置空白对照组和6-OHDA实验组。根据预实验,6-OHDA组以0.025 mg/ml的6-OHDA孵育进行损伤诱导处理,各组并设置6个副孔。之后在细胞培养箱中培养24 h后,直接每孔加入10 μl CCK8试剂,再置培养箱中继续培养4 h,最后使用酶标仪测定每孔在450 nm处的吸光度。
1.2.3LDH法检测细胞毒性 将被检测的细胞进行损伤诱导处理后,按照LDH检测试剂盒的步骤要求,对照组和实验组各做6个复孔,每孔各抽取50 μl上清液加至一个新的酶标检测板中;之后加入配好的底物缓冲液50 μl,避光孵育30 min后,每孔加入50 μl终止液,最后在490 nm处进行吸光度检测。
1.2.4Real-time PCR法检测SH-SY5Y细胞中甲基化相关酶mRNA表达 先根据Total RNA Kit试剂盒操作说明分别抽提对照组和实验组细胞的总RNA。之后取各组总RNA各1 μg,进行去除基因组反应和逆转录反应,从而合成cDNA,之后以cDNA为模板进行PCR扩增。具体操作根据试剂盒所带说明书和仪器操作说明书[PCR反应体系10 μl:cDNA 1 μl,primers(10 μmol/L)0.5 μl,2×Taq PCR MasterMix 5 μl,RNase Free water 3 μl],PCR引物见表1。PCR反应条件为DNMT1:预变性95℃ 7 min,变性95℃ 5 s,退火60℃ 30 s,延伸60℃ 30 s,循环数为40次。本实验中以GAPDH为内参基因,目的基因的相对表达量=2-ΔΔCt,其中ΔΔCt=(Ct靶基因-Ct内参)实验组-(Ct靶基因-Ct内参)对照组。每个目的基因进行3次重复试验,最终以Ct值做统计分析。见表1。

表1 PCR所用引物
1.2.5Western blot法检测两种细胞与凋亡相关的蛋白酶表达 首先分别将两种细胞用含1%PMSF的RIPA(强)蛋白裂解液进行裂解,后用考马斯亮蓝结合法进行蛋白质含量定量。每组按照浓度的大小加入不同体积的PBS缓冲液和蛋白上样缓冲液调至各组蛋白浓度一致,之后10%SDS-PAGE电泳直至溴酚蓝到达分离胶底部停止,转移至PVDF膜(100 V,2 h),预染蛋白marker确定蛋白分子量标准位置。含5%脱脂奶粉的TBST封闭液封闭1 h,抗体METLL14(Proteintech,26158,1∶1000)、METTL3(Abcam,195352,1∶1000)、FTO(Abcam,ERP6894,1∶1000)、ALKBH5(Abcam,ERP18958,1∶1000),GRIN1(Biorbyt,131784,1∶1000)β-actin(Sant Cruz,水槽30656,1∶5000)分别用封闭液按比例稀释后,放置室温摇床上摇30 min,之后4℃孵育过夜。第2天TBST洗涤3次,每次10 min;二抗(1∶5000)室温孵育1 h。再用TBST洗涤3次,每次10 min。最后使用天能凝胶成像机进行ECL曝光。ChemiScope analysis软件分析各个目的条带与β-actin条带的灰度比值,从而计算蛋白相对表达量。
1.2.6HPLC-MS法检测m6A含量 按照实验要求抽提细胞总RNA,之后用mRNA富集试剂盒对mRNA进行富集,随后对mRNA进行酶降解后用碱性磷酸酶除去磷酸集团,自备单碱基检测液,然后进行检测。
1.2.7小鼠帕金森模型的建立 将AAV介导shFTO定位注射在B6小鼠纹状体,并确定敲降结果。野生型小鼠和纹状体FTO基因敲降小鼠各8只,均腹腔注射1-甲基-4苯基-1,2,3,6-四氢吡啶(MPTP),根据密度换算,即每只小鼠每日腹腔注射剂量为 0.01 ml/kg(25 mg/kg,每周2次),连续14 d,建模成功后,进行行为学检测:爬杆实验:将两组小鼠分别悬挂于一根长线上,其评分标准为,小鼠双后肢勾住挂线记为3分;小鼠仅一只后肢勾住电线记为2分,小鼠双后肢均未勾住电线记为1分。并且记录小鼠从悬挂到掉落的时间,即为潜伏期时长。转棒实验:将小鼠分别放在转棒疲劳仪,在转棒上进行适应性放置30 s后,启动疲劳仪,转速为5 r/min,让小鼠适应性90 s后,将疲劳仪转速调整为16 r/min,记录小鼠从转棒上第一次跌落的时间。最后分别收集小鼠的纹状体检测人合氨酸受体亚基(GRIN1)表达水平,以及氧化还原应激相关指标,本研究中小鼠处置方式均符合动物伦理学规定。

2 结果
2.16-OHDA诱导的模拟PD神经元损伤模型 实验结果显示0.025 mg/ml的6-OHDA会明显诱导SH-SY5Y细胞损伤,CCK8和LDH法检测都表明了0.025 mg/ml 6-OHDA所致的细胞毒性(图1A和1B)。细胞形态的变化(见图1C),表明6-OHDA造成了显著的细胞损伤,符合PD的细胞模型。
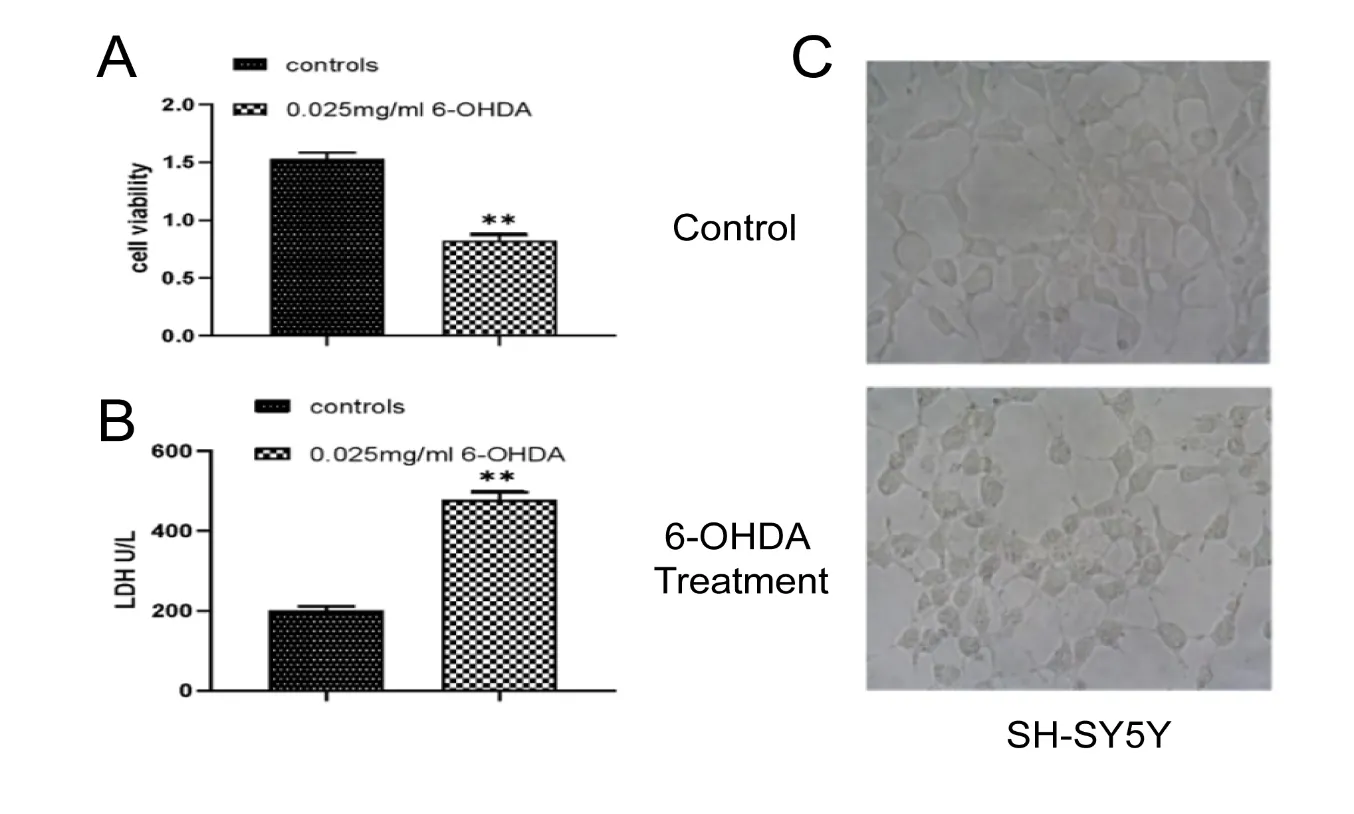
注:A:CCK8检测细胞活力;B:LDH检测细胞毒性;C:细胞形态;**表示P<0.01。
2.26-OHDA对细胞中甲基转移酶mRNA和m6A含量的影响 qRCR检测6-OHDA诱导的神经细胞中表达的与m6A相关的甲基转移酶METTL3、METTL14和去甲基化酶FTO、ALKBH5的mRNA含量的变化(见图2A),发现只有FTO在细胞内显著升高。同时检测了它们的蛋白表达水平(见图2B),结果与mRNA表达水平一致,仅有FTO发生显著变化。HPLC-MS法直接检测正常细胞和PD模型细胞mRNA中m6A的含量变化,发现6-OHDA组虽然有一定程度的下降,但没有显著性差异(见图2C),这可能和细胞内m6A动态调控的复杂机制有关。
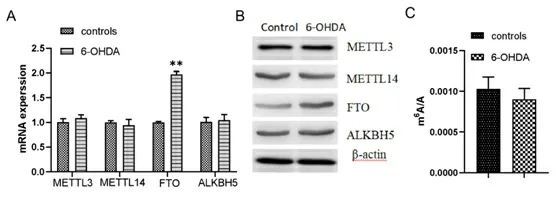
注:A:mRNA的相对表达量;B:蛋白的相对表达量;C:m6A相对含量;**表示P<0.01。
2.3FTO敲低或过表达不影响PD发病相关基因的表达 在确定帕金森模型细胞中FTO升高之后,那么6-OHDA处理诱导的FTO表达升高是否会影响PD发病相关基因的表达水平,为验证该假设,通过siRNA敲低FTO的表达并用慢病毒构建了FTO高表达细胞株,观察在6-OHDA处理24 h后,FTO敲低和过表达对PD疾病密切相关基因的表达变化,结果显示无论敲低或过表达FTO,与PD疾病密切相关基因的表达与对照组相比没有显著性变化(见图3A、图3B和图3C)。
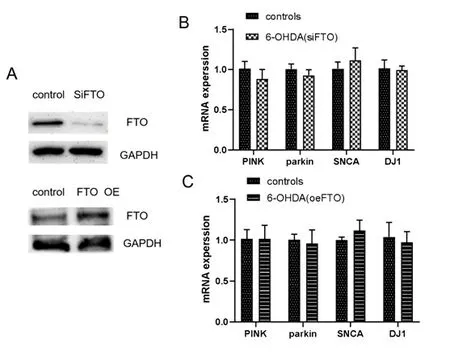
注:A:FTO的敲低和过表达效率;B:FTO敲低后对PD模型细胞中PD相关基因表达的影响;C:FTO过表达后对PD模型细胞中PD相关基因表达的影响。
2.4FTO对多巴胺信号通路相关基因GRIN1的表达变化的影响 为了进一步探究6-OHDA是如何通过调控FTO,诱导了哪些与PD疾病相关的变化,我们对一些多巴胺信号通路相关基因进行了检测,结果显示SH-SY5Y细胞在6-OHDA处理的情况下,过表达FTO则促进GRIN1的表达,mRNA和蛋白的检测结果是一致的(见图4A和图4B);与此相反,敲低FTO后,GRIN1表达明显减少。同时我们使用了FTO抑制剂 结合前面的实验结果,猜测6-OHDA处理升高了FTO的表达,而高表达的FTO又导致多巴胺通路相关基因GRIN1发生改变。

注:A:mRNA的变化;B:蛋白含量的变化;B、C:FTO抑制剂处理后GRIN1的mRNA表达变化;*表示P<0.05
2.5敲降FTO基因降低了帕金森模型小鼠脑中GRIN1的表达 为在动物模型上验证上述结果,纹状体FTO敲降小鼠和野生型对照被腹腔注射MPTP造成帕金森病模型,通过动物行为学实验检测发现,在悬尾实验中,FTO敲降小鼠的得分比野生型小鼠要高,但差异无统计学意义(P>0.05),见图5A;但悬尾实验中FTO敲降小鼠的潜伏期要长于野生型小鼠(P<0.05),见图5B。在转盘实验中,FTO敲降小鼠的掉落时间要远远长于野生型小鼠(P<0.05),见图5C。表明FTO敲降对帕金森模型小鼠有一定的意义。另外取出小鼠纹状体,检测GRIN1的表达,与细胞模型上的结果类似,GRIN1也有一定程度的降低(P<0.05),见图5D。这表明在帕金森疾病模型中 FTO的水平会直接调控GRIN1的表达。

注:A:悬尾实验的评分结果;B:悬尾实验潜伏期;C:转棒实验的掉落时间;D:小鼠纹状体中GRIN1的mRNA
3 讨论
PD的发生过程中会伴随着许多基因表达的变化,越来越多的研究表明表观转录修饰在PD的发生发展过程中扮演了非常重要的角色[13-14]。现有研究表明,RNA甲基化可能与神经退行性疾病的病变有着紧密的联系[15]。但相关的研究主要集中在m6A和神经突触维持之间的关系,还没有详细的关于PD病理过程中m6A含量变化和机制的研究[16-17]。因此本文初步探讨了PD细胞模型中m6A相关的甲基转移酶和去甲基化酶的表达变化。本课题采用了经典的6-OHDA法诱导SH-SY5Y细胞,作为PD模型细胞。CCK8法和LDH检测法结果显示0.025 mg/ml的6-OHDA会导致SH-SY5Y细胞产生明显的损伤,这和PD患者内多巴胺能神经元减少类似。综上所述,我们认为0.025 mg/ml的6-OHDA处理可以有效地模拟PD细胞损伤。首先qPCR法检测了6-OHDA处理的SH-SY5Y细胞中m6A相关酶FTO、ALKBH5、METTL3、METTL14的mRNA表达量的变化,结果显示大部分甲基转移酶和去甲基化酶没有明显变化,仅FTO有明显的表达升高。Western-blot检测了对应的蛋白表达,结果与mRNA一致,仅仅FTO明显升高。FTO作为一个去甲基化酶,在m6A形成的动态调节中具有重要作用。脑内FTO的过高表达可降低神经元内一些基因的mRNA中m6A的含量,导致下游基因表达的改变,最终可能引起一系列脑损伤病变[18-20]。最近研究表明,FTO的异常表达将影响学习记忆、昼夜节律等,并猜测可能与一些神经退行性疾病的发病有一定的相关性[21-22]。我们又用HPLC-MS检测6-OHDA对SH-SY5Y细胞中m6A的含量的影响,结果显示6-OHDA可以降低细胞中m6A的含量,虽然差异无统计学意义。这很可能是因为细胞内m6A的调控机制比较复杂,还存在其他潜在的调控机制。
后续主要以FTO为6-OHDA的主要影响靶点,首先用siRNA敲低FTO,同时用制作FTO高表达细胞株;并检验了敲低和过表达效果,然后检测了6-OHDA对正常细胞、siFTO和FTO过表达细胞的影响,我们着重观察了和PD发病相关的PINK1、parkin、SNCA和DJ1的mRNA表达量,发现差异无统计学意义,这可能是因为m6A的动态调控机制比较复杂,其写入和擦除受到多种酶和细胞因子的共同调控[23]。因此仅仅敲低或过表达FTO,在6-OHDA诱导损伤的细胞中与PD疾病密切相关基因的mRNA上甲基化位点还是得以保存,才会导致其表达基本不变,通过查询相关研究的文献[8],我们又检测了与多巴胺信号通路相关的其他一些基因,经过筛选,实验结果显示敲低FTO导致GRIN1有较为明显的下降,而升高FTO则促进其表达,mRNA和蛋白水平的检测结果是一致的,而过表达FTO则会在一定程度的升高该基因的mRNA水平。以此我们推测FTO可能是通过调控多巴胺信号通路相关基因GRIN1在PD中发挥了一定的作用。GRIN1 基因能够表达离子型谷氨酸受体NMDAR1,致使Ca2+大量内流,造成神经元内Ca2+超载,触发一系列 Ca2+相关的级联反应,如氧化应激水平升高,线粒体功能损伤加剧等。在纹状体FTO敲低的帕金森模型小鼠脑内,我们也发现了类似效果,证明FTO在小鼠体内和体外均可对GRIN1的表达产生影响。但FTO是否直接减少了GRIN1 mRNA上的m6A并且GRIN1 mRNA上的m6A又是被哪种阅读蛋白读取,其具体的机制还需要进一步的研究。
综上所述,我们观察了6-OHDA诱导的神经细胞中m6A的含量差异,也观察了相关的甲基转移酶和去甲基化酶的表达变化,我们发现了FTO在6-OHDA损伤中有一定表达升高,并且利用siRNA敲低FTO后,最终发现多巴胺信号通路相关基因GRIN1在FTO敲低的情况下有显著的下调,而升高FTO则会促进FTO的表达。因此我们推测,FTO可能通过调控GRIN1的表达,在PD的发病过程中发挥了一定的作用。
致谢:该项目被河南省自然科学基金“Sirt6经LKB1/AMPK/PGC1a/NRF上调线粒体生物合成”(编号202300410325)支持。
