可溶性白细胞分化抗原14亚型对慢加急性肝衰竭合并脓毒症的临床诊断价值
2021-09-17马娟张旭张爱芸孙静韩凯明王煜
马娟 张旭 张爱芸 孙静 韩凯明王煜
1宁夏医科大学总医院感染疾病科,银川750004;2宁夏医科大学研究生院,银川750004
慢加急性肝衰竭(ACLF)多因合并严重并发症导致预后较差,一旦患者感染控制不佳,易进展为脓毒症[1]。脓毒症一旦发生,ACLF病情进展迅速,病死率可高达30%~50%[2],因此对于ACLF合并脓毒症患者的早期诊断与治疗至关重要。目前临床公认外周血中性粒细胞(NE)、C反应蛋白(CRP)、降钙素原(PCT)及血培养等检测手段已广泛用于脓毒症的诊断。有研究发现,可溶性白细胞分化抗原14亚型(sCD14-ST)在脓毒症患者外周血中水平会有明显升高,较CRP与PCT上升速度更快、更早,在反映机体炎性反应、感染性休克与器官衰竭等方面发挥重要作用[3]。基于此,本研究探讨血清sCD14-ST水平对ACLF基础的脓毒症患者早期临床诊断的应用价值。
对象与方法
一、研究对象
选择2018—2019年在宁夏医科大学总医院感染性疾病科住院患者,依据纳排标准选取ACLF患者149例,根据ACLF患者就诊早期是否存在脓毒症,分为ACLF脓毒症患者67例(脓毒症组),ACLF无脓毒症患者82例(非脓毒症组)。ACLF的诊断标准参照《肝衰竭诊治指南(2018版)》[4],脓毒症的诊断标准参照《中国严重脓毒症/脓毒性休克治疗指南(2014)》[5],自发性腹膜炎的诊断标准参照《肝硬化腹水及相关并发症的诊疗指南》[6]。排除标准:合并免疫相关性疾病如系统性红斑狼疮、血管炎、混合型结缔组织病等;免疫相关性肝病如原发性胆汁性肝硬化、自身免疫学肝炎等;合并甲状腺疾病如甲状腺功能亢进或减退、甲状腺占位等;病毒性感染如EB病毒、巨细胞病毒、风疹病毒等;合并肿瘤性疾病如肝癌、肺癌、血液系统肿瘤及淋巴瘤;病历资料不全者等。脓毒症患者根据病原学培养结果分为阳性组(25例)和阴性组(42例)。本研究通过宁夏医科大学总医院医学伦理委员会批准(审批号:KYLL-2021-430)。
二、研究方法
收集患者一般临床资料、血常规、生化常规、凝血全套、微生物培养(血或痰或尿或腹水等)、尿便常规、胸部CT或腹水相关检测。所有患者均在确诊早期、尚未开始系统药物治疗前抽取空腹肘静脉血5 mL,2 h内3 500转/min离心15 min(离心半径8 cm),留取血清2 mL,集中冻存于-70℃冰箱待测。血清样本收集结束后,集中解冻、平衡静置室温后1 000转/min离心15 min(离心半径8 cm)提取血清,采用酶联免疫吸附法测定血清sCD14-ST和PCT水平(仪器:Infinite M200),西门子BNII全自动分析仪采用速率放射比浊法测定血清CRP水平,试剂盒均由苏州市跃亚生物技术有限公司提供,检测均严格按照试剂盒使用说明书完成。WBC和NE等其他实验室指标检测采用希森美康XN-1000型血细胞分析仪及其相应的分析试剂、质控品、校准品。
三、统计学方法
采用SPSS 22.0软件对研究数据进行处理。符合正态分布的计量资料以x±s表示,组间比较采用t检验;计数资料以例数和率表示,组间比较采用χ2检验。sCD14-ST与PCT、CRP的相关性分析采用Pearson相关性检验。绘制ROC曲线,分析sCD14-ST、PCT、C R P对ACLF合并脓毒症患者诊断价值。以P<0.05为差异具有统计学意义。
结 果
一、一般情况
149例ACLF患者中,合并脓毒症67例,感染率44.97%。脓毒症组和非脓毒症组患者的性别、年龄、病因、肾功能、肝功能、凝血功能及电解质等差异均无统计学意义(P均>0.05),具有可比性,详见表1。

表1 慢加急性肝衰竭脓毒症和非脓毒症患者的临床资料比较
67例脓毒症组中自发性腹膜炎37例(55.22%),肺部感染25例(37.31%),泌尿系感染3例(4.48%),其他感染2例(2.99%,均为感染病灶不明确,血培养阳性患者);脓毒症组血行感染共21例(31.34%)。脓毒症组病原学培养阳性25例,样本来源包括静脉血样本21例(84.0%)、痰样本3例(12.0%)、腹水1例(4.0%),其中革兰阳性菌9例(36.0%),包括金黄色葡萄球菌(4例)、屎肠球菌(2例)、肺炎链球菌(2例)和草绿色链球菌(1例),革兰阴性菌16例(64.0%),包括大肠埃希菌(8例)、肺炎克雷伯菌(3例)、铜绿假单胞菌(2例)、阴沟杆菌(2例)和鲍曼不动杆菌(1例)。
二、患者sCD14-ST、PCT、CRP及WBC、NE水平
ACLF脓毒症组血清sCD14-ST、PCT、CRP及NE水平均明显高于ACLF非脓毒症组(t=12.425、8.296、9.238和6.655,P均<0.05),血清WBC较非脓毒症组轻度升高,差异无统计学意义(t=1.737,P>0.05),见表2。
脓毒症患者病原学阳性组血清sCD14-ST、PCT、CRP水平明显高于病原学阴性组(t=12.230、4.114和5.307,P均<0.05),WBC、NE水平与病原学阴性组比较差异无统计学意义(t=-0.08和-0.97,P均>0.05),见表2。
三、sCD14-ST与其他血清炎性指标的相关性分析
Pearson相关性分析显示,ACLF脓毒症组血清sCD14-ST与PCT、CRP呈正相关(r=0.813和0.773,P均<0.01),与WBC和NE不相关 (r=0.352和0.286,P均>0.05)。
四、sCD14-ST对ACLF脓毒症患者的诊断效能
血清sCD14-ST与PCT、CRP检测的灵敏度及特异性以血清sCD14-ST较高(84.55%和93.96%),而联合检测的灵敏度及特异性最高 (87.11%,96.74%);血清sCD14-ST与、PCT、CRP及联合检测的ROC曲线下面积分别为0.931、0.857、0.865、0.946,其中联合检测ROC曲线下面积最大。见表3和图1。
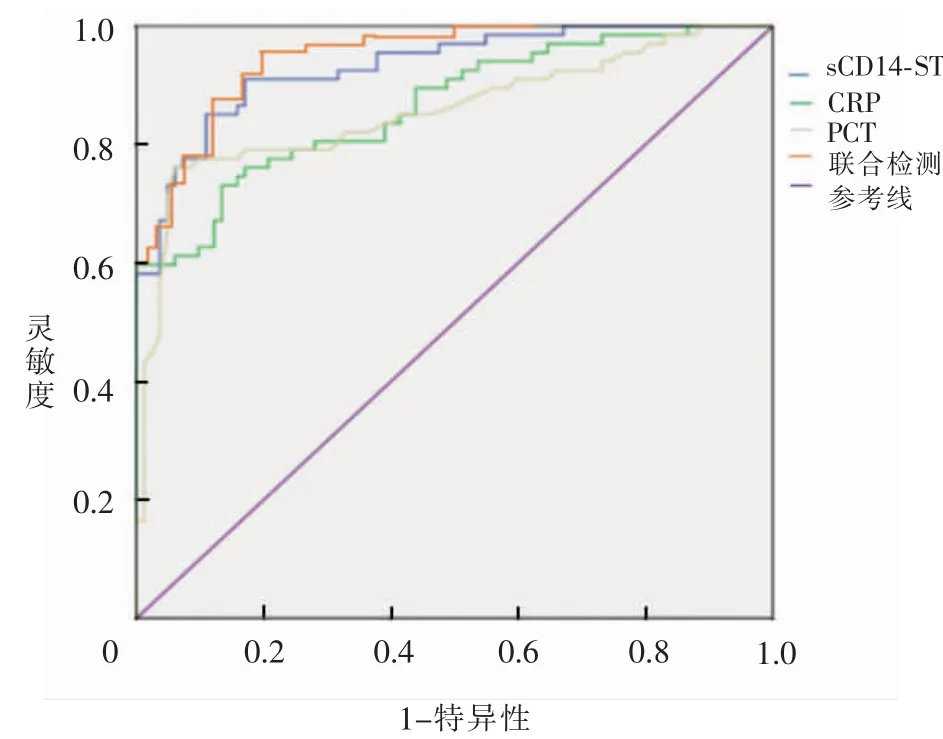
图1 不同指标诊断ACLF脓毒症患者的ROC曲线图

表3 慢加急性肝衰竭脓毒症患者不同指标的诊断效能
讨 论
ACLF常因各种并发症导致病情的急剧进展甚至不良预后,其中细菌感染为其发病、死亡的主要原因。本研究纳入ACLF合并脓毒症患者67例,其中以腹腔和肺部感染为主,与相关研究基本一致[7],考虑与ACLF患者常合并腹腔积液、肠道菌群移位及呼吸道屏障功能下降等有关。进一步分析发现,ACLF脓毒症组中病原学培养阳性25例,革兰阴性菌16例,与Kluge和Tacke[8]研究结果一致。ACLF脓毒症以革兰阴性菌为主,分析可能原因为患者肝衰竭基础,机体抵抗力差,防御屏障受损,易出现感染并发症,且与主要感染部位如呼吸道、腹腔及泌尿系感染的常见定植菌有关。
部分ACLF患者因肝病相关临床症状重,而咳嗽、咳痰、腹痛和尿痛等感染相关临床症状不典型被掩盖,而ACLF患者常伴随骨髓造血功能抑制、脾功能亢进,临床检测WBC水平低于正常值下限,甚至出现严重感染时检测WBC水平仍正常,导致ACLF合并感染的早期诊断有一定困难。血清PCT水平适用于细菌感染的临床诊断,评判感染的严重程度[9]。但也有研究报道,PCT的浓度可间接反映肝细胞受损的程度,严重的肝细胞损伤可能对PCT诊断感染的价值有一定的影响,进而降低了PCT对肝衰竭患者合并感染时的诊断效价[7,10]。因此,寻找诊断特异性高的血清学指标并与PCT联合联合检测对肝衰竭合并感染患者的临床诊断有重要价值。
sCD14-ST主要分布在血清中,对机体炎性反应、感染性休克及脏器功能衰竭的发生发展具有重要的意义[11]。在正常情况下,血清sCD14-ST低水平表达,而在脓毒症患者中显著升高,较PCT及CRP上升更早、速度更快[12]。本研究显示,ACLF合并脓毒症患者血清sCD14-ST、PCT、CRP及NE水平均明显高于非脓毒症组,进一步分析ACLF脓毒症患者病原学阳性组血清sCD14-ST和PCT较病原学阴性组明显升高,提示血清sCD14-ST和PCT水平可以间接提示患者感染情况严重,病情凶险,分析可能原因为:ACLF患者常因肠道屏障功能受损而肠道菌群功能失衡,革兰阴性菌群增多常集中在肠道蓄积,导致内毒素大量释放,此时肝功能衰竭阶段枯否细胞也有受损,其对内毒素代谢能力明显降低,且慢性肝病基础肝衰竭多伴有门体分流现象,均导致肠源性内毒素进入体循环,进而导致血清sCD14-ST和PCT水平上升,推测可能随着病情的持续进展,血清sCD14-ST和PCT持续释放可能成为患者病情恶化的间接判断指标。相关性分析及ROC曲线显示,ACLF脓毒症组血清sCD14-ST、PCT与CRP呈正相关,且血清sCD14-ST、PCT与CRP联合检测的曲线下面积最大,表明血清sCD14-ST、PCT与CRP联合检测在ACLF合并脓毒症的诊断中具有一定的临床价值。
综上,ACLF合并脓毒症常见感染部位为肺和腹腔,菌群以革兰阴性菌为主,血清sCD14-ST、PCT及CRP联合检测有助于早期甄别感染,协助明确诊断。但由于本研究样本量有限,且各指标仅能反应疾病早期,本次研究未对疾病不同病程进行动态监测,也未分析基础疾病的相关并发症等因素,希望在今后的研究中能进一步扩充样本量并细化分层研究。
利益冲突所有作者均声明不存在利益冲突
