1~12岁儿童接种国产冻干水痘减毒活疫苗的安全性和免疫效果评价
2021-09-17高招吴志伟叶祥忠李敏捷辛延涛李生军沈正军苏玉坡靳飞宋巧巧赵玉良马景臣
高招 吴志伟 叶祥忠 李敏捷 辛延涛 李生军 沈正军 苏玉坡 靳飞宋巧巧 赵玉良 马景臣
1河北省疾病预防控制中心疫苗临床研究所,石家庄050021;2北京万泰生物药业股份有限公司102206;3大名县疾病预防控制中心疫苗临床研究项目办公室,河北邯郸056900;4华北理工大学公共卫生学院,河北唐山063000
水痘是由水痘-带状疱疹病毒(VZV)引起、以发热和全身散发瘙痒性疱疹为主要特征的儿童常见传染病,据WHO估计,全球每年约有420万例水痘严重并发症病例和约4 200例水痘相关死亡病例[1]。接种水痘减毒活疫苗是预防水痘及其并发症最有效的办法,北京万泰生物药业股份有限公司对自身生产工艺和质量标准进行完善,并依据Ⅰ期、Ⅱ期临床试验数据优化疫苗配方研制了冻干水痘减毒活疫苗,本研究对该疫苗接种于1~12岁儿童的安全性和免疫效果进行评价,现报道如下。
对象与方法
一、研究对象
2018年10月至2020年12月在河北省疫苗临床试验基地大名县疾病预防控制中心开展研究,招募当地常住户籍人口1~12岁儿童为志愿者,入组1 080名受试者。纳入标准:入组当天年龄1~12岁,腋下体温≤37.0℃。排除标准:有过敏、惊厥、癫痫、脑病和精神病等病史或家族史者;曾接种过水痘减毒活疫苗,或既往有水痘、带状疱疹病毒感染发病史者;对研究疫苗中任一成分或抗菌药物过敏,或既往有任何疫苗接种严重过敏史者;患免疫缺陷症、恶性肿瘤治疗期间、接受免疫抑制剂治疗者等。采用随机、盲法、同类疫苗对照的设计,将1 080名受试者按1∶1的比例区组随机分配到试验组和对照组,分别接种1剂试验疫苗和对照疫苗。接种部位为上臂外侧三角肌下缘附着处皮下注射。本临床试验通过河北省疾病预防控制中心伦理委员会审批(审批号:IRB2017-005)。所有受试者的监护人均签署知情同意书。
二、样本量计算
以易感人群全程免疫后30 d血清VZV抗体阳转率作为有效性评估的替代指标,通过检验试验组和对照组抗体阳转率的非劣效性评价试验疫苗的有效性。样本量估计假设:α=0.025(单侧);δ=0.1(非劣效性界值);β=0.1(把握度90%);假定试验疫苗预期阳转率为98%,试验组和对照组样本分配比例1∶1,采用Miettinen&Nurminen方法计算样本量,每组需要82名,合计164名,如考虑免疫前阴性人群约40%,至少需要410名。考虑试验过程中可能的脱落(约15%)及Ⅲ期临床试验安全性观察例数要求等情况,计划入组1~12岁受试者1 080名。
三、研究疫苗
试验疫苗是北京万泰生物药业股份有限公司研制的冻干水痘减毒活疫苗,本品系用VZV减毒株接种人二倍体细胞MRC-5,经培养、收获病毒液,加适宜稳定剂冻干制成。规格:按标示量复溶后每瓶为0.5 mL,每1次人用剂量为0.5 mL,含Oka株VZV活病毒应不低于3.3 lg PFU;病毒含量:成品病毒滴度为4.2 lg PFU/mL;疫苗批号及有效期:SZ201803808(2019年07月29日)。对照疫苗是上海生物制品研究所有限责任公司生产冻干水痘减毒活疫苗,规格:复溶后每瓶体积为0.5 mL,每1次人用剂量为0.5 mL,含VZV活病毒应不低于3.3 lg PFU;病毒含量:含VZV活病毒应不低于3.3 LgPFU;批签发合格证编号:批签中检20174260;疫苗批号及有效期:201708025(2019年8月10日)。所有疫苗均在2~8℃条件下保存、运输,在有效期内完成使用。
四、免疫原性评价
疫苗接种前和接种后第30天采集静脉血2.5~3.0 mL,用于检测抗VZV抗体。分离血清于-20℃以下保存,委托中国食品药品检定研究院进行抗体检测。采用抗体阳转率和抗体几何平均滴度(GMT)及阳性率作为免疫原性评价指标。
抗体阳转定义:免疫前抗体滴度<1∶8,免疫后抗体滴度≥1∶8。阳转率:接种疫苗后抗体阳转人数/接种疫苗的人数×100%。抗体4倍增长定义:免疫前抗体滴度≥1∶8,免疫后抗体滴度≥4倍增长。4倍增长率=接种疫苗后抗体4倍增长人数/接种疫苗人数×100%。
五、安全性观察
所有研究对象接种疫苗后需在现场留观30 min,观察接种疫苗后30 min内的即时反应,通过日记卡和联系卡收集研究对象接种疫苗0~30 d的所有不良反应。对收集到的不良反应结果按照《预防用疫苗临床试验不良事件分级标准指导原则》进行分类判定。不良反应严重程度按照如下原则进行判定:1级(轻度)为短时(<48 h)或轻微不适,不影响活动,无需治疗;2级(中度)为轻度或中度活动受限,可能需就诊、不需或仅需轻度治疗;3级(重度)为活动明显受限,需就诊并接受治疗,可能需要住院;4级(危重)为可能威胁生命,活动严重受限,需监护治疗;5级(死亡)。
六、统计学方法
原始数据录入到电子数据捕获系统(EDC),生成导出到Excel 2019数据库,采用SAS9.4软件进行统计分析。采用Clopper-Pearson方法计算阳转率及其双侧95%CI,采用χ2检验率法对组间差异进行统计学检验,采用经对数转换的成组t检验比较试验组和对照组受试者免疫后抗体GMT的差异,绘制试验组和对照组免疫前后抗体滴度逆分布图。釆用Fisher精确概率法,比较两种疫苗接种后的不良反应发生率差异。双侧检验,检验水准α=0.05。
结 果
一、基本情况
入组1 080名受试者,1 079名受试者接种疫苗并完成了安全性观察,1 079名受试者完成了免疫原性观察,见图1。试验组年龄(5.62±3.31)岁,男性289人,女性250人;对照组年龄(5.55±3.25)岁,男性268人,女性272人。试验组与对照组研究对象在年龄和性别上的构成基本均衡(t=-0.346,χ2=1.720,P均>0.05)。
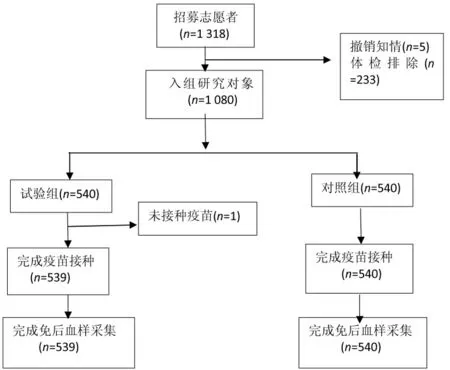
图1 1~12岁儿童接种1剂次国产冻干水痘减毒活疫苗研究流程图
二、疫苗免疫原性
免疫前,试验组抗体滴度<1∶8者为250名,对照组为231名,组间比较差异无统计学意义(χ2=0.489,P>0.05);试验组抗体滴度≥1∶8者为289名,对照组为309名,组间比较差异无统计学意义(χ2=1.418,P>0.05)。试验组和对照组抗体水平分布均衡。
接种免疫后,试验组和对照组抗体阳转率分别为96.00%(240/250)和88.74%(205/231),差异有统计学意义(χ2=9.128,P<0.01)。试验组和对照组抗体4倍增长率分别为90.31%(261/289)和70.87%(219/309),差异有统计学意义(χ2=35.622,P<0.01)。试验组抗体阳转(4倍增长)率92.95%(501/539),高于对照组的78.52%(424/540)(χ2=45.915,P<0.01)。试验组免疫后30 d抗体≥1∶128的比例61.97%(334/539),对照组为38.33%(207/540),差异有统计学意义 (χ2=60.266,P<0.01)。试验组免疫后30 d抗体GMT为192.42,对照组为85.65,差异有统计学意义(t=7.683,P<0.01)。免前抗体滴度<1∶8人群中,试验组和对照组免疫后30 d的GMT分别为79.89和21.73,差异有统计学意义(t=12.575,P<0.01)。免前抗体滴度≥1∶8人群中,试验组和对照组免疫后30 d的GMT分别为411.61和238.80,差异有统计学意义(t=4.210,P<0.01)。见表1、表2和图2。
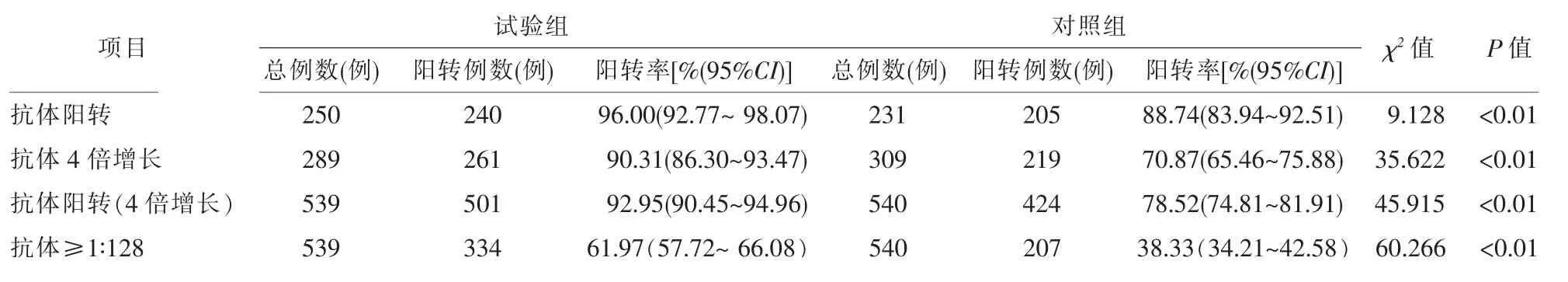
表1 1~12岁儿童接种国产1剂次水痘减毒活疫苗后抗体阳转率比较
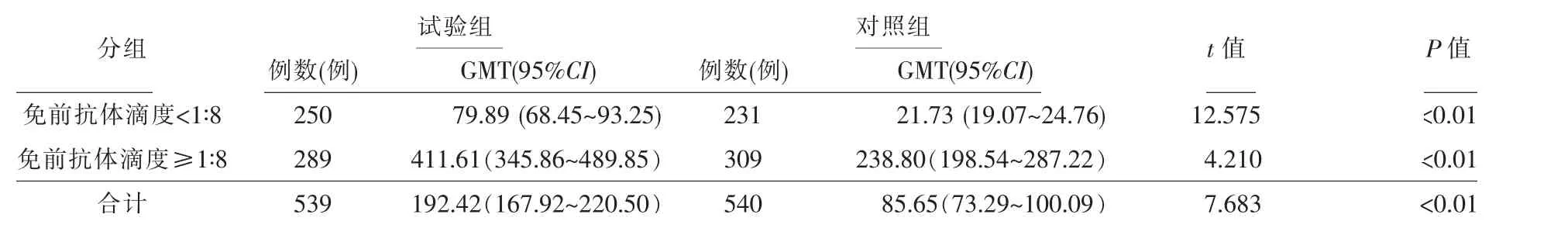
表2 1~12岁儿童接种1剂次水痘减毒活疫苗后抗体GMT比较

图2 1~12岁儿童免疫前与全程免疫后30 d抗体滴度逆分布图
三、疫苗安全性
由表3可见,共273例受试者发生459例次不良反应,不良反应发生率25.30%(273/1 079),其中试验组130例受试者发生200例次不良反应,发生率为24.12%(130/539),对照组143例受试者发生259例次不良反应,发生率为26.48%(143/540),两组不良反应发生率差异无统计学意义(P>0.05)。试验组和对照组全身不良反应发生率分别为23.38%(126/539)和24.44%(132/540),差异无统计学意义(P>0.05)。常见的全身不良反应中,试验组恶心/呕吐的发生率为0.93%(5/539),低于对照组的3.33%(18/540),差异有统计学意义(P<0.01),其他症状发生率两组间差异无统计学意义(P>0.05)。试验组和对照组局部不良反应发生率分别为2.04%(11/539)和3.70%(20/540),差异无统计学意义(P>0.05)。常见的局部不良反应以发红、肿和疼痛为主,各局部反应发生率两组间差异均无统计学意义。
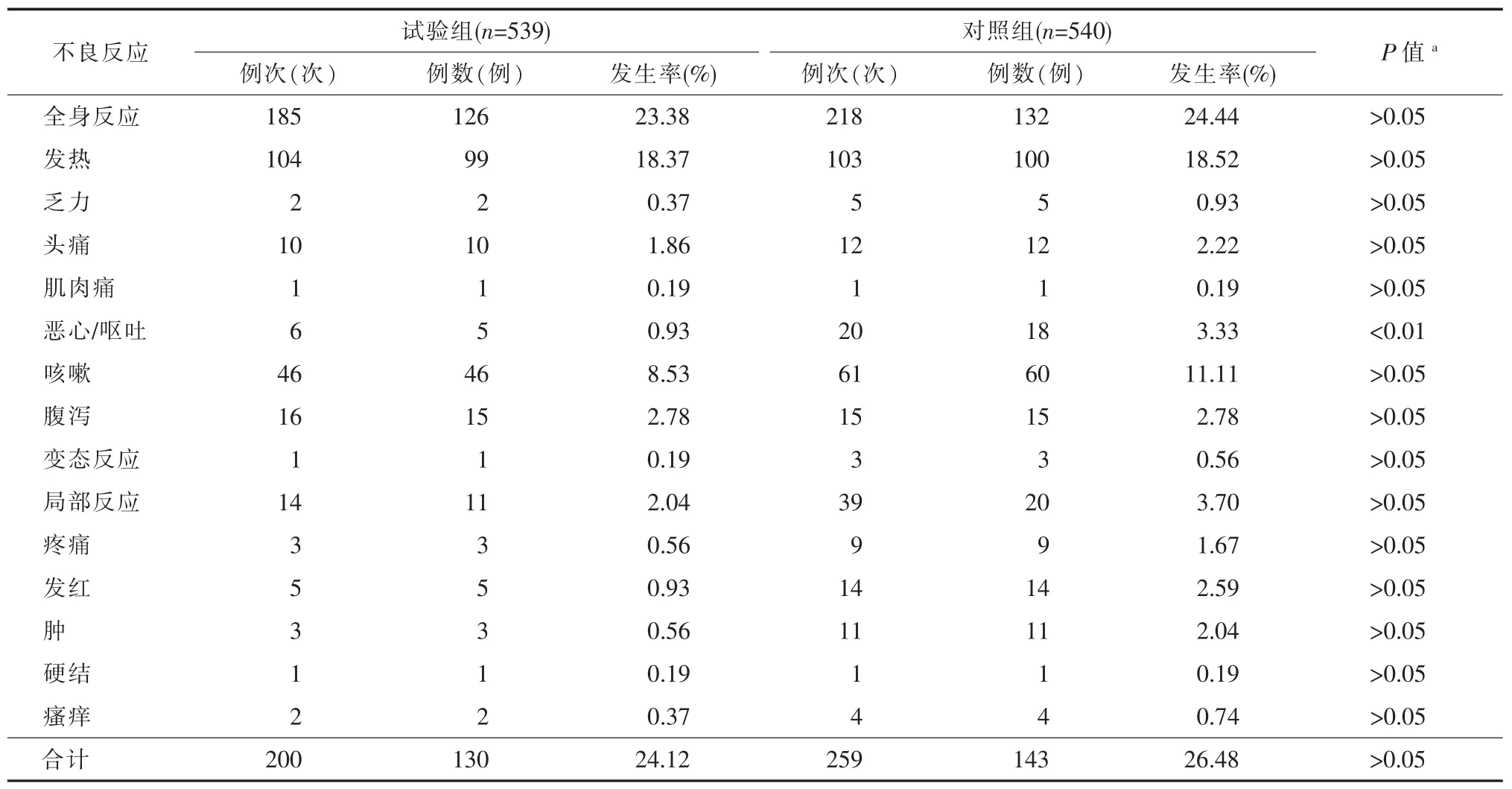
表3 1~12岁儿童接种国产1剂水痘减毒活疫苗后30 d内不良反应发生率比较
表4可见,试验组与对照组严重程度1级的不良反应发生率分别为11.13%和12.96%;2级不良反应发生率分别为14.84%和18.83%;3级不良反应发生率分别为2.23%和2.59%,两组间差异均无统计学意义(P>0.05)。两组均未发生与疫苗接种有关的严重不良事件。
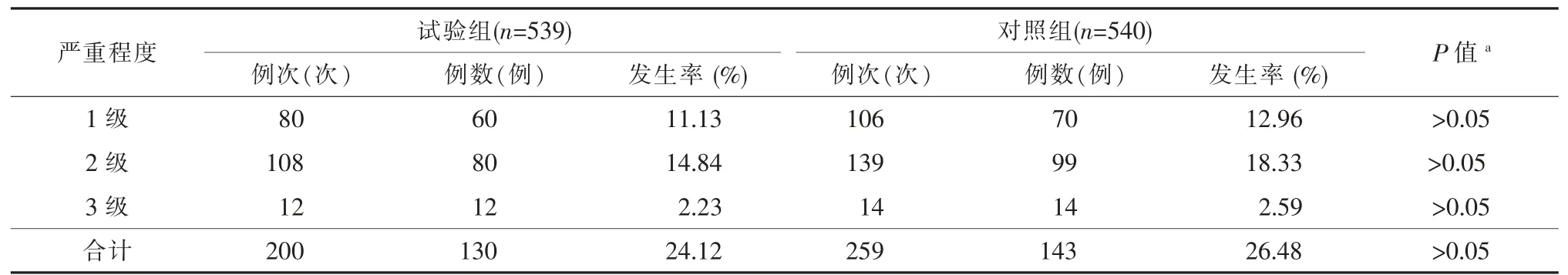
表4 1~12岁儿童接种1剂水痘减毒活疫苗后不良反应严重程度发生率比较
讨 论
有报道指出,水痘疫苗的接种使得全球每年因感染VZV出现重症病例而导致住院甚至死亡的患者数量明显减少[2]。然而,1剂次水痘疫苗受种者体内保护性抗体滴度会随着时间推移逐渐降低[3-4],并且低疫苗覆盖率无法在人群中建立免疫屏障,不能有效阻断因病毒传播而出现突破性水痘病例[5-8]。截至2017年,全球已有35个国家将水痘疫苗作为常规接种疫苗纳入免疫规划[2],中国台湾地区[9]率先于2004年实施1剂次水痘疫苗免费接种计划后,儿童水痘发病率降低了75%~80%。为进一步降低国内水痘疾病负担,提高疫苗覆盖率。本研究采用单中心、随机、双盲、同类疫苗对照的非劣效性试验设计,对北京万泰生物药业股份有限公司研制的1剂次冻干水痘减毒活疫苗开展Ⅲ期临床研究,评价其免疫原性和安全性,从而推动此新疫苗的注册上市。
抗体阳转和4倍增长是疫苗免疫接种成功最重要的标志。本研究结果显示,试验组抗体阳转率为96.00%,稍低于Hao等[10]的研究结果(98.0%);试验组和对照组抗体4倍增长率分别为90.31%和70.87%,说明与对照疫苗相比,试验疫苗能诱导机体产生更强的免疫反应。
受试者接种疫苗后不良反应总体发生率为25.30%,多发生在0~14 d内。严重程度以1级和2级(轻度和中度)为主,占全部不良反应的91.80%,与以往的相关报道相符[11-12]。收集到的不良反应以发热、咳嗽、疫苗接种部位疼痛、发肿和轻度红斑为主,且严重程度较低,是疫苗接种最常见的反应,这与文献[13]报道的研究结果相似。试验组和对照组全身反应发生率分别为24.26%和23.38%,局部反应发生率分别为3.70%和2.04%,较其他研究报道的结果高[11-12],主要原因可能是本研究受试者对疫苗接种后发生的各类不良反应重视程度更高,收集更加全面。较早的研究表明,瘙痒等局部变态反应与水痘减毒活疫苗中动物源性明胶稳定剂有关[14-15]。1999年后国内外各水痘疫苗生产企业相继去除动物源性明胶稳定剂并进行成分优化,可能是降低局部不良反应发生率的重要原因。分类对比和亚组分析发现,除恶心/呕吐外,试验组和对照组间各类不良发生率的差异均无统计学意义(P>0.05),试验组发生率更低。
综上所述,1试剂试验冻干水痘减毒活疫苗接种于1~12岁儿童后安全性良好,同时具有较好的免疫原性。
利益冲突北京万泰生物药业股份有限公司提供项目实施经费,所有作者均声明不存在利益冲突
