大肠杆菌D-乳酸脱氢酶(FAD)的分子克隆与酶学性质
2021-09-17冯静茹于立雪田康明牛丹丹王正祥
冯静茹,于立雪,田康明,牛丹丹,王正祥*
1(天津科技大学 化工与材料学院,天津,300457) 2(天津科技大学 生物工程学院,天津,300457)
乳酸是生物体厌氧代谢的重要有机酸,存在D-乳酸和L-乳酸2种光学构型[1]。L-乳酸已经工业化生产并应用于食品、饲料、饮料和聚乳酸制备等行业[2];D-乳酸也是聚乳酸、药物合成等的重要原料[3]。由于人体不具有代谢D-乳酸的酶系,食品工业中使用的乳酸产品不希望有D-乳酸的存在[4]。现有乳酸含量测定多采用滴定法[5-6],无法区分乳酸的光学构型。D-乳酸测定方法完全依赖配有特定分离柱的高效液相色谱(high performance liquid chromatography,HPLC)法[7-9]。因此,实现对D-乳酸的快速定量分析,是研究和开发利用D-乳酸的重要内容。
已有研究揭示,多种微生物具有以D-乳酸为唯一碳源生长的能力。这类具有代谢D-乳酸能力的微生物,通常能够表达一种以黄素腺嘌呤二核苷酸(flavine adenine dinucleotide,FAD)作为辅酶的氧化型乳酸脱氢酶,能够催化D-乳酸氧化脱氢为丙酮酸,同时将FAD还原为黄素腺嘌呤二核苷酸递氢体(flavine adenine dinucleotide,reduced,FADH2),所形成的丙酮酸则作为代谢中间体参与其生理代谢[10]。在真核微生物细胞中,FAD依赖型D-乳酸脱氢酶位于线粒体内膜的细胞质侧,是参与电子转移的外周膜呼吸组分;在原核细胞中,此酶主要位于细胞膜的内侧[11-12]。FAD依赖型D-乳酸脱氢酶的结构与其他FAD依赖型蛋白家族最显著的区别在于膜结合区域,有研究报道FAD依赖型D-乳酸脱氢酶的膜结合结构域呈阳性电荷表面,有6个Arg和5个Lys残基,可能与膜上带负电荷的磷脂头基团相互作用,使与膜的结合是通过静电力而非疏水力[13-14]。此外,以D-乳酸作为底物,在FAD依赖型D-乳酸脱氢酶作用下,转移2个电子和2个质子到电子传递链,该反应还与细胞的各种氨基酸和糖的主动运输有关[12,14]。
通过对大肠杆菌基因组序列分析发现,大肠杆菌具有编码FAD依赖型D-乳酸脱氢酶的编码基因dld,但其性质和功能未被解析[15]。为此,本文通过分子克隆技术,对大肠杆菌dld基因进行克隆与表达,并对其表达产物的酶学性质进行了分析。研究结果可为酶法定量检测D-乳酸提供重要理论基础。
1 材料与方法
1.1 菌株与质粒
EscherichiacoliJM109用于本研究的分子克隆与表达宿主,为本实验室保藏;E.coliB0013为本实验室前期分离保藏[15],用于本研究D-乳酸脱氢酶的编码基因dld的供体;pND-113为大肠杆菌分泌表达载体[16]。
1.2 酶与试剂
限制性内切酶,宝生物工程(大连)有限公司;质粒提取试剂盒,Omega Bio-tec;胰蛋白胨、酵母浸粉,OXOID公司;吩嗪硫酸甲酯(phenazine methosulfate,PMS)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethyl-2-Thiazolyl)-2,5-diphenyl tetrazolium bromide,MTT),Sigma-Aldrich;黄素腺嘌呤二核苷酸二钠盐水合物(FAD-Na2),国药集团化学试剂有限公司。
1.3 培养基
LB培养基(g/L):胰蛋白胨10,酵母抽提物5,NaCl 10,pH 7.0;加入20 g/L的琼脂为固体培养基。
1.4 基因克隆与重组菌构建

1.5 酶液制备、纯化与鉴定
从平板上挑取2~3个大小均一的单菌落接种于50 mL液体培养基中,在37 ℃、200 r/min条件下培养12 h,按照5%的接种量转接到50 mL LB液体培养基,在37 ℃、200 r/min条件下培养24 h,离心收集菌体。每50 mL发酵液收集到的菌体加10 mL缓冲液(含0.5%的TritonX-100)重悬,经细胞破碎仪破碎得到细胞裂解液,12 000 r/min,离心5 min,收集上清液,即为粗酶液[17]。将粗酶液经200~600 g/L(质量浓度)硫酸铵分级沉淀,再经PD-10脱盐柱和Ni-NTA纯化树脂预装柱进行纯化,通过酶活力测定和SDS-PAGE方法分析纯化情况,其中SDS-PAGE使用12%分离胶和5%浓缩胶。
1.6 酶活力测定
参照文献[18-19]进行改进。每毫升反应体系中包含20 mg/mL的PMS 5 μL,20 μmol/mL的FAD-Na25 μL,5 mg/mL的MTT 50 μL,1 mg/mL的D-乳酸500 μL,50 μL适当稀释的酶液,并用0.067 mol/L的pH 7.0的KH2PO4-K2HPO4缓冲液补足到1 mL。在35 ℃、pH 7.0的条件下反应20 min,冰浴5 min终止反应,测定570 nm下的吸光度。以灭活酶液作为对照。酶活单位(u)定义为:在35 ℃、pH 7.0的条件下,每分钟还原1 μmol MTT所需酶量定义为1个酶活力单位。
1.7 酶学性质分析
1.7.1 最适温度及热稳定性
在pH 7.5,分别测定20、25、30、35、40、45、50和55 ℃下的酶活力,以最高酶活力为100%,计算其他温度下的相对酶活力,进而确定最适反应温度。将酶液分别在30、35、40和45 ℃下保温处理150 min,每隔30 min取样,按1.6中方法测定剩余酶活力,以未经处理的酶液酶活力为100%,确定其热稳定性。
1.7.2 最适pH及pH稳定性
在最适反应温度下,用pH 5.0~8.5的缓冲液适当稀释酶液,测定对应pH条件下的酶活力,以最高酶活力为100%,计算其他pH条件下的相对酶活力,确定酶的最适反应pH。将酶液于不同pH 5.0~8.5、25 ℃条件下放置1 h,按1.6中方法测定残余酶活力,以未处理的酶液酶活力为100%,确定其pH稳定性。
1.7.3 金属离子及相关化学试剂对酶活力的影响
配制不同金属离子溶液(Na+、K+、Mg2+、Ca2+、Mn2+、Zn2+、Cu2+)和化学试剂(EDTA、SDS),将酶液分别与5 mmol/L的金属离子或化学试剂混合,按1.6中方法测定样本酶活力,以缓冲液代替金属离子或化学试剂作为对照,确定不同金属离子及化学试剂对酶活力的影响。
1.7.4 底物特异性
分别以1 mg/mL的D-乳酸、L-乳酸、丙酮酸、D-半乳糖醛酸、D-丙氨酸、丁二酸和α-酮戊二酸为底物,按1.6中方法测定该酶对不同底物的酶活力。
1.8 酶动力学参数测定
参照文献[20]进行。分别以0.01、0.02、0.05、0.10、0.50、1.00 mg/mL的D-乳酸为底物,在最适反应条件下按1.6中方法测定酶活力,采用双倒数法作图(Lineweaver-Burk法)并进行酶反应动力学参数计算。
2 结果与分析
2.1 dld的分子克隆表达与重组Dld(rDld)的制备与纯化
以大肠杆菌基因组B0013为模板,通过PCR扩增获得完整的D-乳酸脱氢酶基因片段dld,酶切后克隆入表达载体pND-113中,获得重组表达质粒pND-Dld。进一步采用双脱氧核苷酸链终止法对其进行核苷酸序列测定与分析,dld大小为1 497 bp,编码499个氨基酸残基,Dld的预测分子质量约为55 ku。经DNAMAN和MEGA-X分析发现,Dld氨基酸序列与来源于Achromobacter的D-乳酸脱氢酶(A0A0M7 N8L3)相似程度最高,序列一致性为100%,与Klebsiellaoxytoca(A0A181XSC2)、Raoultellaplanticola(A0A2X2EIS0)和Serratia(A0A084A2I9)的D-乳酸脱氢酶的序列一致性分别为91.3%、89.7%和67.2%,与其他来源的D-乳酸脱氢酶相似度较低(图1)。进一步通过UniProt分析发现,所克隆的Dld分子中的Glu468、Gln497和Ala527残基组成其催化活性中心,Gly143、Ser150、Gly160和Val262为FAD辅酶结合位点。其中,Leu303-Lys323和Lys484-Gly504可能构成其膜结合结构域(图2)。
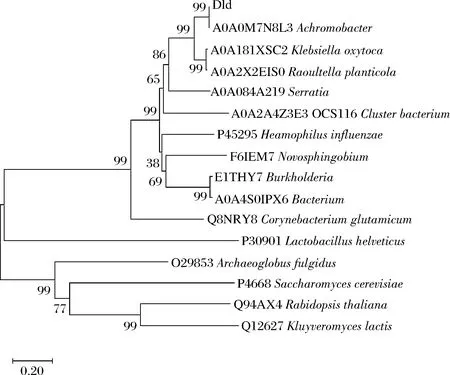
图1 大肠杆菌Dld的系统发育树Fig.1 The phylogenic tree of Dld from E.coli

图2 大肠杆菌Dld的3D模拟结构Fig.2 The mimic 3D structure of Dld from E. coli
将含有重组表达质粒pND-Dld的菌株JM109(pND-Dld)摇瓶发酵24 h,离心收集菌体。经细胞破碎,离心收集上清液得到粗酶液。粗酶液经200~600 g/L(质量浓度)硫酸铵分级沉淀,再经PD-10脱盐柱和Ni-NTA纯化树脂预装柱进行纯化。结果如图3所示,纯化后rDld的分子质量约为55 ku。
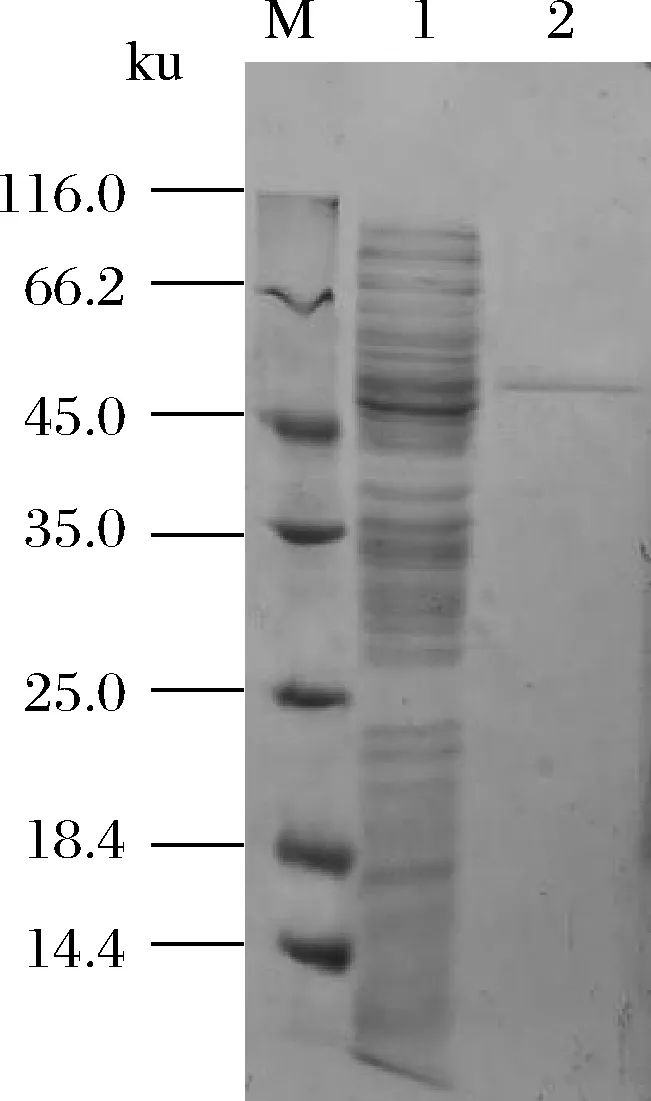
M-蛋白质标准样品;1-粗酶液;2-纯化后酶液图3 纯化后rDld的SDS-PAGE图谱Fig.3 The SDS-PAGE profile of rDld
2.2 rDld的酶学性质
2.2.1 最适作用温度
在pH 7.5条件下,测定20~55 ℃ rDld的酶活力,结果汇总于图4-a。rDld的最适作用温度为35 ℃;温度上升到45 ℃时,相对酶活力显著降低至71.7%;当温度为55 ℃时,相对酶活力仅为8.1%。
2.2.2 最适作用pH
在最适温度下测定pH 5.0~8.5 rDld酶活力,获得了不同pH对酶活力的影响曲线(图4-b)。可知,rDld的最适作用pH值为7.0,pH 7.0~8.5酶活力变化较小;当pH由7.0降低到6.5时,酶活力下降较明显;而在pH 5.0时相对酶活力仅为15.2%。
2.2.3 热稳定性
将酶液在不同温度下保温150 min,定时取样分析剩余酶活力,结果见图4-c。rDld在30~40 ℃条件下孵育2 h后仍保留80%的酶活力;在45 ℃孵育0.5 h后其酶活力显著降低,其相对酶活力仅为59.6%,孵育1 h后相对酶活力仅剩31.3%。可以看出,rDld在30~40 ℃下具有较好的热稳定性。
2.2.4 pH稳定性
将酶液在不同pH缓冲液中室温放置1 h后测其剩余酶活力,结果见图4-d。rDld在pH 7.0和pH 7.5下具有较好的稳定性;在pH 5.0~6.5条件下保温1 h酶活力仍在85%以上;当在pH 8.0条件下孵育1 h,酶活力下降较明显,剩余酶活力为75%。
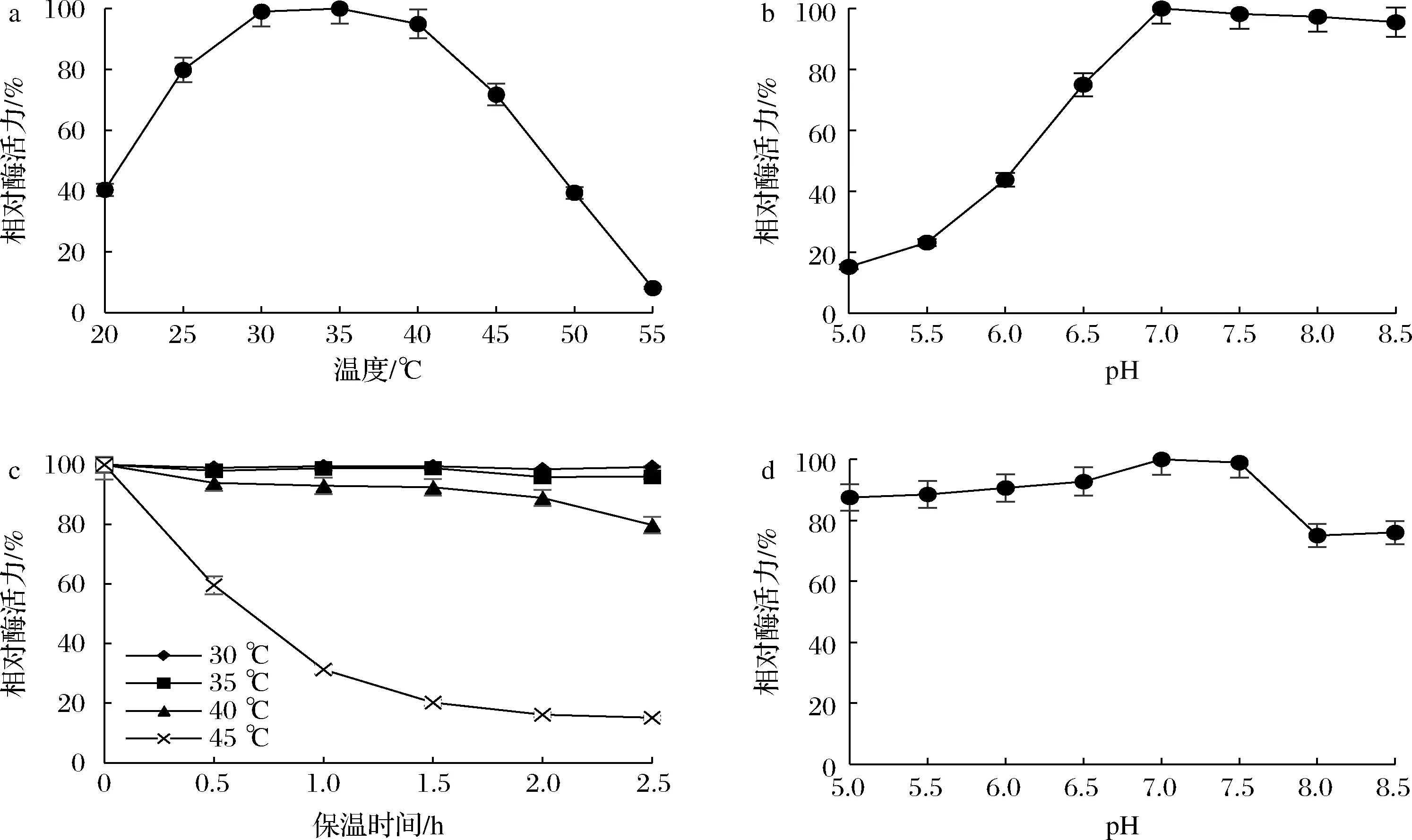
a-最适作用温度;b-最适pH;c-热稳定性;d-pH稳定性图4 rDld的最适作用温度和pH及其稳定性Fig.4 Optimal temperature and pH of rDld and its thermal and pH stability
2.2.5 金属离子和化学试剂对酶活力的影响
按照1.7.3中方法研究金属离子和化学试剂对酶活的影响,结果汇总于表1。7种常见金属离子和2种化学试剂中,Zn2+对rDld有明显促进作用。该性质与文献报道的Archaeoglobusfulgidus来源的D-乳酸脱氢酶添加Zn2+后酶活力大幅提高相类似[12]。Mn2+、Cu2+、Mg2+和SDS对rDld有明显的抑制作用。
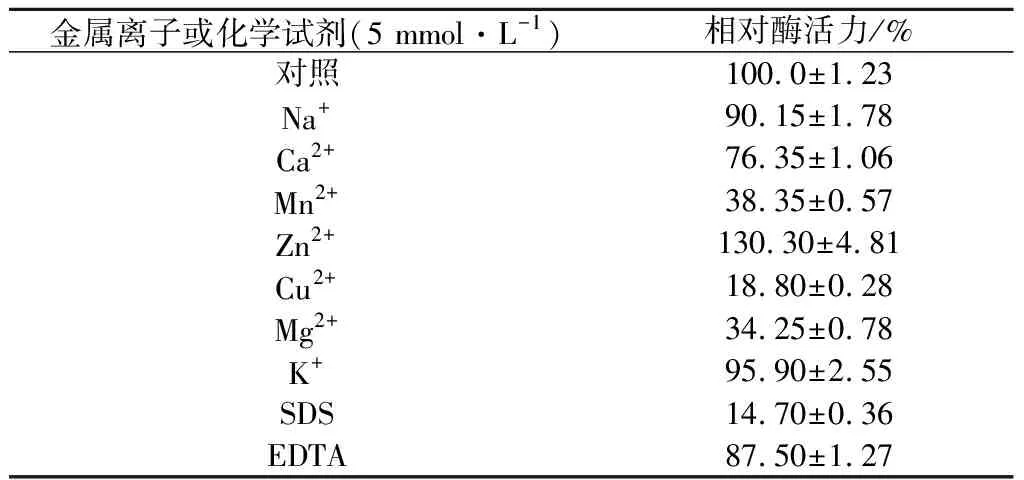
表1 金属离子和化学试剂对酶活力的影响Table 1 Effect of metal ions and chemicals on the enzyme activity
2.2.6 底物特异性
在最适反应温度和pH条件下,将酶液与1 mg/mL下的D-乳酸、L-乳酸、丙酮酸、D-半乳糖醛酸、D-丙氨酸、丁二酸和α-酮戊二酸反应,结果显示,rDld的最适底物为D-乳酸;rDld对丁二酸和α-酮戊二酸呈现出较低活性,对L-乳酸、丙酮酸、D-半乳糖醛酸和D-丙氨酸未表现出活性。

表2 rDld的底物特异性Table 2 The substrate specificity of rDld
2.3 rDld的动力学特征
分别以0.01、0.02、0.05、0.10、0.50、1.00 mg/mL的D-乳酸为底物,按1.6中方法,在最适反应条件下测定酶活。采用Lineweaver-Burk双倒数作图法,以1/[S]为横坐标,1/[V]为纵坐标,得到rDld的动力学相关特征参数,其中Km值和Vmax值分别为0.057 mg/mL和0.054 μmol/(mL·min),kcat值为0.275 min-1,kcat/Km为0.435 mL/(mg·min)。
3 结论
本研究成功获得了一种催化D-乳酸生成丙酮酸正向反应的FAD依赖型D-乳酸脱氢酶,并对其酶学性质进行了全面分析,为D-乳酸脱氢酶的进一步研究提供了可靠生物材料,也为D-乳酸的酶法定量检测方法的建立与应用提供了工具。
