不同脂肪处理纯化方法对移植脂肪组织的影响
2021-09-17陈兵李发成
陈兵 李发成
自体脂肪移植,手术操作简单,创伤小,恢复快,效果好,并且组织来源充足,无排斥反应,因而被广泛应用于修复各类软组织缺损以及美容外科领域,尤其在乳房外科中的应用愈发得到整形外科的重视和认可[1]。然而,在临床应用中,特别是大体积脂肪移植时,移植脂肪存在较高的吸收率和坏死率,体积保留率仅为50%~70%[2-3]。因此,提高移植后的脂肪组织成活率一直是自体脂肪移植领域的研究重点。
为了促进移植脂肪存活再生,提高脂肪移植效率,通过添加外源性促成脂、促血管化刺激来辅助脂肪移植,在一定程度上有效提高了脂肪移植存活率,已应用的方法包括细胞辅助脂肪移植技术(CAL)[4-5]、添加富血小板血浆(PRP)[6-7]、脂肪源干细胞基质胶(SVF-gel)[8-9]以及脂肪脱细胞提取液[10]等。自体脂肪移植术后的效果,还取决于术中的操作和处理,包括脂肪的抽吸、处理纯化以及注射技术等。其中,脂肪的处理纯化方法是影响脂肪移植成活率的主要因素之一,处理纯化后的脂肪组织应含尽量少的水、油脂颗粒、血液来源细胞以及细胞碎片,尽可能保持脂肪细胞的完整性,且富含脂肪干细胞。因此,优化脂肪的处理纯化技术,提高脂肪移植效率是临床一直关注和致力于解决的问题。
目前,脂肪的处理纯化方法主要有静置沉淀法、清洗沉淀法、离心法与过滤浓缩法等。静置沉淀与清洗沉淀法操作简单、对组织破坏小,但浓缩效率偏低;离心法是应用最广泛的脂肪浓缩处理方法,但争议也较大。Kurita 等[11]认为,离心法能较大程度地浓缩脂肪组织,提高单位体积移植物中脂肪细胞数目与脂肪干细胞的比例。雷华等[12]则认为,无论是高速还是低速离心,脂肪颗粒的活性都会受损,建议慎用离心法处理纯化脂肪颗粒。Conde-Green等[13]比较了静置法、清洗法和离心法处理纯化的脂肪组织中的细胞数量、细胞膜完整性以及脂肪干细胞数量,认为清洗法最大限度上保留了脂肪细胞活性以及内皮细胞和脂肪干细胞的数量。
为了对比不同的纯化方法对移植脂肪的影响,本研究比较了静置沉淀法、清洗沉淀法、离心法和棉垫吸附浓缩法4 种临床最常用的脂肪处理纯化方法,体外观察脂肪组织的细胞完整性、脂肪细胞活性、脂肪组织内水和油脂含量、SVF 细胞数量、脂肪干细胞含量等体外研究指标,并构建裸鼠脂肪移植模型进行体内验证,为优化脂肪移植技术、提高脂肪移植后存活效率提供理论依据。
1 材料与方法
1.1 实验试剂及仪器
低糖DMEM 培养基(Hyclone,美国),胎牛血清(Gibco,美国),Ⅰ型胶原酶(Sigma,美国),甘油-3-磷酸脱氢酶检测试剂盒(Kamiya,美国),Perilipin A抗体(Abcam,美国),CD45、CD31、CD34、CD105 流式抗体(BD,美国)。
倒置相差显微镜(Olympus BX5,日本),Megaf Uge 离心机(Thermo Scientific,美国),AriaⅡ流式细胞仪(BD,美国),NanoDrop 2000c 微量分光光度计(Thermo Scientific,美国)。
1.2 脂肪组织的获取
脂肪组织取自20 位接受脂肪抽吸手术的健康女性。所有获取的脂肪组织随机平均分为4 组,分别采用静置沉淀法、清洗沉淀法、离心法和棉垫吸附浓缩法进行纯化处理,并用于后续实验。本研究经我院医学伦理委员会审核同意,所有患者均已签署知情同意书。
1.3 实验动物
BALD/c 裸鼠,6 周龄(中国军事医学科学院实验动物中心),由我院研究中心动物室喂养管理。实验过程中对动物的处置遵守科技部《关于善待实验动物的指导性意见》的相关规定。
1.4 脂肪组织分组与处理纯化
A 组,静置沉淀组,脂肪放置在20 mL 的注射器中,注射器垂直静置沉淀15 min。从上到下最终分为油脂层、脂肪组织层和液体层,去除上层油脂和底层液体层,保留中间脂肪组织用于后续实验(图1Aa)。
B 组,清洗沉淀组,脂肪经等体积生理盐水清洗2 遍,放置在20 mL 的注射器中,静置沉淀15 min,取中间层脂肪组织用于后续实验(图1Ab)。
C 组,离心组,脂肪放置在20 mL 的注射器中离心(1 200×g,3 min,4 ℃)。同样取中间层脂肪组织用于后续实验(图1Ac)。
D 组,棉垫吸附浓缩组,抽吸的脂肪经生理盐水清洗后倒入无菌棉垫,吸附浓缩去除水分和游离油脂(图1Ad)。
1.5 脂肪组织含水量和游离油脂含量测定
取各组处理纯化后的脂肪组织10 mL,分别放入15 mL 离心管中离心(1 200×g,3 min,4 ℃)。离心后,该组织成分按不同密度从上到下依次分为:游离油脂层、脂肪组织层和水液体层,分别测量游离油脂层、脂肪组织层和水液体层的体积占总体积的比例(图1B)。

图1 4 种纯化方法处理后脂肪组织的含水量及油脂含量Fig.1 Water content and oil content of lipoaspirate processed by 4 purification methods
1.6 SVF 计数与亚群统计
取每组处理纯化后的脂肪组织10 mL 置于50 mL离心管中,加入等体积含0.1% Ⅰ型胶原酶的DMEM 低糖培养基混合,置于37 ℃振荡箱中消化60 min 后,去除上清液,加入含10%胎牛血清的DMEM 低糖培养基重悬底部沉淀物,吹打混匀后离心(1 200×g,5 min)。去上清后,底部沉淀物振荡重悬于红细胞裂解液中,室温下放置5 min。沉淀物重悬于PBS 缓冲液,1 200×g离心5 min,该过程反复2 次。滤网过滤后,浓缩至1 mL 细胞悬液,移入1.5 mL的EP 管中,取细胞悬液10μL 进行有核细胞计数。
上述各组细胞定量后,将细胞悬液浓缩成每100μL 含1×106个有核细胞,分别移入1.5 mL 的EP 管中。各组SVF 细胞分别依次加入CD31、CD34、CD45、CD105 抗体,阳性、阴性对照组加入同型抗体,充分混合后避光冰浴30 min。用流式分析缓冲液清洗后,将上述细胞悬液滤网过滤入流式分析管,依次上机进行流式细胞分析。
1.7 脂肪细胞完整性和活性检测
1.7.1 脂肪细胞结构观察
各组脂肪组织用4%多聚甲醛固定,脱水,石蜡包埋,切片,HE 和免疫组化染色。镜下观察并比较4 种不同纯化方法处理的脂肪的组织学特点。HE染色用于观察组织镜下结构,脂周蛋白(Perilipin,PLIN)免疫组化染色用于观察脂肪细胞结构完整性。
1.7.2 脂肪细胞代谢活性检测
甘油-3-磷酸脱氢酶(G3PDH)活性可用于评估各组脂肪细胞活性,G3PDH 活性越高,移植物中脂肪细胞功能越好。参照使用说明书,应用G3PDH检测试剂盒定量检测G3PDH 活性,并根据公式G3PDH 活性(U/mL)=ΔOD×0.482×20 计算脂肪组织细胞内G3PDH 活性值。
1.8 动物试验
6 周龄BALD/c 裸鼠共60 只,分3 次进行脂肪组织移植,每次20 只裸鼠,按静置沉淀法、清洗沉淀法、离心法与棉垫浓缩法分为4 组,每次每组5 只裸鼠。
1.8.1 脂肪移植
每次脂肪组织取自于一位患者,脂肪的分组和处理纯化方法如前所述。1%戊巴比妥钠腹腔注射麻醉裸鼠后,应用1 mL 注射器将脂肪组织移植于裸鼠双侧背部,每侧背部移植脂肪量为0.5 mL,每侧移植面积为1 cm×2 cm,操作时注意多方向、多隧道、多点均匀注射。
1.8.2 大体观及称重
脂肪移植12 周后,颈椎脱臼法处死裸鼠,剪开皮肤取出移植脂肪组织,观察移植物组织形态并称重、记录,最后用4%多聚甲醛固定。
1.8.3 组织学分析
各组脂肪组织常规脱水和石蜡包埋后切片,HE染色和PLIN 免疫组化染色观察组织学特点。每组随机抽取10 张切片,每张切片随机选取5 个视野进行镜下双盲评估。每张切片根据有核脂肪细胞的完整性、囊肿或空泡的数量、纤维化及炎性反应程度分级。0 =无,1 =极少,2 =极少至中等,3 =中等,4 =中等至广泛,5 =广泛。
1.9 统计学方法
使用GraphPad Prism 8 进行统计分析,计量数据以表示,选择单因素方差分析对组间数据进行两两比较,P<0.05 表示差异具有统计学意义。
2 结果
2.1 处理纯化的脂肪组织含水量和细胞外油脂含量
各组处理纯化后的脂肪组织含水量(图1C):A组25.4%±3.2%,B 组24.5%±1.5%,C 组6.2%±2.3%,D 组6.6%±2.3%。A 组与B 组大于C 组与D 组(P<0.05);A 组与B 组含水量无统计学差异;C组与D 组含水量无统计学差异。
各组处理纯化后的脂肪组织细胞外油脂含量(图1D):A 组8.1%±3.4%,B 组6.9%±3.1%,C 组4.9%±2.1%,D 组2.0%±0.8%。A 组最高,与C 组及D 组相比有统计学差异(P<0.05);B 组大于C组及D 组(P<0.05);C 组细胞外油脂含量大于D组(P<0.05);D 组细胞外油脂含量最低,与其余各组相比均有统计学差异(P<0.05)。
2.2 SVF 细胞数量与流式细胞分析结果
各组处理纯化的脂肪组织中SVF 细胞数量:A组(1.78±0.78)×106/mL,B 组(2.07±0.91)×106/mL,C 组(2.96±1.44)×106/mL,D 组(2.87±0.89)×106/mL。A 组SVF 数量小于C 组 与D 组(P<0.05),其余各组无统计学差异(图2A)。
CD45+细胞:A 组大于D 组(P<0.05);CD31+CD45-细胞:B 组大于A 组(P<0.05)。余无统计学差异(表1)。
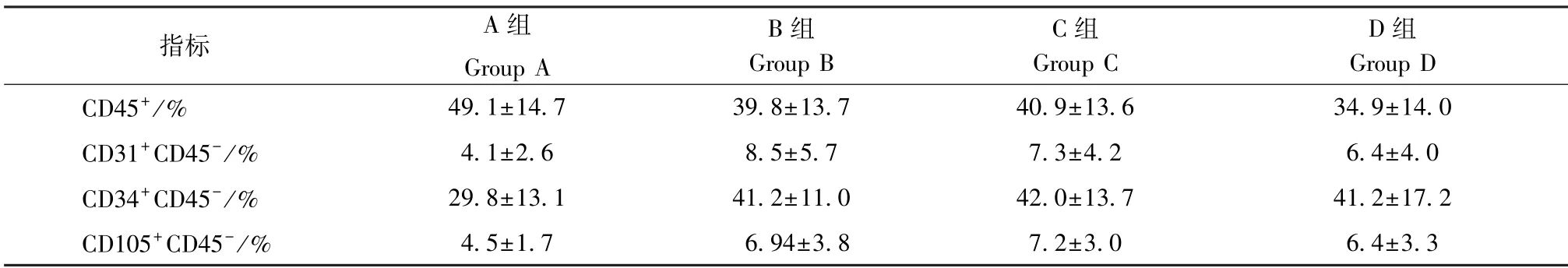
表1 流式细胞检测SVF 中各类细胞含量Table 1 Content of each type of cells in SVF detected by flow cytometry
2.3 G3PDH 活性
G3PDH 活性(图2B):A 组(0.093±0.039)U/mL,B 组(0.093±0.045)U/mL,C 组(0.144±0.023)U/mL,D 组(0.131±0.017)U/mL。C 组G3PDH 活性最高,大于A 组和B 组(P<0.05),但与D 组的G3PDH 活性无统计学差异。D 组G3PDH 活性大于A 组和B 组(P<0.05)。

图2 4 种纯化方法处理后脂肪SVF 细胞数量(A)与细胞活性(B)Fig.2 SVF cell number and G3PDH activity of lipoaspirate processed by 4 purification methods
2.4 处理纯化的脂肪组织HE 染色结果
HE 染色显示,经4 种不同的方法处理纯化后,各组脂肪组织均有少量脂肪细胞破裂,但大部分脂肪细胞的形态较为完整,各组脂肪组织细胞的完整性在镜下无明显差别(图3)。
PLIN 免疫组织化学染色显示,各组脂肪组织均有部分细胞周脂素蛋白不完整,提示有脂肪细胞损伤,但大部分脂肪细胞形态较为完整,各组镜下无明显差别(图3)。
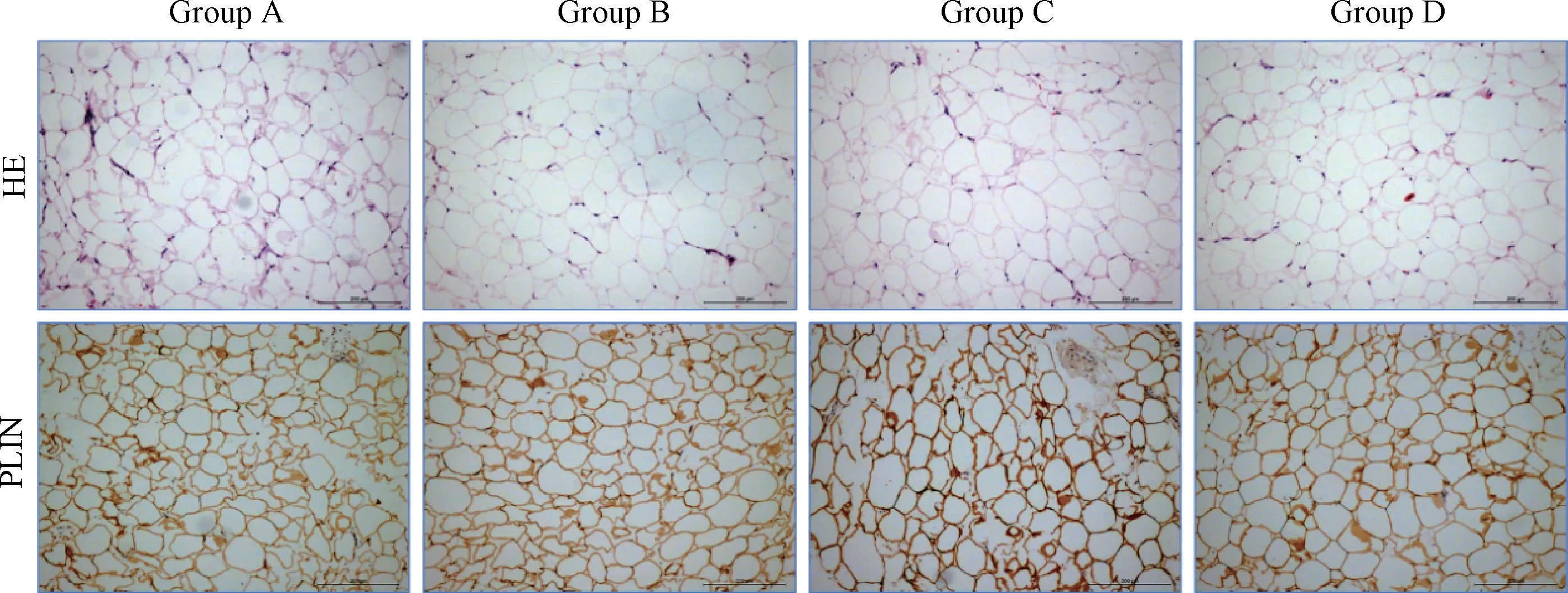
图3 纯化脂肪组织HE 染色和PLIN 免疫染色(标尺:200 μm)Fig.3 HE staining and PLIN immunestaining of processed lipoaspirate(scale bar: 200 μm)
2.5 动物实验结果
裸鼠死亡11 只,成活49 只,其中A 组成活10只,其余各组均成活13 只。
2.5.1 新生组织大体观及称重
各组新生脂肪组织形状略不规则,外观呈淡黄白色,表面有一层包膜包裹,触之较柔软,组织表面有新生细小血管形成。D 组新生脂肪组织的体积明显大于其余3 组(图4)。
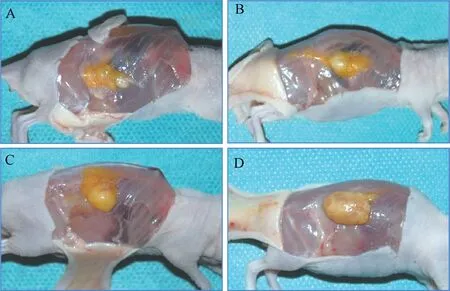
图4 新生组织大体形态观察Fig.4 Gross observation of tissue samples
新生组织重量:A 组(0.081±0.041)g,B 组(0.093±0.060)g,C 组(0.085±0.053)g,D 组(0.149±0.068)g。D 组新生组织重量大于A、B、C 组(P<0.05)。此3 组之间脂肪重量无统计学差异。
2.5.2 新生组织的组织学观察结果
HE 染色显示4 组新生组织周围均有纤维组织包膜,外周可见结构较为完整的脂肪细胞,脂肪细胞大小也较为均匀,排列整齐紧密,外周纤维组织增生及淋巴细胞浸润较明显,而囊肿形成较少。中央部分则有组织坏死,进而形成囊肿和空腔,移植物内有血管形成。各组新生组织的有核脂肪细胞的完整性、囊肿或空泡形成、纤维化与炎性细胞浸润均无明显差异(表2、图5)。
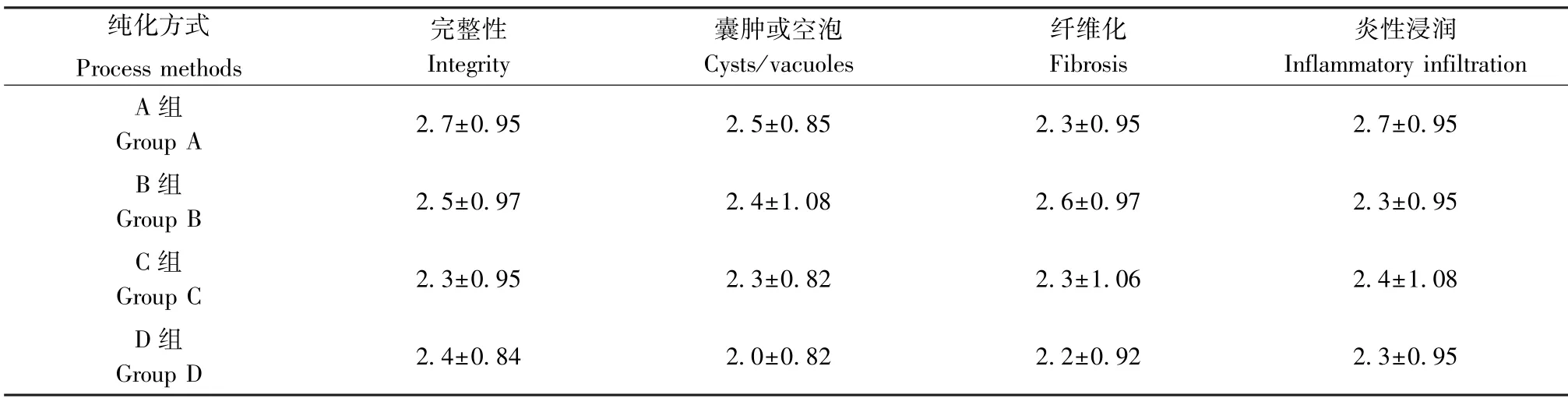
表2 不同纯化方式的新生脂肪组织细胞的完整性、囊肿或空泡、纤维化和炎性浸润分级Table 2 Grade of integrity,cysts or vacuoles,fibrosis,and inflammatory infiltration of new adipose tissue cells by different purification methods
PLIN 染色显示4 组新生组织周围均有PLIN+新生脂肪细胞产生,与原有正常脂肪细胞相比,体积较小。A 组、B 组、C 组中,仅组织周围区域发现少量散在PLIN+新生脂肪细胞(图5)。D 组中,组织周围区域内可见连片的PLIN+新生脂肪细胞,并且还可见到PLIN+新生脂肪细胞深入到组织中间(图6)。
3 讨论
自体脂肪组织移植无免疫排异反应、组织来源充足、填充效果好,因而被广泛应用于软组织重建。然而,脂肪组织移植后存在较高的吸收率,并伴随脂肪液化坏死、感染、结节形成等风险,在很大程度上制约了脂肪移植在临床中的推广应用。因此,提高脂肪移植后的存活率是临床普遍关注的问题。
解决这一问题的方法主要分为两类:第一类,优化脂肪获取、纯化及移植技术;第二类,添加外源性刺激辅助脂肪移植。目前,外源性辅助刺激手段包括细胞辅助移植(CAL)、纳米脂肪、SVF-gel、脂肪脱细胞提取液、PRP 等,这些手段通过富集ADSCs 或VEGF、TGF-β、bFGF、PDGF 等生物活性因子促进组织修复、血管新生,在一定程度上明显改善了脂肪坏死吸收,提高了脂肪移植后的存活率[14]。然而,面对复杂制备流程和伦理安全风险,这些技术的临床广泛应用尚存阻碍。因此,目前临床上使用的传统脂肪移植改良方法大多围绕术中的处理环节开展,通过优化脂肪获取、纯化及移植的操作技巧来降低对脂肪组织的破坏,提高脂肪移植效率。其中,脂肪的纯化处理是影响脂肪移植术后效果的关键因素,方法主要包含静置沉淀法、清洗沉淀法、离心法和棉垫吸附浓缩法。这些方法各有优劣,关于移植脂肪的最佳纯化处理方法目前尚未达成一致意见。
本研究通过比较4 种不同方法纯化处理后的脂肪的细胞完整性、脂肪活性、SVF 数量、ADSCs 含量和体内移植效果,来系统性评估不同的脂肪纯化处理对脂肪移植的影响。结果表明,离心组和棉垫吸附浓缩组的体外指标总体优于静置沉淀组和清洗沉淀组。离心法和棉垫浓缩吸附法比静置沉淀法和清洗沉淀法更能有效去除移植物中的水分、油脂,增加有效成分比例,有助于减轻移植后受区组织炎症反应,促进脂肪存活与再生。离心组和棉垫吸附浓缩组的SVF 数量和活性脂肪细胞更多。流式细胞分析中代表脂肪来源干细胞的CD34+CD45-,CD105+CD45-细胞的百分比,静置沉淀组虽然低于其他3组,但无显著性差异,可能原因是本实验样本量较少,同组中不同样本间差异较大。但考虑到静置沉淀组中SVF 细胞数量本来就少于其他3 组,该组脂肪来源干细胞是较少的。代表血液来源的CD45+细胞在静置沉淀组中最多,棉垫吸附浓缩组中最少,有显著性差异,说明棉垫吸附浓缩组去除血液来源细胞最为彻底,对减少移植后受区炎症反应、提高脂肪成活率有一定帮助。HE 和PLIN 免疫染色观察显示,4 组脂肪细胞均有少量破裂,大部分都保持完整,各组之间的细胞完整性无明显区别。从动物实验结果来看,棉垫吸附浓缩组结果显著优于其余3组,值得注意的是,不同于体外指标,离心组的新生脂肪组织的重量明显低于棉垫吸附浓缩组。离心组游离油脂含量为4.9%±2.1%,而棉垫吸附浓缩组为2.0%±0.8%。游离油脂的含量越高,说明脂肪细胞的损伤破裂程度较高。
以上结果表明,与静置沉淀法和清洗沉淀法相比,离心法和棉垫浓缩吸附法处理的脂肪组织杂质更少、纯度更高、脂肪细胞活性更好,其中又以棉垫吸附浓缩法处理更温和,对脂肪破坏更小,体内移植存活率更高。
