定向诱导为神经元样细胞的间充质干细胞对大鼠坐骨神经损伤的修复作用及生物力学评价
2021-09-16胡安全王正安秦力李哲冯祁军
胡安全 王正安 秦力 李哲 冯祁军

[關键词] 骨髓间充质干细胞;神经元样细胞;坐骨神经损伤;生物力学;神经修复
[中图分类号] R329.2 [文献标识码] A [文章编号] 1673-9701(2021)15-0027-05
Repairing effects and biomechanical evaluation of mesenchymal stem cells induced into neuron-like cells on sciatic nerve injury in rats
HU Anquan WANG Zheng′an QIN Li LI Zhe FENG Qijun
Department of Orthopedics, the First Hospital of Jiaxing in Zhejiang Province, Jiaxing 314000, China
[Abstract] Objective To research the repairing effects and biomechanical evaluation of mesenchymal stem cells (BM-MSCs) induced into neuron-like cells on sciatic nerve injury in rats. Methods The purified rat BM-MSCs were obtained in vitro, and the BM-MSCs were differentiated into neuron-like cells by β-mercaptoethanol inducer. A total of 80 SD rats were divided into the sham operation group, the model group, the normal cell group and the directional induction group. Excepted the sham operation group, the other three groups were used to establish rat sciatic nerve crush injury models. In rats of the normal cell group and the directional induction group, BM-MSCs or neuron-like directional differentiation BM-MSCs were injected into the sciatic nerve injury respectively. The sham operation group and the model group were injected with the same dosage of normal saline. The sciatic nerve function index (SFI) was measured, the motor function of rats was evaluated by Bsso-Beattie-Bresnahan(BBB) scoring method, and its biomechanics was evaluated by electrophysiological examination of sciatic nerve and unidirectional stretching test of sciatic nerve. The expression levels of brain-derived neurotrophic factor (BDNF), myelin basic protein (MBP) and growth-associated protein 43 (GAP-43) in neurogenic encephalopathy were detected by Western blot method. Results Compared with the sham operation group, the SFI index and BBB score of sciatic nerve in rats of the model group were all decreased, the expression levels of BDNF, MBP and GAP-43 protein were decreased, and the amplitude value, motor conduction velocity, maximum stress, maximum strain, elastic limit stress and elastic limit strain were also decreased significantly(all P<0.05). However, compared with the model group, the above-mentioned indexes in the normal cell group and the directional induction group were increased, especially in the directional induction group (all P<0.05). Conclusion BM-MSCs induced into neuron-like cells have obvious repairing effects on sciatic nerve injury in rats.
[Key words] Bone marrow mesenchymal stem cells; Neuron-like cells; Sciatic nerve injury; Biomechanics; Nerve repairing
外伤性周围神经损伤是一种重要的临床和公共卫生问题[1],尤其以臀部坐骨神经损伤最难处理且预后最差[2]。这与周围神经系统的再生和修复能力有限有关,易导致与之相关的器官结构和功能的永久性损伤[3]。近年来,骨髓间充质干细胞(Bone marrow stromal stem cells,BM-MSCs)已被用作Schwann细胞的替代品,在治疗周围神经损伤方面显示出巨大的潜力[4]。刘峰等[5]研究表明,在特定诱导剂的作用下,骨髓间充质干细胞在体外亦可定向向神经细胞分化。因此,本研究将大鼠骨髓间充质干细胞在体外定向诱导为神经元样细胞,继而回植入大鼠体内,研究其对大鼠坐骨神经损伤的治疗作用及机制,以期为坐骨神经损伤的治疗提供新的治疗方法及依据。
1 材料与方法
1.1主要仪器和试剂
MODEL55100电子万能自动控制试验机购自中国长春试验机研究所;MedlecSynergy型肌电图仪购自英国Oxford仪器公司;小动物手术显微镜和非吸收尼龙缝线(带针)购自上海玉研科学仪器有限公司;免疫印迹一抗脑源性神经营养因子(Brain-derived neurotrophic factor,BDNF)、髓磷脂碱性蛋白(Myelin basic protein,MBP)与和生长关联蛋白43(Growth associated protein-43,GAP-43)购自英国Abcam公司。
1.2大鼠BM-MSCs提取、鉴定及向神经元样细胞定向诱导分化
取4只健康成年SD大鼠双侧后腿,解剖股骨和胫骨,用无菌的DMEM/F12完全培养基反复冲洗骨髓腔,直至骨骼变白。经常规细胞贴壁筛选法及多次传代在体外进行纯化后获得大鼠BM-MSCs,经流式细胞术检测间充质干细胞标志分子CD29、CD44、CD90以及造血细胞标志物CD45的表达情况。将获得的BM-MSCs接种于培养板中,待细胞铺满孔底达90%时,吸弃培养基。用化学诱导剂β-巯基乙醇诱导大鼠骨髓间充质干细胞分化为神经细胞,检测神经元特异性烯醇化酶阳性细胞的阳性率,将获得的神经元样细胞用于后续动物实验。
1.3动物分组与模型建立
84只(包含4只用于提取BM-MSCs,余80只大鼠进行实验分组)成年健康SPF级Sprague-Dawley(SD)大鼠购自中国医科大学实验动物中心[(动物许可证号:SCXK(辽)2018-0004)],雌雄不限,实验过程得到我院动物实验伦理委员会批准,并遵守国家研究委员会护理和使用实验动物的指南(1996年修改)。随机分为假手术组、模型组、普通细胞组与定向诱导组。用钳夹坐骨神经的方法构建大鼠单侧坐骨神经损伤模型[6]。3%戊巴比妥钠麻醉大鼠后,剃毛备皮,常规消毒固定。无菌条件下取左股后上部纵形切口,自股二头肌与半腱肌、半膜肌间钝性分离,充分暴露坐骨神经,在坐骨结节下方0.5 cm处,钳夹10 s,反复3次,造成3 mm的损伤区,手术过程中,显微镜观察到其外膜连续而神经轴突中断。依次缝合肌肉皮肤,消毒后常规饲养。术后次日,分别将未做任何诱导分化处理的BM-MSCs(约1×106个细胞)和诱导分化成功的神经元样细胞(约1×106个细胞)植入普通细胞组和定向诱导组大鼠坐骨神经损伤处。另外假手术组和模型组大鼠分别给予等量(1 mL)生理盐水。
1.4坐骨神经功能指数(Sciatic function index,SFI)评分[6]
分别于术后第2、4、8、12周进行坐骨神经功能指数测定。自制长90 cm、宽 15 cm、高 20 cm的大鼠足行走箱。箱底放置宽15 cm的连续记录纸。大鼠双后足蘸炭素墨水后放入行走箱入口,大鼠在向远端爬行过程中每侧留4~5个足印,选实验侧肢(E)和健侧肢(N)足印,测量以下变量:足印长度(Paw length,PL)=足跟到足尖的距离;足趾宽度(Toe spread,TS)=第一趾到第五趾连线的距离;中间足趾距离(IT)=第二趾到第四趾连线的距离。将上述三个变量代入Bain公式计算SFI,以SFI=0为正常值,-100为神经完全断离指标。SFI=-38.3×(EPL-NPL)/NPL+109.5×(ETS-NTS)/NTS+13.3×(EIT-NIT)/NIT-8.8。
1.5大鼠运动功能评价
每次观察4 min内各组大鼠的运动情况,两位经验丰富的观察者独立地使用Bsso-Beattie-Bresnahan(BBB)评分标准[7]对大鼠运动情况进行打分,分值范围0分(无自发运动)~21分(运动正常)。在手术前记录1次BBB评分,以建立基线对照。手术后每间隔7 d记录1次各组大鼠BBB评分,连续记录12周。
1.6电生理检测
术后12周,大鼠用10%水合氯醛麻醉,俯卧在自制手术台上,暴露左、右侧坐骨神经干。
安装两个接地电极-单极直针电极(26G)和螺旋電极。直针电极插入邻近肌肉组织内,螺旋电极定位于神经周围。高频滤波器设置为5 kHz,低频滤波器设置为2 Hz。对每一个所获得的电位(复合神经动作电位和复合肌肉动作电位),刺激为方形电脉冲(持续时间0.04 ms,电流20 mA,6个连续刺激),诱发出动作电位波幅及潜伏期。由两个刺激点之间的距离除以不同的传导时间计算神经传导速度。
1.7单向拉伸实验[8]
10%水合氯醛麻醉大鼠后,在神经吻合处的中点取各组大鼠的两侧坐骨神经(长约20 mm),大鼠右侧坐骨神经为正常对照组。取出坐骨神经后,在麻醉状态下断头处死大鼠。室温下将每个坐骨神经试样安装到试验机拉伸夹头中,以1.5 mm/min的增加速度对坐骨神经试样施加拉伸载荷。
1.8蛋白免疫印迹法(western blot)
将收集的坐骨神经组织在液氮中研磨成粉后,用RIPA细胞裂解液提取各组大鼠坐骨神经总蛋白,取各蛋白样品于10%聚丙烯酰胺凝膠中设置80 V(1.5 h)/100 V(0.5 h)电压电泳。将蛋白条带转至聚偏二氟乙烯膜上后用5%的牛血清白蛋白封闭2 h。分别加入BDNF、MBP与和GAP-43蛋白抗体孵育过夜。再用山羊抗兔IgG二抗孵育2 h后显影,最后以β-actin作为内标对蛋白条带进行半定量分析。
1.9统计学处理
应用SPSS 17.0统计学软件进行数据处理,计量资料以均数±标准差(x±s)表示。两组间比较采用t检验;多组间比较采用单因素方差分析(ANOVA),再采用LSD-t检验进行两两比较。以P<0.05表示差异有统计学意义。
2结果
2.1 BM-MSCs提取、鉴定及向神经元样定向诱导分化
置于倒置光学显微镜下观察,大鼠BM-MSCs呈典型的长梭形,排列整齐,旋涡样生长。经流式细胞术鉴定,培养P3代的BM-MSCs高表达CD29(98.35±0.14)%、CD44(98.53±0.08)%、CD90(97.31±0.15)%,几乎不表达CD45(1.05±0.03)%。然后用化学诱导剂β-巯基乙醇诱导大鼠BM-MSCs向神经元样定向分化,诱导7 d后,细胞逐渐向神经元样细胞形态分化,出现轴突样类似物,细胞体收缩,遮光性增强。神经元特异性烯醇化酶阳性细胞的阳性率为(39.75±3.34)%,故可用于后续试验。见封三图4。
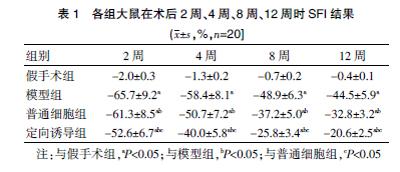
2.2定向诱导为神经元样细胞的BM-MSCs对SFI的影响
术后2、4、8、12周时,模型组大鼠SFI显著低于假手术组,而定向诱导组大鼠SFI一直高于模型组、普通细胞组(均P<0.05)。见表1。
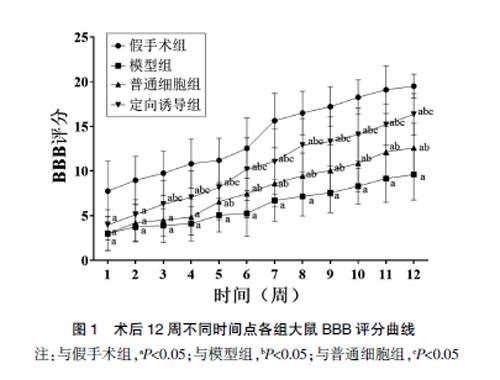
2.3 定向诱导为神经元样细胞的BM-MSCs对BBB评分的影响
与假手术组相比,模型组大鼠术后12周各时间点的BBB评分均显著降低;但是与模型组相比,普通细胞组和定向诱导组大鼠各时间点BBB评分均显著升高,尤其是定向诱导组大鼠各时间点BBB评分高于普通细胞组(均P<0.05)。
2.4定向诱导为神经元样细胞的BM-MSCs对电生理测定结果的影响
与假手术组相比,模型组大鼠波幅值和运动传导速度值均显著降低;但是与模型组相比,普通细胞组和定向诱导组大鼠波幅值和运动传导速度值均显著升高,尤其是定向诱导组大鼠波幅值和运动传导速度值高于普通细胞组(均P<0.05)。
2.5定向诱导为神经元样细胞的BM-MSCs对拉伸实验结果的影响
与假手术组相比,模型组大鼠坐骨神经最大应力、最大应变、弹性限度应力、弹性限度应变均显著降低;但是与模型组相比,普通细胞组和定向诱导组大鼠坐骨神经最大应力、最大应变、弹性限度应力、弹性限度应变均显著升高,尤其是定向诱导组大鼠坐骨神经最大应力、最大应变、弹性限度应力、弹性限度应变高于普通细胞组(均P<0.05)。
2.6定向诱导为神经元样细胞的BM-MSCs对BDNF、MBP与和GAP-43蛋白表达的影响
与假手术组相比,模型组大鼠坐骨神经BDNF、MBP与和GAP-43蛋白表达量均显著降低;但是与模型组相比,普通细胞组和定向诱导组大鼠坐骨神经BDNF、MBP与和GAP-43蛋白表达量均显著升高,尤其是定向诱导组大鼠坐骨神经BDNF、MBP与和GAP-43蛋白表达量高于普通细胞组(均P<0.05)。
3 讨论
坐骨神经是由L4~5和S1~3神经根组成[9]。临床上坐骨神经常由于挤压、压迫、拉伸、撕脱和分裂而受损,多见于腰椎间盘突出症、梨状肌综合征、髋关节脱臼或骨盆骨折等[10]。坐骨神经损伤是生活中常见的疾病,当坐骨神经受伤后,患者患肢显示疼痛相关的步态和肿胀,不仅影响到正常行走,也会导致腿部的肌肉丧失功能。尽管坐骨神经修复技术不断改进,但单纯外科手术的治疗效果仍差强人意。这主要是由于坐骨神经组织再生能力差,损伤后局部微环境不利于轴突生长,以及损伤部位胶质瘢痕的形成等原因[11]。为了使损伤的坐骨神经恢复到损伤前的水平,研究人员做了大量的研究,如同种异体神经移植,但是移植后的排除反应不可避免[12]。
近年来,基于BM-MSCs的治疗已经成为促进神经再生的一种十分有前途的治疗方法。BM-MSCs可以从脂肪、脐带血,胚胎以及骨髓中获得[13]。它们具有分化为骨髓基质细胞、脂肪细胞、成骨细胞、软骨细胞、腱细胞、心肌细胞以及神经细胞的潜能,故而可用于再生细胞治疗[14]。在本研究中利用常规细胞贴壁筛选法及多次传代获得纯化的大鼠BM-MSCs,置于倒置光学显微镜下观察,大鼠BM-MSCs呈典型的长梭形,排列整齐,旋涡样生长。经流式细胞术鉴定,培养P3代的BM-MSCs高表达CD29、CD44、CD90,几乎不表达CD45。BM-MSCs因具备横向分化潜能,在神经营养因子诱导作用下,少部分BM-MSCs在体内可分化为神经外胚层样细胞,但是仍有大部分BM-MSCs分化为星形胶质细胞。因此在应用BM-MSCs时,在体外成功将其定向分化的技术将至关重要,这在很大程度上会影响疾病的治疗效果。目前,国内外学者将BM-MSCs定向诱导分化成神经元样细胞的方法主要包括化学诱导法(β-巯基乙醇,全反式视黄酸)、神经生长因子诱导法、Transwell小室共培养等。β-巯基乙醇是研究较早且较为成熟的一种分化诱导剂,通过提高胞质内抗氧化成分-谷胱甘肽的水平降低氧自由基的生成量以达到诱导细胞分化的目的。关宁等[22]曾比较β-巯基乙醇和神经生长因子诱导BM-MSCs向神经细胞分化的可行性,结果证实,β-巯基乙醇组神经元特异性烯醇化酶阳性率和微管相关蛋白分化率更高,说明相较于神经生长因子,β-巯基乙醇能够更好地促进BM-MSCs向神经元样细胞分化。基于此,本研究利用化学诱导剂β-巯基乙醇诱导大鼠BM-MSCs向神经元样定向分化,诱导7 d后,细胞逐渐向神经元样细胞形态分化,出现轴突样类似物,细胞体收缩,遮光性增强。神经元特异性烯醇化酶阳性细胞的阳性率超过90%,说明神经元样定向诱导分化较为成功,进而将定向诱导分化的BM-MSCs注射入模型大鼠的坐骨神经损伤处,另外设置普通BM-MSCs对照组。观察12周后,证实普通细胞组和定向诱导组大鼠运动功能较模型组大鼠明显改善,利用电生理检测和拉伸实验也证实,无论是注射BM-MSCs还是注射神经元样定向诱导分化的BM-MSCs,均具有恢复大鼠坐骨神经电生理学特性和拉伸力学性能的作用。而且坐骨神经损伤处神经生长相关因子(BDNF、MBP、GAP-43蛋白)的表达水平明显升高。尤其是定向诱导组大鼠较普通细胞组大鼠SFI指数、BBB评分、坐骨神经电生理学特性和拉伸力学性能改善更明显,且BDNF、MBP、GAP-43蛋白表量更高,说明BM-MSCs可以向神经损伤点传递有助于功能恢复的关键信号,进而改变细胞行为或转移某些细胞因子以减轻损伤。而且神经元样定向诱导分化的BM-MSCs更有利于坐骨神经损伤的恢复。
既往虽然众多基础研究证实,静脉注射BM-MSCs可以调节局部环境,减少炎症反应,促进小鼠坐骨神经挤压模型轴突再生[15];同时也可增加新生神经纤维和神经血管的数量,進而促进损伤的周围神经功能的恢复[16]。例如龚庆等[17]的研究显示分化的骨髓间充质干细胞植入外周神经断端时,可以促进神经纤维的再生,其作用机制与骨髓间充质干细胞移植促进周围神经损伤中的轴索再生与营养物质的产生有关联。但是随着研究的深入,越来越多的体内实验发现,体内移植后BM-MSCs向胶质细胞和成纤维细胞分化的比率高于向神经元样细胞分化的比率[18]。以BM-MSCs为基础的坐骨神经损伤治疗有两个主要目的,一是为神经元细胞提供微环境,以支持或增强损伤处细胞的神经保护和再生能力;二是替换丢失或受损的神经元。以往的许多研究表明,移植的BM-MSCs可促进神经营养因子的分泌进而对周围神经元再生起重要作用。然而诱导BM-MSCs向神经元样定向分化也是十分重要的。因此在本研究中,首先在体外利用化学诱导剂将BM-MSCs向神经元定向诱导,再注射至动物坐骨神经损伤处,并得到了较为理想的治疗效果。
GAP-43是一种热稳定的磷酸蛋白,当神经受到损伤时GAP-43表达开始升高,能够帮助受损伤的神经再生、发育并加快结构重建[19]。BDNF是一种促进中枢神经系统神经元增殖和存活的分泌生长因子,其与神经元可塑性和神经递质调节有关。MBP是中枢神经系统髓鞘中含量第二丰富的蛋白,负责致密多层髓鞘的细胞质表面的黏附[20]。作为“内在无序”或构象适应性蛋白家族的一员,它可以与肌动蛋白、微管蛋白、网格蛋白等多阴离子蛋白以及带负电荷的脂质相互作用,并通过与它们结合而获得结构[21]。Western blot实验结果表明定向诱导为神经元样细胞的BM-MSCs可以上调坐骨神经损伤大鼠坐骨神经组织中BDNF、MBP和GAP-43蛋白表达,说明将BM-MSCs进行神经元样定向诱导分化处理后,更有利于大鼠坐骨神经的恢复,其可能的作用机制之一与BM-MSCs产生多种细胞因子,如BDNF、MBP、GAP-43等有关。
随着社会的发展、交通事故伤害的增加,坐骨神经损伤的发生率日渐增高,我们的研究证明定向诱导为神经元样细胞的BM-MSCs对大鼠坐骨神经损伤具有明显的修复效果,这为坐骨神经损伤的治疗提供了新的方向,并为最终过渡到临床应用提供强有力的实验依据。
[参考文献]
[1] Checchia GA,Maruro GL,Morico G,et al.Observational multicentric study on chronic sciatic pain:Clinical data from 44 Italian centers[J].Eur Rev Med Pharmacol Sci,2017, 21(7):1653-1664.
[2] Coluzzi F,Fornasari D,Pergolizzi, J,et al.From acute to chronic pain:Tapentadol in the progressive stages of this disease entity[J].Eur Rev Med Pharmacol Sci,2017,21(7):1672-1683.
[3] Jiang J,Zhang Z,Yu Y,et al.Screening of NogoA/NTR-related differential genes in rat sciatic nerve injury signal pathway[J].Per Med,2019,16(2):93-105.
[4] Fu X,Liu G,Halim A,et al. Mesenchymal stem cell migration and tissue repair[J].Cells,2019,8(8):784.
[5] 刘峰,李晓飞,刘艳.慢病毒介导髓细胞触发受体2过表达质粒转染促进人骨髓间充质干细胞向神经细胞分化[J].解剖科学进展,2020,26(5):570-574.
[6] 王泽穆,宋清清,周波,等.鼠神经生长因子治疗大鼠坐骨神经损伤的疗效[J].江苏医药,2019,45(12):1193-1196,1184.
[7] 姚阳,车敏,滕松龄,等.重组水蛭素对大鼠坐骨神经损伤后神经功能的影响及可能机制[J].解剖科学进展,2020, 26(1):86-89.
[8] 吴志峰,罗民.化学去细胞异体神经联合骨髓间充质干细胞修复损伤坐骨神经的生物力学评价[J].中国组织工程研究,2020,24(7):991-995.
[9] Micke O,Seegenschmiedt MH,Adamietz IA,et al.Low-dose radiation therapy for benign painful skeletal disorders:The typical treatment for the elderly patient?[J].Int J Radiat Oncol Biol Phys,2017,98(4):958-963.
[10] 佟欣鑫,马铁明.坐骨神经损伤分类及常用模型制造[J].按摩与康复医学,2018,28(8):8-10.
[11] 付秀美,杨海艳,王荣良,等.脂肪源性干细胞促进大鼠受损坐骨神经传导及脊髓脑源性神经营养因子和睫状神经营养因子的表达[J].解剖学杂志,2017,40(1):11-15.
[12] Hervera A,De Virgiliis F,Palmisano I,et al.Reactive oxygen species regulate axonal regeneration through the release of exosomal NADPH oxidase 2 complexes into injured axons[J].Nat Cell Biol,2018,20(3):307-319.
[13] 张德绸,葛建华,吴昭君.自体富血小板血浆对周围神经损伤修复微环境影响的的实验研究[J].四川医学,2018,39(8):846-850.
[14] Wang Y,Li ZW,Luo M,et al. Biological conduits combining bone marrow mesenchymal stem cells and extracellular matrix to treat long-segment sciatic nerve defects[J].Neural Regen Res,2015,10(6):965-971.
[15] 龚庆,宋秋莹,邱莉晶,等. PLGA微球搭载鹿茸多肽联合BMSCs移植对坐骨神经损伤修复的作用及机制研究[J].中药新药与临床药理,2019,30(11):1296-1300.
[16] Lima Giacobbo B,Doorduin J,Klein HC,et al.Brain-derived neurotrophic factor in brain disorders:Focus on neuroinflammation[J].Mol Neurobiol,2019,56(5):3295-3312.
[17] 龚庆,宋秋莹,邱莉晶,等.聚丙交酯-乙交酯微球搭载鹿茸多肽联合骨髓间充质干细胞对大鼠坐骨神经损伤的修复作用及其机制[J].吉林大学学报(医学版),2018,44(6):1174-1178.
[18] 程光,王梅,刘爱华.AAV介导NGF过表达载体转染BMSCs对高强度聚焦超声致活体SD大鼠坐骨神经损伤模型保护作用[J].社区医学杂志,2020,18(10):721-727,731.
[19] 王天儀,原文琦,刘勇,等.坐骨神经预损伤后miR-124-3p调节GAP-43表达并促进轴突生长的实验研究[J].中华骨科杂志,2015,22(4):420-427.
[20] 古梓婷,贾会,赖胜敏,等.丙烯酰胺染毒对大鼠坐骨神经MBP和MAG表达的影响[J].神经解剖学杂志,2019, 35(1):29-34.
[21] Huang R,Xiao H,Zhao J,et al.GAP-43 is involved in the orientation of cell division by interacting with GalphaI during neurogenesis[J].Int J Neurosci,2020,130(2):144-152.
(收稿日期:2020-12-01)
