超声波辅助提取红枣中黄酮类物质的研究
2021-09-16刘秀敏单春会张雪刘娅
刘秀敏,单春会,2,张雪,刘娅,3*
(1.石河子大学食品学院,新疆 石河子 832000;2.新疆特色果蔬贮藏加工教育部工程研究中心,新疆 石河子 832000;3.新疆植物药资源利用教育部重点实验室,新疆 石河子 832000)
红枣系鼠李科植物的果实,自古以来与桃、李、杏、栗并称“中国五果”[1],其富含糖类、膳食纤维、蛋白质、维生素等多种营养成分及黄酮、多酚、多糖、皂苷等生物活性成分[2],是一种天然的药食同源食品[3]。已有研究表明黄酮类化合物是最具活性的天然产物之一[4],对人体生命健康起着重要作用[5],具有抗病毒、抗过敏、降血脂、预防心脑血管疾病、抗菌消炎等功效[6-8]。
目前黄酮类物质主要以甲醇、乙醇和乙酸乙酯等有机溶剂提取,工艺要求苛刻,高温条件和大量有机溶剂的使用使得黄酮类化合物易发生电离、水解和氧化而失活[9],有毒有机溶剂的使用还会导致环境问题并增加人类健康风险[10]。低共熔溶剂(deep eutectic sol-vent,DES)作为一种新型绿色提取溶剂,因具有原料易得、无毒性、成本低、可生物降解且能精准调节和设计等优势[11-14],目前已经成功用于黄酮[15]、酚酸[16]、花青素[17]、多酚[18]、多糖[19]等多种生物活性成分的提取。因此,本文针对新疆丰富的红枣资源,辅以高效的超声波技术,利用低共熔溶剂提取红枣中的黄酮类物质,旨在提高红枣的附加值,为新疆红枣产业的绿色可持续发展提供新的思路和理论依据。
1 材料与方法
1.1 材料与仪器
红枣:产自新疆石河子;氯化胆碱、芦丁标准品(纯度>98%):上海源叶生物科技有限公司;尿素、氢氧化钠:天津市化学试剂三厂;亚硝酸钠:天津市巴斯夫化工有限公司;硝酸铝:天津市北联精细化学品开发有限公司。以上化学试剂均为分析纯。
1.2 仪器与设备
GL-20G-Ⅱ高速离心机:赛默飞世尔科技(中国)有限公司;JP-1000B-2高速多功能粉碎机:永康市永久工贸有限公司;HWS-28电热恒温水浴锅:上海一恒科学仪器有限公司;WD-2102A酶标仪:美国伯腾仪器有限公司;SK5200BT超声清洗器:上海科导超声仪器有限公司。
1.3 方法
1.3.1 低共熔溶剂的配制
按照一定的摩尔比称取氯化胆碱和尿素,加入一定量的蒸馏水。用磁力搅拌器搅拌,直至形成均匀透明的液体,冷却至室温25℃备用[20]。
1.3.2 红枣中黄酮的提取
将红枣片粉碎过40目筛,4℃冷藏备用。称取一定质量的红枣粉,按照一定料液比与DES均匀混合,进行超声波辅助提取(200 W,35 kHz),然后以6 000 r/min离心10 min,取上清液即为红枣黄酮提取液。
1.3.3 单因素试验
准确称取0.5 g红枣粉,分别考察低共熔溶剂(氯化胆碱∶尿素)的摩尔比(1∶1、1∶2、1∶3、2∶1、3∶1)、加水量(10%、20%、30%、50%、70%、90%)、料液比[1∶15、1∶20、1∶25、1∶30、1∶35、1∶40(g/mL)]、超声温度(45、50、55、60、65、70 ℃)、超声时间(10、20、30、40、50、60 min)对黄酮得率及总还原力的影响。
1.3.4 响应面试验
根据单因素试验结果,以加水量、料液比、超声温度、超声时间4个因素为自变量,黄酮得率(Y)为响应值,利用Box-Behnken设计四因素三水平的试验[21],试验因素与水平见表1。

表1 响应面因素水平设计Table 1 Factors and levels of response surface experiment
1.3.5 黄酮含量测定和黄酮得率的计算
采用亚硝酸钠-硝酸铝比色法测定黄酮含量[22]。精密称取芦丁对照品,用60%乙醇配制成0.10 mg/mL的芦丁标准品溶液。分别准确吸取标准品溶液0、1.0、2.0、3.0、4.0、5.0 mL 于 6 支 10 mL 具塞刻度试管中,加入0.3 mL 5%亚硝酸钠溶液,摇匀后静置6 min;再加入0.3 mL 10%硝酸铝溶液,摇匀后静置6 min,然后加入4.0 mL 4%氢氧化钠溶液,最后加蒸馏水定容至10 mL,摇匀后静置15 min。在510 nm波长下测其吸光度,根据芦丁浓度和吸光度绘制标准曲线。黄酮测定方法为取1 mL样品溶液至10 mL具塞刻度试管中,后续操作按照标准曲线方法进行,黄酮得率计算公式如下。

式中:X为将测得吸光值代入标曲后计算得出的黄酮质量浓度,mg/mL;V0为提取液定容后的体积,mL;V1为测吸光值时所用提取液的体积,mL;V2为待测提取液总体积,mL;m为红枣粉质量,g;W为黄酮得率,mg/g。
1.3.6 总还原力测定
参照文献[23]的方法测定总还原力。分别取浓度为0.005、0.010、0.015、0.020 mg/mL 样品溶液 1.0 mL,分别加入0.2 mol/L(pH 6.6)的磷酸盐缓冲溶液(phos phatebuffersaline,PBS)0.2mL和1%氰化钾溶液 0.5mL,摇匀后置于50℃水浴中反应20 min,反应结束后用流动水迅速冷却,加入10%三氯乙酸溶液1.0 mL终止反应。然后在5 000 r/min下离心10 min,取1.5 mL上清液于试管中,加入1%三氯化铁溶液0.2 mL和蒸馏水3 mL,摇匀后静置8 min,在700 nm处测定吸光度,平行测定3次,取平均值,以VC作阳性对照。吸光值越大则代表样品还原能力越强。
1.4 数据处理
采用Origin8.5软件做图,Design-Expert 8.0.6软件进行方差显著性处理和分析,测定数据以平均值±标准差表示。
2 结果与分析
2.1 单因素试验结果
2.1.1 氯化胆碱与尿素的摩尔比对黄酮得率的影响
氯化胆碱与尿素的摩尔比对黄酮得率的影响见图1。

图1 氯化胆碱与尿素的摩尔比对黄酮得率的影响Fig.1 Effect of molar ratio of choline chloride to urea on the yield of flavonoids
由图1可以看出,当DES体系中的氢键受体氯化胆碱与氢键供体尿素的摩尔比为2∶1,此时黄酮得率最高。这可能是因为DES体系是一种弱碱性溶液,DES的pH值可通过影响DES与溶质分子之间的静电键和氢键相互作用而在提取中起重要作用。由于存在酚羟基,黄酮类化合物通常具有弱酸性,也增加一定溶解能力。当DES组分摩尔比改变时,会极大影响体系极性、pH值、黏度、密度、折光率等理化性质[24],从而影响黄酮提取效率。因此选择氯化胆碱与尿素的摩尔比为2∶1进行后续研究。
2.1.2 DES的加水量对黄酮得率的影响
DES的加水量对黄酮得率的影响见图2。
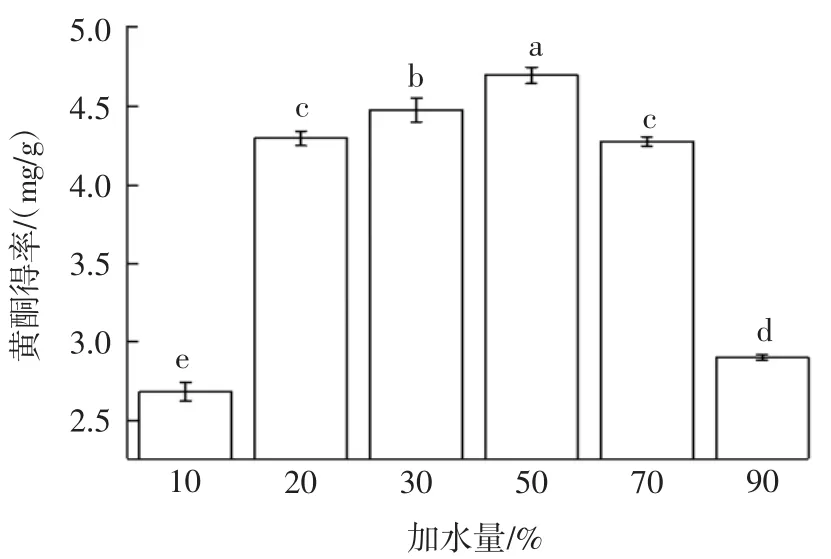
图2 加水量对黄酮得率的影响Fig.2 Effect of adding water on the yield of flavonoids
由图2可知,加水量对黄酮得率影响很大,DES加水量为50%时黄酮得率最高。加水量低于50%时,黄酮得率随加水量增加呈现上升趋势,可能是因为氯化胆碱与尿素构建的DES体系在室温25℃下具有很高黏度(428 mPa·s)[10],而加水量增加至 50%,体系黏度显著降低[25],大大提高了DES溶液的传质效率,从而提高黄酮得率。加水量高于50%后,会增加DES的极性,而极性的增加不利于黄酮类物质提取,因此得率明显下降。
2.1.3 料液比对黄酮得率的影响
料液比对黄酮得率的影响见图3。

图3 不同料液比对黄酮得率的影响Fig.3 Effect of different solid-liquid ratio on the yield of flavonoids
由图3可知,随着溶剂用量的增加,黄酮得率呈上升趋势。提取溶剂用量的增加,会加大红枣粉与提取剂的接触面积,从而加快红枣粉中黄酮向提取溶剂的质量转移,从而提高得率。料液比从1∶35(g/mL)至1∶40(g/mL)时,得率增加速率显著下降,这可能是因为提取溶剂的增多反而起到了稀释作用,并且增加其它物质的析出,影响得率。因此从经济节约的角度选择料液比 1∶35(g/mL)进行后续研究。
2.1.4 超声温度对黄酮得率的影响
超声温度对黄酮得率的影响见图4。
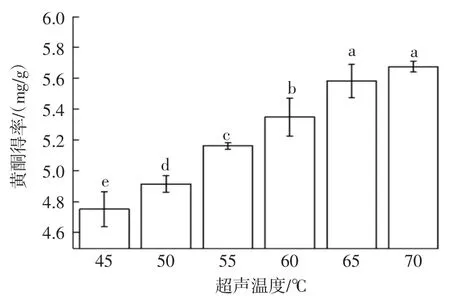
图4 不同超声温度对黄酮得率的影响Fig.4 Effect of different ultrasonic temperature on the yield of flavonoids
由图4可知,黄酮得率随着超声温度的升高而增大。升高温度,会降低DES体系的黏度,增加红枣粉的分散性,加速溶质的传质作用,有利于有效成分的析出[25]。温度的升高虽有利于黄酮的提取,但高温也会破坏黄酮类化合物的活性,使其氧化、水解、电离[9]。因此从经济节约的角度选择超声温度为65℃进行后续研究。
2.1.5 超声时间对黄酮得率的影响
超声时间对黄酮得率的影响见图5。

图5 不同超声时间对黄酮得率的影响Fig.5 Effect of different ultrasonic time on the yield of flavonoids
随着超声时间的增加,黄酮得率呈上升趋势,这是由于超声波的空化效应和机械效应,能够增大物质分子运动频率和速度,从而加速溶质的扩散和传播,使有效成分易溶出。从图5可知,超声时间从40 min增至60 min时,上升速率明显下降,其原因可能是超声时间过长,样品组织中其它物质会扩散出来,并附着于样品表面,阻碍样品与溶剂接触,从而影响提取效率。因此选择超声时间50 min为宜。
2.2 响应面试验结果
2.2.1 响应面试验结果及方差分析
以单因素试验结果为基础,设计响应面优化试验。响应面试验结果见表2。

表2 响应面试验结果Table 2 Response surface experiment results
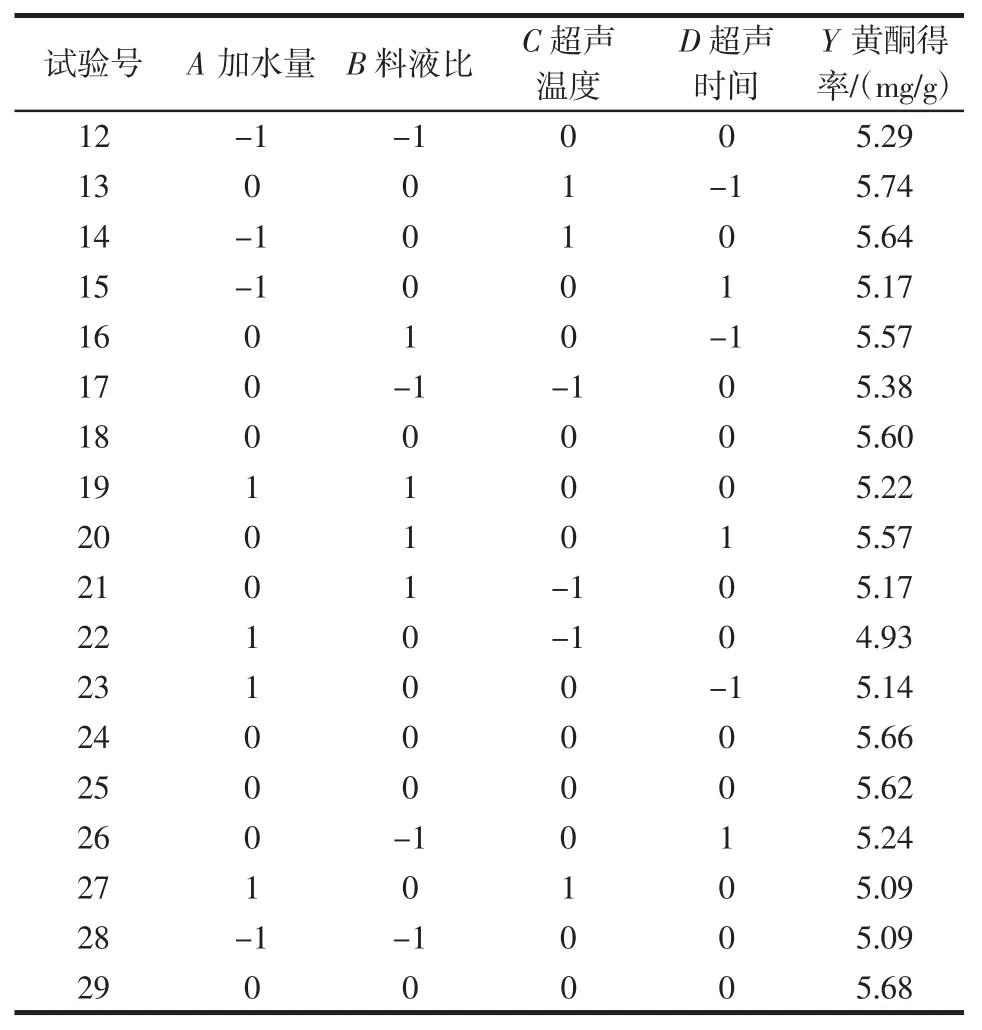
续表2 响应面试验结果Continue table 2 Response surface experiment results
利用Design-Expert 8.0.6软件,对试验数据进行多元回归模型拟合,得到回归方程:Y=5.63-0.083A+0.10B+0.19C-8.061×103D+0.053AB-0.16AC+0.18AD+0.15BC+0.058BD-0.12CD-0.42A2-0.11B2-0.068C2-0.041D2。对回归方程进行显著性检验及方差分析。
回归模型方差分析见表3。

表3 回归模型方差分析Table 3 ANOVA for response surface regression model
由表 3可知,模型相关系数 R2=0.959 4,P<0.01,说明该响应面模型极显著,模型能解释95.94%响应值的变化,模型拟合程度较好。且失拟项为0.073 0不显著(P>0.05)。模型R2Adj=0.918 7,说明不确定因素对试验结果干扰较小,仅有总变异的8.13%不能用此模型解释。一次项 A、B、C 影响极显著(P<0.01);交互项 AC、BC、CD 影响极显著(P<0.01);A2、B2影响极显著(P<0.01),C2影响显著(P<0.05)。根据 F 值可知各因素对黄酮得率影响程度的大小顺序为超声温度>料液比>加水量>超声时间。
2.2.2 响应面分析
各因素交互作用响应面图见图6。

图6 各因素交互作用的响应面图Fig.6 Response surface plots showing the mutual effects of different factors
响应面曲面图的曲面越陡峭,说明该因素对黄酮得率影响越大。由图6可明显看出,A(加水量)及 C(超声温度)、B(料液比)及 C(超声温度)、C(超声温度)及D(超声时间)的交互作用的曲面有较大的倾斜度,说明这些交互项对红枣黄酮得率影响较大。
2.2.3 验证试验
根据优化得出的最佳条件为加水量45.28%,料液比 1∶40(g/mL),超声温度 69.99 ℃,超声时间 43.92 min。考虑到操作条件的可行性,最终将试验条件调整为加水量 45%,料液比 1∶40(g/mL),超声温度 70 ℃,超声时间44 min,进行回归模型有效性验证,此时黄酮得率为5.79 mg/g,该值和理论值(5.95 mg/g)基本一致,表明采用Box-Behnken分析法优化红枣中黄酮的提取工艺可行。
2.3 总还原力的测定结果
总还原力的测定结果见图7。

图7 红枣黄酮总还原力的变化Fig.7 Changes of total reduction ability of jujube flavonoids
由图7可知,不同质量浓度的红枣黄酮均表现出一定的总还原力,且总还原力随其质量浓度的增大而增强。总体VC还原力比样品总还原力要强,其主要原因是作为阳性对照的VC为纯品,而本文提取得到的仅为粗品黄酮,并未进一步分离纯化。但仍可以发现,红枣中的黄酮具有较好的还原能力。
3 结论
本文以红枣为研究对象,以氯化胆碱与尿素构建的DES为提取溶剂,研究氯化胆碱与尿素的摩尔比、加水量、料液比、超声温度、超声时间对红枣中的黄酮得率及总还原力的影响。通过响应面优化试验确定黄酮提取的最佳工艺参数:氯化胆碱与尿素摩尔比为2∶1,加水量 45%,料液比 1∶40(g/mL),超声温度 70 ℃,超声时间44 min,此时黄酮得率为5.79 mg/g。红枣中黄酮的总还原力随浓度增加而增大,红枣黄酮粗提液具有较好还原力。
