基于生物信息学分析自噬基因在骨肉瘤发生发展中的作用及其评估预后的价值
2021-09-16徐建勋朱鸣镝张亚峰
孙 杰,徐建勋,姚 晨,朱鸣镝,张亚峰
(南通大学附属医院骨科,南通 226001)
骨肉瘤(osteosarcoma,OS)是儿童和青少年常见的原发性骨源性恶性肿瘤,具有高侵袭性且血运丰富,早期即可发生广泛的肺转移,临床上患者死亡率高,预后差[1]。OS 可发生在任何骨中,长骨干骺端为其主要好发部位,以股骨和胫骨常见,其次是肱骨、骨盆等。膝关节周围是OS 最常见的发生部位,占所有受累部位的50%[2]。据报道[3],晚期及转移性OS 患者5 年总生存率仅约20%。因此,找出理想的肿瘤生物学标志物和治疗靶点对改善OS 患者的预后、延长生存期具有重要的临床意义。
自噬是一种细胞将自身不需要的蛋白质或受损的细胞器的一部分包裹在双层膜囊泡中,传递至溶酶体进行降解的高度保守的分解代谢过程,对细胞应激时保持其稳定及存活极其重要。近年来有研究[4]表明,自噬参与成骨细胞和破骨细胞的分化过程,同时也可以调节两者的功能,参与骨质疏松(osteoporosis,OP)和OS 等多种骨疾病的发生发展过程。
本研究利用肿瘤基因组图谱(the cancer genome atlas,TCGA)和基因表达数据库(gene expression omnibus,GEO),筛选出OS 组织或细胞和正常骨细胞及其前体之间的差异自噬基因,利用基因本体论(gene ontology,GO)分析及京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)分析、蛋白质-蛋白质相互作用网络(protein-protein interaction network,PPI)分析等方法探索自噬相关基因在OS 发生发展中的作用及其评估预后的价值。
1 资料与方法
1.1 自噬基因及基因芯片数据的获取 从人类自噬数据库(human atuophagy database,HADb)(http://www.autophagy.lu/index.html)中获得233 个自噬基因。GSE42352 的基因芯片的系列矩阵文件来源于美国国立生物技术信息中心(National Center of Biotechnology Information,NCBI)基因表达数据库,该数据已经过RMA 标准化处理。该基因芯片含有118 份临床标本或细胞系基因表达谱数据,其中包括84 份临床骨肿瘤活检组织、19 份OS 细胞系和15 份正常骨细胞及其前体细胞。GSE42352 基因芯片矩阵文件提取自噬基因的表达矩阵文件。从TCGA 中下载具有临床生存信息的81 例OS 样本信息,内容包括完整的生存状态及生存时间(https://portal.gdc.cancer.gov/)。
1.2 数据处理 均值函数处理GSE42352 样本数据后使用R(版本3.6.1,https://www.r-project.org/)中的Wilcoxon 检验,鉴定出在肿瘤和正常样品之间差异表达的12 种自噬基因[|log2(倍数变化)|>1 且错误发现率(false discovery rate,FDR)<0.05]。将TCGA 中OS样本差异自噬基因的表达数据相应的临床信息整合在一起。
1.3 基因富集分析 使用“org.Hs.eg.db”“clusterProfiler”“enrichplot”“ggplot2”“colorspace”“stringi”包进行enterzid 转换,GO 功能分析(展示目录为24,调整后P<0.05),KEEG 通路富集分析(展示目录为25,调整后P<0.05)。
1.4 差异基因编码蛋白间相互作用的分析 由在线分析网站string(https://string-db.org/)得到差异表达基因的蛋白相互作用网络,将所得源文件导入Cytoscape 进行可视化分析,用插件cytoHubba 进行Hub 基因分析,并根据其最大团中心性(maximal clique centrality,MCC)排名筛选出核心基因。
1.5 生存分析 整合TCGA 中OS 样本临床数据(生存状态及生存时间)和样本中自噬基因表达量。根据中枢基因的中位表达值将其分为两组,使用survival 和survminer 包绘制Kaplan-Meier 曲线以显示两组之间的总体生存率差异,P<0.05 为差异有统计学意义。
2 结果
2.1 差异自噬基因及其热图 在GSE42352 中,差异自噬基因有12 个,其中上调基因3 个,下调基因9 个,见图1。
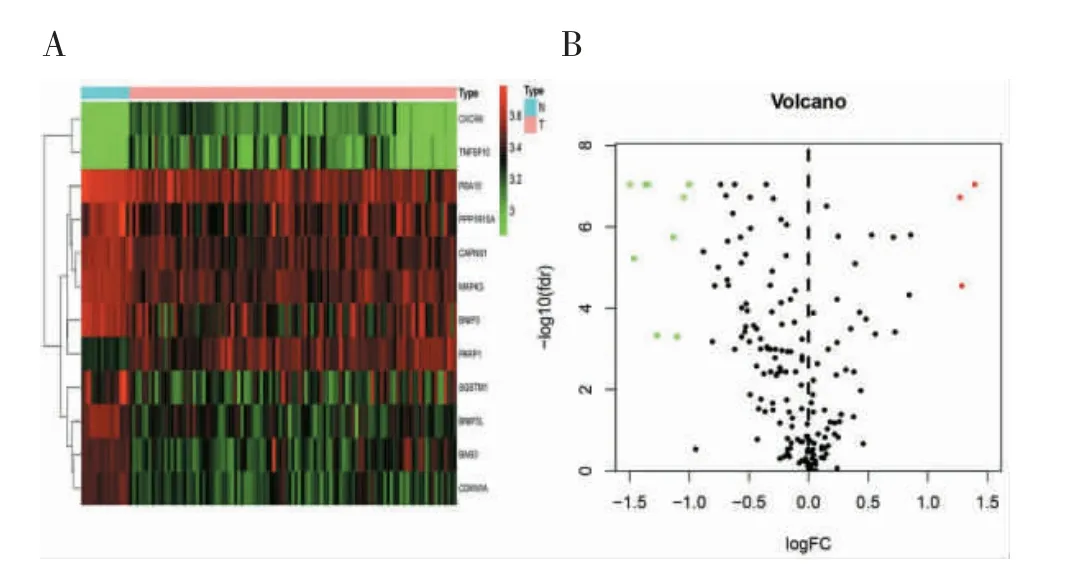
图1 高通量测序芯片数据GSE42352 中差异自噬基因分析
2.2 GO 富集分析、KEGG 通路分析及PPI 分析 对12 个差异自噬基因的GO 及KEGG 结果分析显示,差异自噬基因在生物过程中参与大自噬、大自噬调节、线粒体调控等;细胞成分表现为核被膜和线粒体外膜部分;分子功能与泛素及泛素样蛋白酶结合过程。KEGG 通路分析结果显示,差异自噬基因可通过叉头转录因子O1(forkhead box O1,FoxO1)、表皮生长因子受体(epidermal growth factor receptor,EFGR/ErbB)、缺氧诱导因子-1(hypoxia inducible factor-1,HIF-1)信号通路实现上述各种生物学功能,并且参与人体多种恶性肿瘤如膀胱癌、非小细胞肺癌及肾透明细胞癌的发生发展过程,见图2。根据cytoHubba的算法-MCC 排名筛选出核心基因,最终得到2 个关键基因,分别为Sequestosome1(SQSTM1)和丝裂原活化蛋白激酶3(mitogen-activated protein kinase 3,MAPK3),见图3。

图2 差异自噬基因的GO 富集分析(A)及KEGG 通路分析(B)
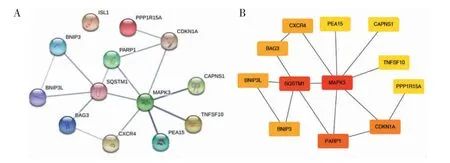
图3 差异自噬基因的蛋白相互作用网络分析
2.3 生存分析 在TCGA 数据库中获得12 个差异自噬基因在骨肿瘤患者中的表达数据,根据表达差异分为低表达组和高表达组,对两组患者的总体生存期进行分析。结果显示,12 个差异自噬基因中、DNA修复酶1[poly(ADP-ribose) polymerase 1,PARP1]、肿瘤坏死因子超家族因子10(tumor necrosis factor superfamily member 10,TNFSF10)、SQSTM1 高表达组患者预后比低表达组相对较好(P=0.032、0.043、0.048);Bcl-2/腺病毒E1B 19 ku 相关蛋白3(Bcl-2 interacting protein 3,BNIP3)低表达组患者预后比高表达组相对较好(P=0.021),见图4。
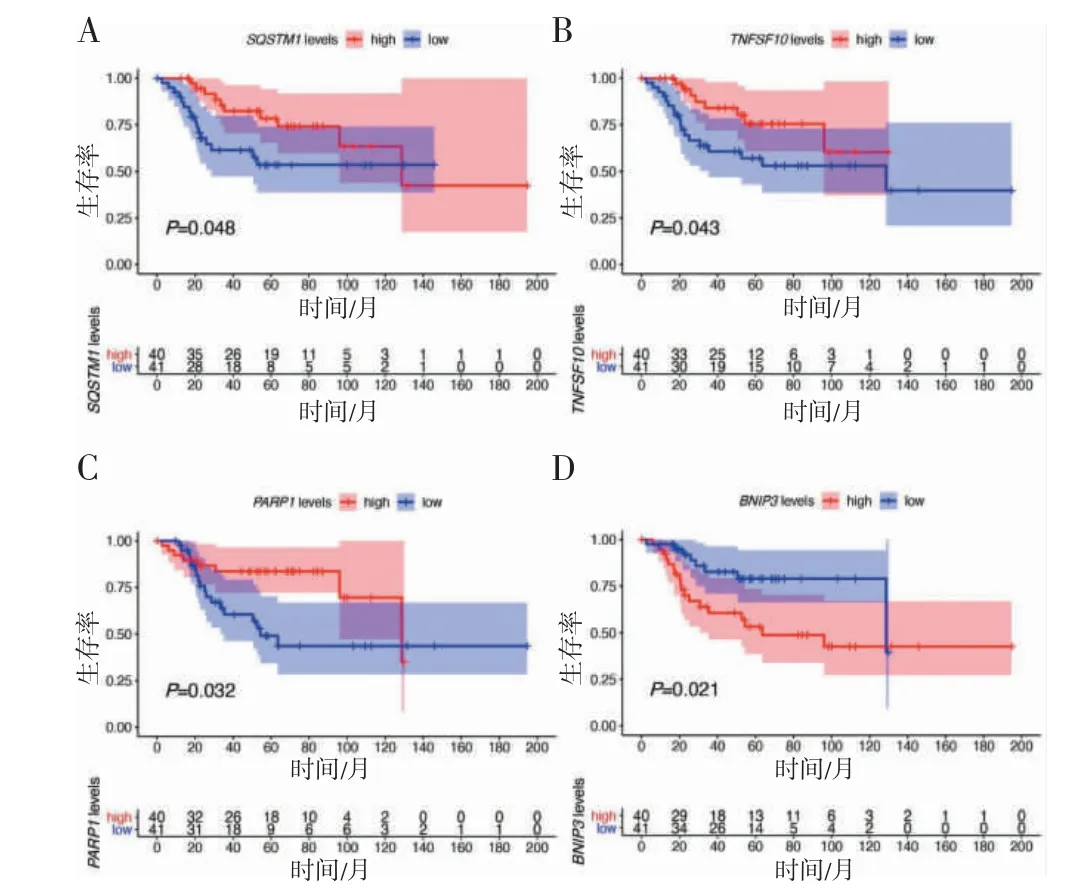
图4 OS 患者中自噬基因SQSTM1(A)、TNFSF10(B)、PARP1(C)及BNIP3(D)与患者预后的生存曲线图
3 讨论
OS 具有较高的发病率、致残率和死亡率,严重影响患者的生活质量和预后。OS 患者最常见的症状是疼痛和肿胀,通常就诊时其肿痛的症状已经持续了几个月甚至数年。由于肿瘤快速生长,肿瘤部位的皮肤常张力高、皮温高,且浅静脉充盈明显。骨肿瘤患者开放性活检手术后常导致病理性骨折[5]。
OS 恶性程度高,具有高度浸润性和远处转移潜力,易在发病初期和手术后发生血源性转移,转移部位中最常见的是肺,预后差[6-7]。在临床上,OS 通常采用外科手术联合放疗或化疗[8-9]。目前随着大剂量联合化疗的应用,无转移患者5 年生存率已提高到55%~70%。但一旦发生转移,患者5 年生存率仅5%~20%[10]。因此,了解OS 的发生发展及转移对其诊断和治疗仍非常重要。
研究[11-12]表明肿瘤细胞可利用自噬作为一种动态机制来抑制癌变的初始步骤或支持已存在肿瘤的存活和生长。在肿瘤发生的早期阶段,自噬可以通过限制染色体的不稳定性,限制氧化应激来抑制肿瘤。而在肿瘤的晚期阶段,肿瘤细胞可利用自噬来维持线粒体功能和动态平衡,以应对无节制增殖所需要的高能量。
同样,自噬与OS 的发生发展关系密切,已有大量研究[13]表明自噬能够促进OS 细胞的存活。CYT997是一种具有抗癌活性的新型有效药物,可通过增加GFPLC3 点的数目,自噬体的形成及自噬相关蛋白LC3B-Ⅱ和Beclin-1 的表达来诱导自噬的增强。有研究者[14]将CYT997 与自噬抑制剂3-MA 和CQ 或Atg5-和Atg7 靶向的短发夹RNA(short hairpin RNA,shRNA)结合使用,结果表明CYT997 加上自噬抑制剂产生了显著的抗癌作用,表明CYT997 诱导的自噬可以促进肿瘤生长。有关康普他汀A-4(CA-4)的研究[15]表明,CA-4 可以激活自噬进而促进肿瘤细胞的存活。此外,在OS 经常失活的肿瘤抑制因子中,RB 转录抑制因子1(RB transcriptional corepressor 1,RB1)可以通过抑制E2F 转录因子1(E2F transcription factor 1,E2F1)诱导自噬[16];生长素响应因子(auxin response factor,ARF)可以通过减少细胞中的Beclin-1/Bcl-xl复合物从诱导自噬[17];WNT 抑制因子1(WNT inhibitory factor 1,WIF1)可以通过抑制Wnt/β-catenin 信号通路诱导自噬[18];磷酸酶和张力蛋白同源物(phosphatase and tensin homolog,PTEN)可以通过p-JUN-SESN2/AMP 信号通路诱导自噬[19];肿瘤抑制STF cDNA 3(tumor-suppressing STF cDNA 3,TSSC3)也可以通过下调PI3K/Akt/mTOR 信号通路诱导自噬[20]。在OS 激活的几种癌基因中,胰岛素样生长因子2(insulin like growth factor 2,IGF2)可以通过建立自噬“休眠”状态来保护OS 细胞存活[21];H19 过表达可通过PI3K/AKT/mTOR 信号通路促进侵袭和自噬[22];RUNX 家族转录因子2(RUNX family transcription factor 2,RUNX2)可以通过增强LC3B 囊泡的运输来促进自噬[23],这些结果表明自噬参与OS 发生发展的众多过程并发挥重要作用。
随着高通量测序及基因表达谱芯片技术的发展,越来越多OS 中的潜在基因治疗靶点被发现。本研究首先从HADb 中获得233 个自噬基因,然后通过对基因表达谱芯片GSE42352 的数据进行生物学信息分析,筛选出12 个差异自噬基因,分别为BAG Cochaperone 3(BAG3)、BNIP3、BNIP3 Like(BNIP3L)、钙蛋白酶小亚基1(Calpain small subunit 1,CAPNS1)、细胞周期蛋白依赖性激酶抑制剂1A(cyclin dependent kinase inhibitor 1A,CDKN1A)、C-X-C 基序趋化因子受体4(C-X-C motif chemokine receptor 4,CXCR4)、MAPK3、PARP1、增殖和凋亡衔接蛋白15(prolifera tion and apoptosis adaptor protein 15,PEA15)、蛋白磷酸酶1 调节亚基15A(protein phosphatase 1 regula tory subunit 15A,PP1R15A)。其 中CXCR4、PARP1、TNFSF10 显示为OS 发生发展中的促癌基因,BAG3、BNIP3、BNIP3L、CAPNS1、CDKN1A、MAPK3、PEA15、PPP1R15A 及SQSTM1 显示为OS 发生发展中的抑癌基因。GO 及KEGG 富集分析结果显示,12 个差异自噬基因可通过HIF、ErbB 等信号通路实现调节骨肿瘤中大自噬等生物学过程;并且参与人体多种恶性肿瘤如膀胱癌、非小细胞肺癌及肾透明细胞癌的发生发展过程。为了进一步筛选关键基因,本研究利用string 构建了一个由12 个节点、15 条边组成的蛋白质-蛋白质互作网络,利用Cytoscape 对该网络可视化,并用cytoHubba 插件来筛选目的基因。根据算法得到2 个关键基因,分别为SQSTM1 和MAPK3。随后对12 个差异基因进行生存曲线分析,结果表明PARP1、TNFSF10、SQSTM1 及BNIP3的表达与OS患者的预后有关。其中SQSTM1 既是复合基因网络中的关键基因,又与患者的预后相关,有望成为OS新的治疗靶点,值得进一步深入探究。
综上所述,OS 的发生发展受各种复合基因网络调控,在自噬相关复合基因网络中,BAG3、BNIP3、BNIP3L 等12 个自噬相关基因起到重要作用,SQSTM1 和MAPK 是该网络中的核心基因。PARP1、TNFSF10、SQSTM1 及BNIP3 与OS 的预后相关,有望成为有效抑制OS 的靶点。
