2例肺腺癌EGFR-TKIs耐药后转化小细胞肺癌的病例报道及文献回顾
2021-09-16张兰兰李向敏毛志远元霄梅于海燕樊再雯
张兰兰,李向敏,毛志远,晋 颖,元霄梅,于海燕,樊再雯
分子靶向药物对携带敏感突变基因肿瘤的治疗具有精准性和敏感性,分子靶向治疗已成为基因突变的非小细胞肺癌(non-small cell lung cancer,NSCLC)的一线治疗方案[1]。相比传统的放、化疗,表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor tyrosine kinase inhibitors,E G F R-T K I s)不仅改善了表皮生长因子受体(epidermal growth factor receptor,EGFR)基因突变的NSCLC患者的无进展生存期和总生存期,而且提高了生活质量。但是EGFR-TKIs也不可避免出现耐药现象。目前已发现EGFR-TKIs继发性耐药的机制主要有T790M突变、C-Met基因扩增、K-ras基因突变、BRAF基因突变、小细胞肺癌转化、上皮-间充质转化等。现报道2例肺腺癌患者EGFR-TKIs治疗后转化为小细胞肺癌的病例。
1 病例资料
例1,男,56岁,无吸烟史。2016年8月出现痰中带血,10月就诊北京某三甲医院行胸部CT检查提示:左肺下叶占位,行PET/CT检查提示:左肺下叶肿块影,约2.6 cm,肺癌可能性大(图1A)。2016年11月于北京某三甲医院行胸腔镜下左肺下叶切除术,术后病理示:肺周围性浸润性腺癌,术后诊断:左下肺浸润型腺癌(pT2N1M0,ⅡB期),免疫组化:TTF-1(+)、EGFR(++)、HER2(-)、P40(-)、CEA(+++)、P53(++)、PTEN(-)、Ki-67(50%),ALK(-)。术后组织行二代基因检测(next generation sequence,NGS),示EGFR 18外显子G719S(12.24%) 及20外显子S768I(11.45%)突变,TP53突变(6.63%)。2016年12月—2017年2月原空军总医院肿瘤科行PC方案(培美曲塞+顺铂)化疗4周期。期间定期复查。2018年1月复查PET/CT,示右侧肾上腺新发转移瘤,大小约1.8 cm;行头颅增强MRI检查,示左侧额叶新发转移瘤,大小约0.8 cm(图1B);遂于北京某三甲医院行脑转移病灶伽马刀及右侧肾上腺转移灶射波刀治疗。2018年2月开始口服阿法替尼,30 mg,1 qd。1个月后复查,右侧肾上腺转移瘤消失;脑转移瘤较前缩小,评价疗效为部分缓解(partial remission,PR),并继续口服阿法替尼。8个月后复查头颅MRI,示脑转移瘤消失(图1C),疗效评估完全缓解(complete response,CR)。期间定期复查,2019年7月发现血清神经元特异性烯醇化酶(neuron-specific enolase,NSE)升高:28.29 ng/ml(参考值:0~24 ng/ml);行下腹CT检查,示腹膜后新发肿大淋巴结,最大者约4.6 cm×1.6 cm(图1D)。2019年7月31日于北京某三甲医院行腹膜后淋巴结射波刀治疗。行全血NGS检测,仍显示EGFR18外显子G719S突变 (26.8%) 及20外显子S768I 突变(26.7%),TP53突变(43.5%)。2019年9月2日行颈部CT检查,示左侧颈根部锁骨上窝肿大淋巴结,大小约3.4 cm×2.6 cm×3.3 cm(图1E)。遂于原空军总医院行左锁骨上淋巴结穿刺活检,病理提示:符合小细胞癌转移(图2)。免疫组化:Ki-67(90%+),P53(+),TTF-1(+),NapsinA(-),CD56(+),syn(+),NSE(-),CgA(-),Ventana方法:ALK-L(-)。同时活检组织行NGS检测提示:EGFR 18外显子G719S突变(40.3%)及20外显子S768I突变(41.5%),TP53突变(76.8%)。2019年8月28日—12月19日行CE方案(依托泊苷+卡铂)化疗6周期,化疗后出现Ⅲ度骨髓抑制,升白细胞治疗好转。化疗过程中每2个周期复查颈部淋巴结超声及腹部CT,均显示病灶缩小(图1F、G),疗效评价为PR。2020年1—2月行左锁骨上区淋巴结局部放射治疗。2个月放疗结束后于原空军总医院行PET/CT检查,示全身未见明显高代谢阳性病灶,疗效评价CR,外周循环肿瘤细胞阴性。2020年5月行度伐利尤单抗持治疗,期间定期复查,疗效持续CR。
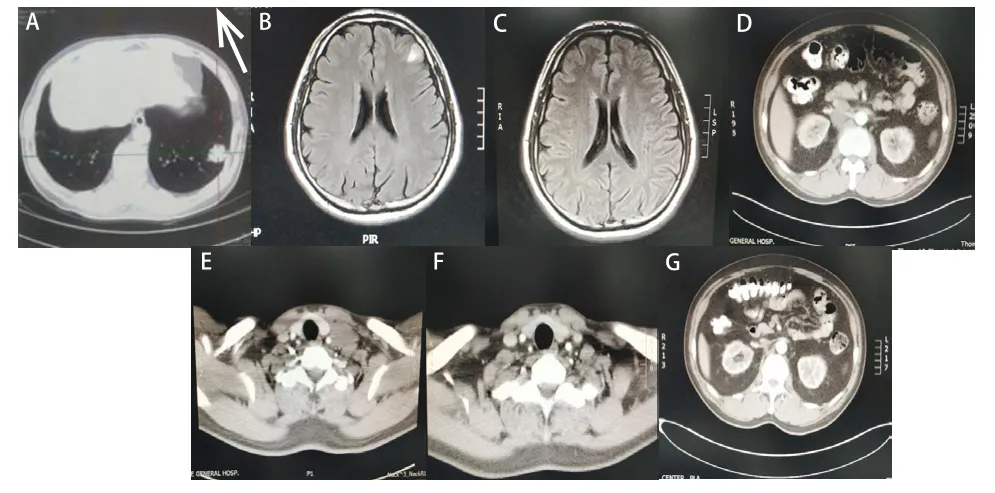
图1 例1治疗前后病灶的变化

图2 例1病理图片
例2,男,46岁,无吸烟史。2017年7月体检发现左肺占位,遂于原空军总医院行PET/CT检查,示左肺上叶周围性肺癌(图3A),7月19日于胸外科行左肺上叶切除并淋巴结清扫术,术后病理:左肺上叶中分化腺癌,诊断:左肺腺癌(pT2aN0M0 ⅠB期);免疫组化:CK7(-)、CK20(-)、CK5/6(-)、P53(++)、P40(-)、Ki-67(50%)、TTF-1(+)、EGFR(+++),Ventana方法:ALK-L(-)。未接受辅助化疗。此后定期随访。2018年1月患者诉活动后腰痛,数字评分法(numerical rating scale,NRS):3分。行脊柱MRI检查,示多处腰、胸椎体转移;行颅脑MRI检查,示左侧颞叶海马转移瘤,大小约0.4 cm(图3B)。同时行全血NGS检测,示EGFR 21外显子L858R突变(57.6%),TP53突变(19.1%)。2018年1月起口服吉非替尼,250 mg,1 qd,1周后患者诉腰部疼痛完全缓解,定期应用唑来膦酸抑制骨转移。期间每2个月复查,脊柱转移灶、颅内转移瘤缓慢进行性增大,疗效评价缓慢进展(progressive disease,PD)。2019年1月行头颅MRI检查,示颅内多发转移瘤,同时行全血NGS检测,示EGFR 21外显子L858R突变(81.4%),EGFR 20外显子T790M突变(7.7%),TP53突变(25.2%);考虑吉非替尼耐药,给予奥希替尼,80 mg,口服,1 qd。2019年2月底患者诉腰痛,部位同前,NRS法疼痛评分:6~7分,2019年3月原空军总医院放疗科行腰5椎及髂骨局部放疗,并就诊北京某三甲医院行颅内转移瘤伽马刀治疗。2个月后检查头颅、脊柱MRI均提示转移瘤较前缩小,疗效评价PR。2019年8月出现右侧部分视野缺损,考虑脑转移瘤周围水肿,给予贝伐珠单抗注射液静滴缓解脑转移瘤周围水肿导致视野缺损的症状。2019年9月初发现右颈部包块,就诊北京某三甲医院行右侧颈部包块穿刺活检,病理结果示:中-低分化腺癌,伴部分小细胞分化,免疫组化结果:Ki-67(+70%),TTF-1(+)、Syn(-)、CD56+、CK7(+)、Napsin-A(+)、p40(-)、CK20(-),考虑为肺来源转移瘤;全血行NGS检测,示EGFR 21外显子L858R错义突变,T790M突变消失,疗效评价PD。2019年10月—2020年1月行贝伐珠单抗联合培美曲塞+卡铂方案治疗4周期,同时继续口服奥希替尼靶向治疗,1个月后颈部彩超及头颅MRI检查,示转移瘤较前缩小。胸部CT检查,示右肺上叶新发转移瘤,大小约0.7 cm,疗效评价局部PR。2020年4月行第5周期贝伐珠单抗联合培美曲塞+卡铂方案治疗,治疗后出现Ⅱ度骨髓抑制,对症治疗好转。全血行NGS检测,示EGFR 21外显子L858R突变(58.7%),伴EGFR基因扩增,TP53突变(19.2%)、RB1突变(1.8%)。于2020年5月1日、5月22日行西妥昔单抗联合培美曲塞+卡铂方案治疗2周期。复查胸部CT提示右肺、残余左下肺转移瘤,右肺尖肿块影较前未见明显缩小;上腹部CT及上腹部MRI提示肝右后叶下段病灶,考虑转移,疗效评价缓慢PD。患者拒绝行颈部肿块局部放射治疗,于2020年6月18日行第1周期西妥昔单抗+培美曲塞+依托泊苷方案治疗,治疗后出现Ⅳ度骨髓抑制,对症治疗好转。1个月后复查胸部CT,示双肺多发转移瘤(图3C),部分较前增大,疗效评价缓慢PD。故调整治疗方案,于2020年8月1日开始行西妥昔单抗联合紫杉醇维持治疗,目前患者一般情况差,间断爆发痛,给予对症止痛治疗。
2 讨论
EGFR-TKIs已成为驱动基因阳性的NSCLC一线治疗方案,但是其耐药性依旧不可避免。SCLC转化是耐药的一种方式,目前关于NSCLC转化为SCLC常见的假说有:①肿瘤异质性假说:发生的转化时间节点在EGFR-TKIs治疗之前;②NSCLC转化为SCLC假说:发生的转化时间节点在EGFR-TKIs治疗之后。③分子机制假说:RB1、TP53等基因突变与SCLC转化是相关的。Lee等[2]认为RB1和TP53基因同时突变使得NSCLC更倾向于转化为SCLC。Offin等[3]研究发现,EGFR/TP53/RB1 3个基因共突变型肺癌有更高的组织学转化的风险。Marcoux等[4]报道RB1、TP53和PIK3CA突变是EGFR突变的腺癌转化为SCLC、神经内分泌癌常见的基因突变。Hayashi等[5]认为RB1和TP53可作为发生SCLC转化的潜在标志物。2例患者TP53基因在转化前后均存在,且突变丰度在转化时较初治时增高;而第2例患者发生SCLC转化后可见RB1基因突变。故TP53和RB1基因同时突变提示SCLC转化的风险提高,预后不良。
总结2例患者的相同点如下:①2位患者均为不吸烟男性;②肺腺癌伴EGFR基因突变;③经EGFR-TKIs治疗后表型由肺腺癌转化为SCLC,且影像学显示远处淋巴结进行性增大;④发生转化时伴有NSE水平的升高;⑤转化后对EGFR-TKIs治疗不敏感。2例病例不同点在于:①第1例患者为非经典基因共突变(EGFR 18外显子G719s和20外显子S768I),有文献显示少见突变如18外显子(G719C、G719S、G719A)、21外显子(L861Q)和20外显子(S768I),对EGFR-TKIs也同样敏感[6],故给予患者口服阿法替尼;而第2例为常见突变(21外显子 L858R),故给予患者口服吉非替尼。②第1位患者转化为SCLC后对标准SCLC治疗方案敏感;而第2位患者转化为SCLC后对含铂两药化疗方案不敏感。建议肺腺癌EGFR-TKIs治疗后转化为SCLC的患者选择标准SCLC治疗方案,这类患者可能会从铂类化疗中获益[7]。有报道称免疫检查点抑制剂对EGFRTKIs耐药后转化的SCLC的患者的治疗也有效果[8]。但是目前尚缺乏关于SCLC转化免疫治疗的大型研究。根据Horn等[9]研究,考虑SCLC转化型肺癌有SCLC的特征,故对于第1例患者给予免疫维持治疗,病情维持CR;而第2例患者一般情况差,给予保守治疗。
定期检测血清肿瘤标志物对监测EGFR-TKIs耐药有一定的帮助作用。2例患者均在SCLC转化时出现NSE升高。周彩存教授团队报道1例奥希替尼治疗耐药后发生SCLC转化的肺腺癌患者,其血清NSE的波动与治疗的反应和肿瘤的进展是一致的[10],胡廷婷等[11]也发现2例NSCLC患者EGFR-TKI耐药后SCLC转化时NSE水平显著升高。Zhang等[12]报道当NSE升高5倍是肺腺癌转化SCLC的高危因素。因此血清NSE可做为动态监测SCLC转化的指标。
肺癌患者在治疗前进行NGS检测,不论对于评估疗效,还是预测耐药都是有意义的。而且液体活检相对于组织活检来说,减少了对患者的有创操作,且更加灵活和方便,血液、胸水、脑脊液等均可做为检测标本,血液检测EGFR T790M突变的敏感性高达70%~77%[13],但是其特异性有待于提高,故目前两次活检对确诊EGFR-TKIs耐药的肺腺癌患者依旧为诊断的金标准。根据多项关于转化SCLC的分子机制的研究,或许NGS检测可以从分子机制为NSCLC向SCLC转化的机制提供精准判断,从而为SCLC转化的患者提供精准治疗。
