NAF与EGCG联合应用对变异链球菌的作用研究
2021-09-16刘晓璇
刘晓璇,方 圆,王 瑞
龋病是一种牙体硬组织疾病,主要是由于牙菌斑生物膜附着在牙齿表面产酸,对牙体硬组织造成损伤[1]。早在19世纪,研究结果已经证实变异链球菌与龋病具有相关性[2]。变异链球菌在口腔中具有极强的附着能力,能在牙面上形成细菌生物膜,通过利用多种碳水化合物产酸形成低pH值环境,从而改变口腔内环境,为其他产酸菌和耐酸菌提供有利的生存环境[3-4]。因此,通过减少变异链球菌生长及其生物膜的形成,可以有效预防龋病的发生。
氟化钠(sodium fluoride,NAF)是一种公认的双重功能防龋剂,对牙齿硬组织保护和口腔微生物调节均具有重要作用[5],NAF既是糖酵解酶抑制剂,又是跨膜质子载体,可以通过诱导细胞质酸化来抑制细菌的生长[6-7]。茶叶作为一种天然的抗龋物质,茶多酚已被证实可以有效防止龋病的形成,甚至抑制龋病的发展[8],此外它还具有抑制口腔相关致龋菌生长的功能。表没食子儿茶素没食子酸酯(Epigallocatechin gallate,EGCG)是茶多酚中主要的抗微生物单体成分,它具有抑制变异链球菌生长繁殖和产酸的作用[9-10]。现有研究显示NAF与EGCG都具有良好的抗菌性能,因此我们想要探讨两者联合应用是否能够对变异链球菌产生协同抑制作用,增强其抗菌性能,从而减少药物的使用量。
1 材料与方法
1.1 材料
变异链球菌(Streptococcusmutans,UA159)由吉林大学口腔医学院牙发育及颌骨重塑与再生重点实验室提供,牛脑心浸出液培养基(brain heart infusion,BHI)购自北京索莱宝科技有限公司,结晶紫染料购于珠海迪尔生物工程有限公司,EGCG购自北京索莱宝科技有限公司,NAF购于上海易恩化学技术有限公司。
1.2 细菌的培养
将-80 ℃冻存的变异链球菌复苏后接种于琼脂板,于37 ℃恒温培养箱、厌氧条件下培养24 h后,接种于BHI液体培养基中继续培养至对数生长期,用于后续实验。
1.3 NAF与EGCG对变异链球菌生长的抑制作用
通过微量稀释法测量NAF与EGCG对变异链球菌生长的抑制作用[11],在96孔微量滴定板的孔中均加入100 μL变异链球菌(1×107CFU/mL)和100 μL系列稀释的试剂。先通过预实验,最终确定NAF的浓度范围为125.000、100.000、62.500、31.250、25.000、15.625 mg/L,EGCG浓度范围为500.00、250.00、125.00、62.50、31.25 mg/L。将菌液分别和不同浓度的EGCG或NAF试剂在96孔微量滴定板中混合,在37 ℃厌氧环境下孵育24 h,然后用酶标仪测定各孔于600 nm波长处的OD值以评估细菌生长情况,定性检测药物最小抑菌浓度值(minimal inhibition concentration,MIC),药物最小抑菌浓度值(MIC50)定义为与对照组相比至少抑制50%细菌生长的最低药物浓度。
1.4 NAF与EGCG联合应用对变异链球菌生长的抑制作用
NAF与EGCG联合应用对变异链球菌生长的抑制作用通过棋盘微量稀释法来测定,将菌液与不同浓度的NAF和EGCG混合溶液加入96孔板中,检测联合应用时NAF与EGCG的MIC值,然后计算分级抑菌浓度指数(fractional inhibitory concentration,FIC)用来判断两者是否有潜在协同作用[11]。FIC=联合用药时甲药MIC/单独应用甲药时MIC+联合应用乙药时MIC/单独应用乙药时MIC。FIC指数为<0.500、0.500~1.000、1.000~2.000、>2.000时分别表示协同、相加、无关、拮抗作用。
1.5 生物膜的检测
检测NAF与EGCG对变异链球菌生物膜的抑制作用是将100 μL变异链球菌(1×107CFU/mL)与100 μL不同浓度的药物溶液一同加入96孔板中,根据预实验确定药物的最终浓度梯度为NAF(125.000、62.500、31.250、15.625 mg/L)、EGCG(125.000、62.500、31.250、15.625 mg/L)、检测单独与联合应用对生物膜抑制实验时药物的浓度分别为(25.0 mg/L NAF、62.5 mg/L EGCG、25.0 mg/L NAF+62.5 mg/L EGCG),于37 ℃、厌氧条件下进行培养24 h[12],吸出上清液,生理盐水洗涤3次,用戊二醛固定15 min,结晶紫染色10 min后用生理盐水清洗3次,加入95%的乙醇,将板在室温下摇动30 min,用酶标仪测量600 nm波长处的OD值。最小生物膜抑制浓度(minimal biofilm inhibitory concentration,MBIC)定义为与未处理的对照相比,至少抑制了50%生物膜(MBIC50)形成时的药物浓度。
1.6 NAF与EGCG对变异链球菌产酸的影响
测定不同浓度的NAF与EGCG联合应用以及单独应用时对变异链球菌产酸的影响[11],取对数生长期的变异链球菌培养于BHI培养基(含1%蔗糖)中,调整初始pH值为7.5,每个试管中各含有4 mL菌液和4 mL不同浓度的药物溶液,检测单独与联合应用对产酸抑制作用时药物的浓度分别为(25.0 mg/L NAF、62.5 mg/L EGCG、25.0 mg/L NAF+62.5 mg/L EGCG),37 ℃厌氧环境下培养24 h,每隔4 h测量各个试管中变异链球菌的pH值,即pH1。计算ΔpH=pH0-pH1,抑制产酸率=(ΔpH对照组-ΔpH实验组)/ΔpH对照组×100%,并绘制“时间—pH值”曲线。
1.7 统计学方法
采用SPSS 16.0软件进行统计分析,进行单因素方差分析(ANOVA),并使用t检验进行多组之间均值的比较,以P<0.05为差异有统计学意义。所有实验重复3次。
2 结 果
2.1 NAF与EGCG单独及联合应用对变异链球菌生长的影响
NAF对变异链球菌生长的抑制作用,从图1可以看出NAF能够显著抑制变异链球菌的生长,NAF对变异链球菌的MIC值为100 mg/L。
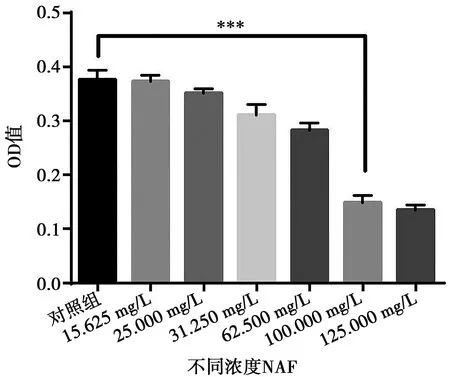
n=3;***:P<0.01
EGCG对变异链球菌生长的抑制作用,从图2可以看出EGCG能够抑制变异链球菌的生长,EGCG对变异链球菌MIC值为500 mg/L。
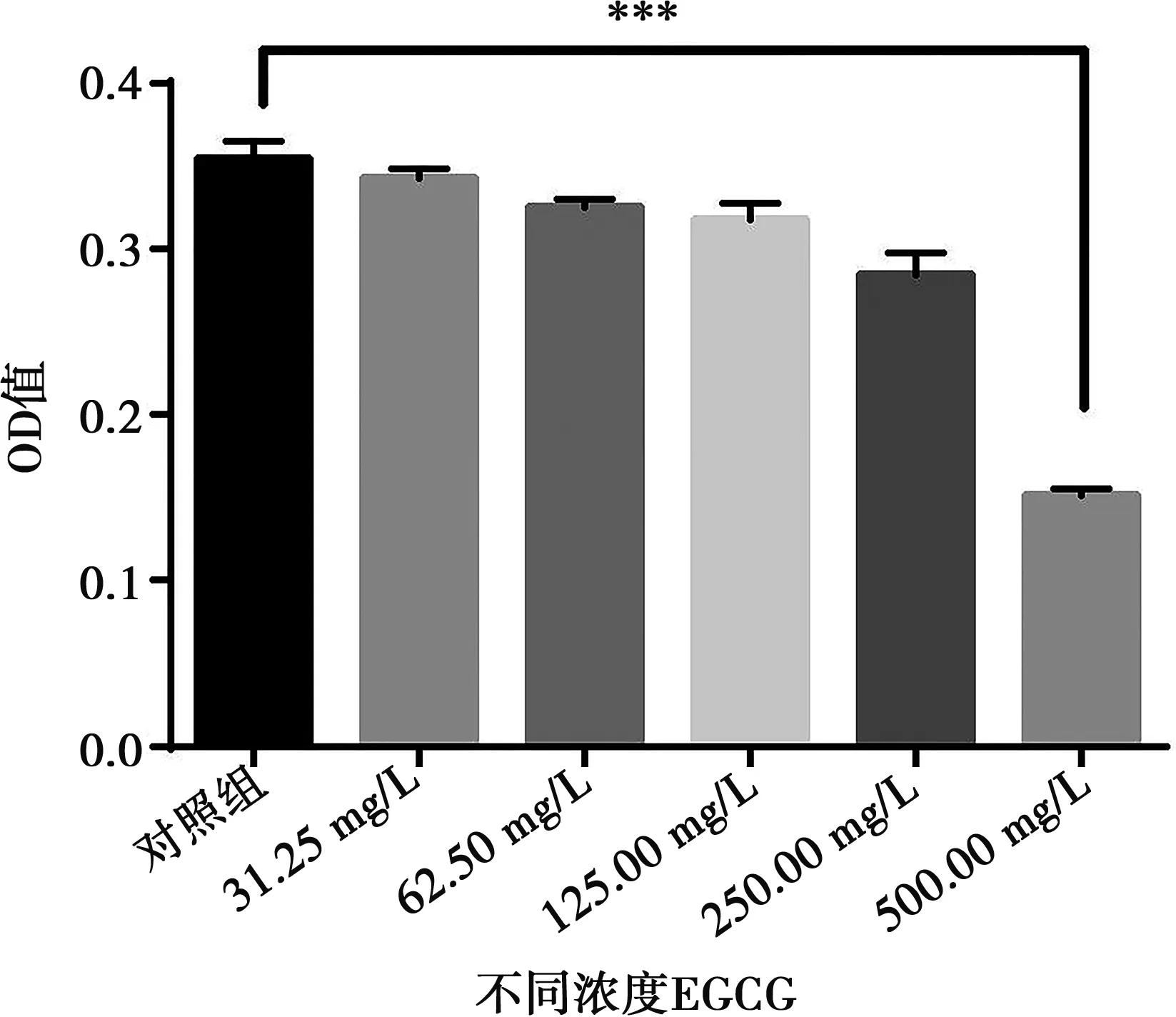
n=3;***:P<0.01
NAF与EGCG联合应用对于变异链球菌生长的影响由棋盘微量稀释法得出NAF与EGCG联合应用时NAF的MIC值为25.0 mg/L,EGCG的MIC值为62.50 mg/L,而单独应用时,NAF的MIC值为100 mg/L,EGCG的MIC值为500 mg/L,通过公式计算FIC值为0.375,<0.500,认为具有协同抑制作用。结果显示25.000 mg/L NAF与62.50 mg/L EGCG联合应用能达到单独应用100 mg/L NAF或500 mg/L EGCG时的抑菌效果,NAF与EGCG能够协同抑制变异链球菌的生长。
2.2 NAF与EGCG对变异链球菌生物膜的影响
NAF对变异链球菌生物膜的抑制作用,从图3可以看出NAF能够显著抑制变异链球菌生物膜的生长,NAF对变异链球菌的MBIC值为62.50 mg/L。
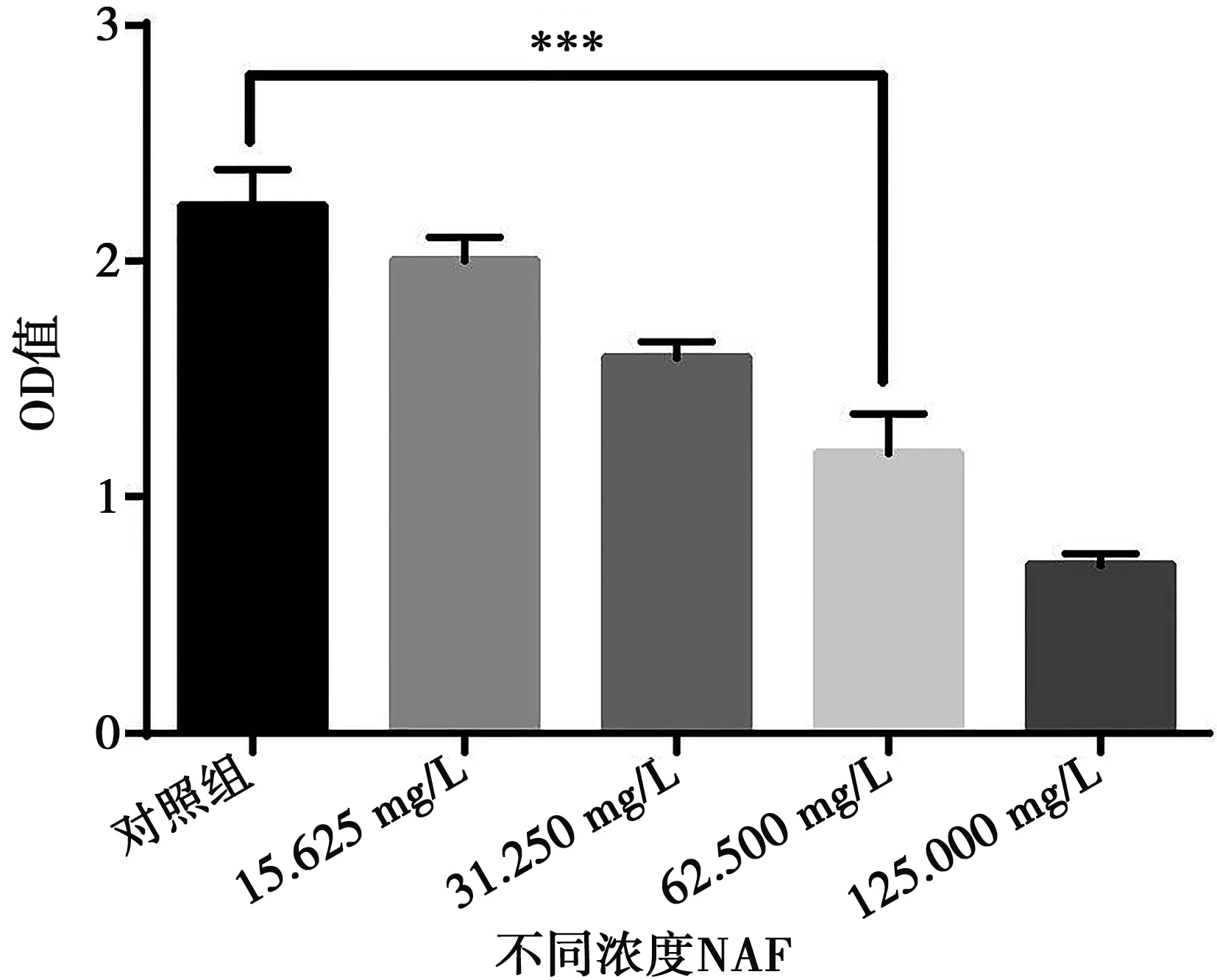
n=3;***:P<0.01
EGCG对变异链球菌生物膜的抑制作用,从图4可以看出EGCG能够抑制变异链球菌生物膜的生长,EGCG对变异链球菌MBIC值为62.50 mg/L。
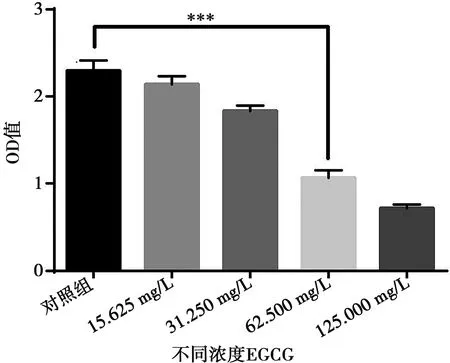
n=3;***:P<0.01
NAF与EGCG单独与联合应用对变异链球菌生物膜的影响,如图5、6结果显示,当联合应用25.000 mg/L NAF和62.50 mg/L EGCG时,变异链球菌的生物膜形成量与对照组相比显著减少(P<0.01),并且与单独应用25.000 mg/L NAF和62.50 mg/L EGCG时生物膜的形成量也相对减少(P<0.01)。

n=3;***:P<0.01
2.3 NAF与EGCG单独与联合应用对变异链球菌产酸的影响
如图7结果显示,NAF与EGCG均能抑制变异链球菌的产酸活动,24 h后25 mg/L NAF产酸抑制率为22.5%,62.50 mg/L EGCG产酸抑制率为35%。NAF与EGGC联合应用时25.000 mg/L NAF与62.50 mg/L EGCG混合溶液对变异链球菌的产酸抑制率为60%,比单独应用NAF或EGCG时产酸抑制率明显增加(P<0.01),充分说明两者联合应用能够增强对变异链球菌产酸的抑制作用。

A:25.000 mg/L NAF+62.50 mg/L EGCG组;B:EGCG(62.50 mg/L)组;C:NAF(25.000 mg/L)组;D:对照组
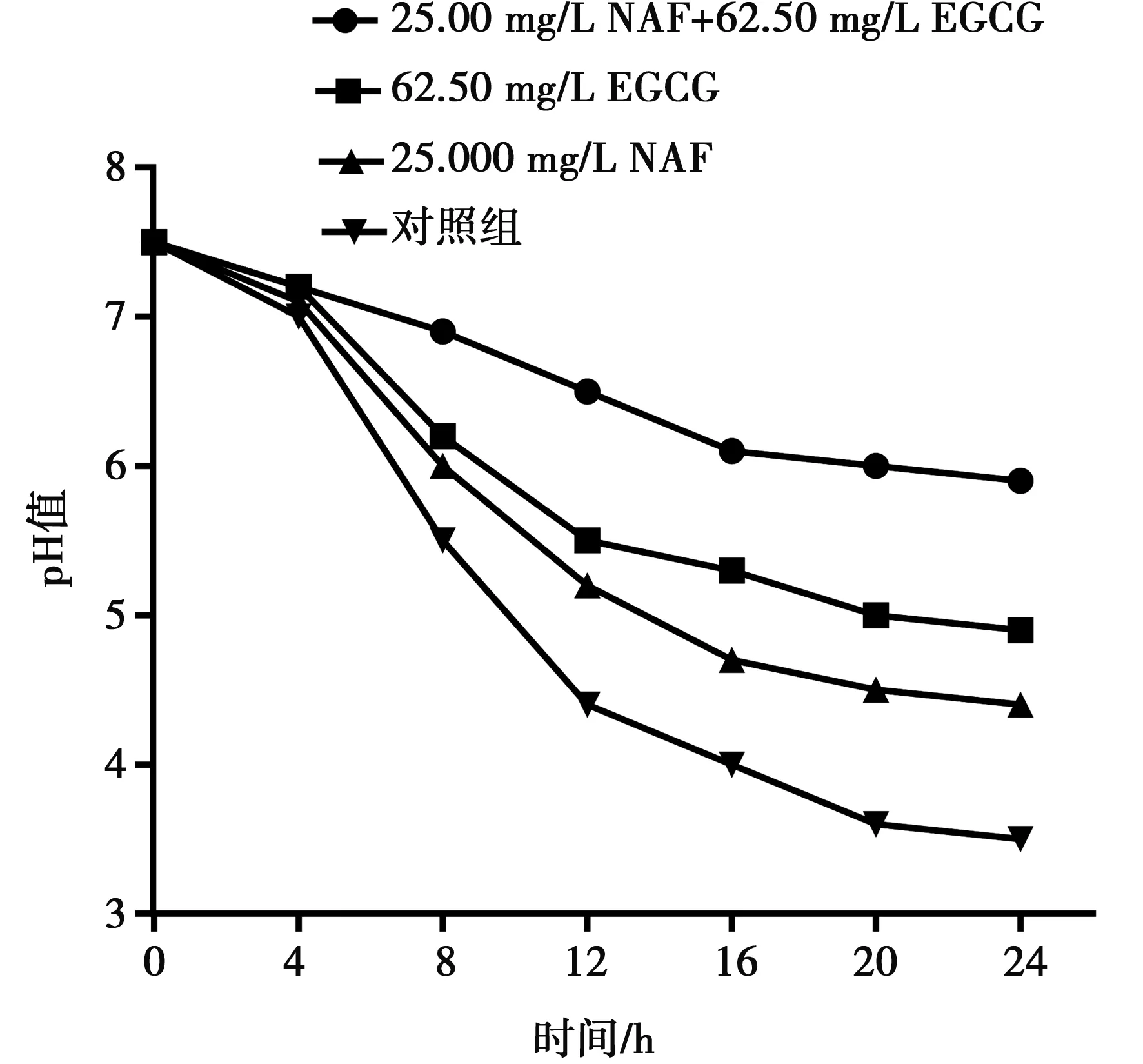
图7 NAF与EGCG单独和联合应用对变异链球菌产酸的影响
3 讨论
NAF作为一种传统防龋药物,在龋病预防上发挥着重要作用,但是近年来对氟化物安全性问题进行了大量研究讨论[13]。研究显示氟化物如果使用不当很容易造成氟中毒、氟牙症等其他疾病[14-15],因此提高NAF功效,减少NAF用量显得尤为重要[16]。通过研究NAF与EGCG联合应用对于变异链球菌的影响,寻找一个更好抑制变异链球菌生长繁殖的方法,为预防龋病提供一个新的思路[17]。
变异链球菌的致龋能力主要为耐酸性、产酸性以及生物膜形成能力,使变异链球菌能以生物膜的形式附着在牙齿表面,其糖酵解以及其他反应产生的酸性产物可对牙体硬组织造成损伤,并使变异链球菌在菌斑生物膜中保持优势地位[3]。通过对变异链球菌的生长,生物膜的形成,以及产酸方面进行研究,结果发现EGCG和NAF都能够显著抑制变异链球菌浮游菌以及生物膜的生长,并明显抑制变异链球菌的产酸反应。当NAF与EGCG联合应用时,抗菌性能显著增强,25.000 mg/L NAF与62.50 mg/L EGCG联合应用就可以达到单独使用100 mg/L NAF以及单独使用500 mg/L EGCG时的抑菌效果。NAF与EGCG联合应用生物膜的形成量比单独应用时生物膜形成量明显减少并且可以增强对变异链球菌产酸的抑制作用。相关研究显示变异链球菌的耐酸性主要与胍丁胺脱亚氨酶系统(agmatine deiminase system,AgDS)和F-ATP酶有关,而耐酸性是变异链球菌能在酸性环境中存活以及繁殖的重要特征,EGCG 可以抑制F-ATP酶活性与AgDS的作用,从而造成细胞质酸度增加,抑制细胞内一些不耐酸酶类的正常功能,包括糖酵解反应和EPS的生成,进而降低了细菌对酸性环境的适应性[18-20]。氟化钠以HF的形式进入细胞膜内,解离成H+和F-,还可将F-ATP酶排出的质子带回细胞质,不仅抑制了F-ATP酶的功能还使细胞质酸化,破坏了细菌的耐酸性,还可以导致细菌的死亡[21]。EGCG与氟化钠合用不仅可以破坏变异链球菌的耐酸性,还可以通过抑制葡萄糖基转移酶(glucosyltransferase,GTF)和唾液淀粉酶的活性来影响碳水化合物的代谢,一方面抑制细菌的生长和生物膜的形成,另一方面也减少了酸的产生,生物膜形成量的减少也使细菌繁殖及生长速率减慢,产酸量也可随之下降[8]。EGCG和氟化钠还可以通过多种途径抑制变异链球菌产酸,既可通过上述细胞质酸化影响糖酵解反应抑制细菌产酸,还可以通过抑制乳酸脱氢酶(lactate dehydrogenase,LDH)的活性[9-10]抑制酸性产物的生成。EGCG和氟化钠对变异链球菌的生长繁殖,生物膜以及产酸的抑制是通过一系列复杂生物联级反应造成的,除了上述的抑菌机制外还可通过其他途径抑菌。
本研究得出结论,当EGCG和氟化钠联合应用时,可以在增强NAF对变异链球菌抑制作用的同时减少NAF用量,并充分发挥EGCG天然抗龋剂的作用,从而为龋病防治提供一个新的方法。NAF与EGCG联合应用既可以通过相同的抑菌途径共同抑制细菌毒性,也可以通过不同的方式对细菌多种毒性因子进行抑制,从而达到比单独应用时更好的抑菌效果,但是具体抑制机制需要我们更加深入的研究。
