基于网络药理学分析当归补血汤治疗糖尿病肾脏病的内在机制
2021-09-15艾思南朱泽兵郑慧娟田蕾王耀献刘伟敬
艾思南 朱泽兵 郑慧娟 田蕾 王耀献 刘伟敬


摘要 目的:基于网络药理学探究当归补血汤治疗糖尿病肾脏病的内在可能作用机制。方法:采用中药系统药理学数据库与分析平台(TCMSP)获得当归补血汤(由黄芪、当归组成)主要活性成分和作用靶点信息;利用GeneCards数据库获取与糖尿病肾脏病相关的基因靶点,运用Cytoscape 3.7.1软件构建“药物-活性成分-靶点-疾病”网络,并运用R软件进行基因富集分析。结果:共获得当归补血汤活性成分30个,其中黄芪具有活性成分19个,当归具有活性成分11个,经筛选得到主要活性成分共19个;收集到药物与疾病共有靶点基因71个。基因富集分析结果显示,当归补血汤主要通过涉及炎症反应、凋亡-自噬通路、低氧诱导通路等的21条通路改善糖尿病肾病病情。结论:该研究基于网络药理学方法,揭示了当归补血汤从炎症反应、自噬-凋亡通路、低氧诱导通路等途径多成分、多靶点、多通路改善糖尿病肾脏病的作用,为后续研究开展实验工作提供了更丰富的信息和依据。
关键词 当归补血汤;黄芪;当归;糖尿病肾脏病;网络药理学
Exploring Mechanism of Danggui Buxue Formula Against DKD Based on Network Pharmacology
AI Sinan1,2, ZHU Zebing1, ZHENG Huijuan1, TIAN Lei1, WANG Yaoxian1, LIU Weijing1
(1 Renal Research Institution of Dongzhimen Hospital Affiliated to Beijing University of Chinese Medicine,
Beijing 100700, China; 2 Beijing University of Chinese Medicine, Beijing 100029, China)
Abstract Objective:To explore the potential possible mechanism of treatment of Diabetic Kidney Disease (DKD) by Danggui Buxue Decoction based on network pharmacology analysis. Methods:The TCMSP platform was used to collect information of the main active ingredients and targets of Danggui Buxue Decoction “Radix Astragali seu Hedysari”and “Radix Angelicae Sinensis”; the gene targets of DKD were obtained from the GeneCards database. Cytoscape 3.7.1 was used to build a drug-active ingredient-target-disease network and R software was used for gene enrichment analysis. Results:A total of 30 active ingredients of Danggui Buxue Decoction were obtained; Among them, Radix Astragali seu Hedysari had 19 active components, Radix Angelicae Sinensis had 11 active components, and 19 main active components were obtained by screening. 71 target genes shared by drugs and diseases were collected. Gene enrichment analysis showed that Danggui Buxue Decoction improves diabetic nephropathy through 21 pathways involving inflammatory response, apoptosis-autophagy pathway, hypoxic induction pathway, etc. Conclusion:Based on the network pharmacological method, this study revealed the multi-component, multi-target and multi-pathway effects of Danggui Buxue Decoction on the improvement of diabetic kidney disease through inflammatory response, autophagy-apoptosis pathway, hypoxia induction pathway and other pathways, providing more abundant information and basis for the subsequent experimental work.
Keywords Dangguibuxue Decoction; Radix Astragali seu Hedysari; Radix Angelicae Sinensis; DKD; Network pharmacology
中圖分类号:R285.6文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.15.008
随着人们生活水平的提高和生活饮食习惯的变化,糖尿病作为一种慢性非传染性的疾病,已经迅速地在全球蔓延开来。国际糖尿病联盟(International Diabetes Federation,IDF)发布的第九版全球糖尿病地图中显示,截至2019年,在20~79岁的人群中,共有约4.63亿糖尿病患者。其中中国糖尿病患者数排名第一,总人数约为1.164亿人[1]。糖尿病肾脏病(Diabetic Kidney Disease,DKD)是糖尿病导致的以微血管病变为主要特点的肾脏结构和功能的改变,是糖尿病常见且严重的并发症之一。现代医学尚无针对DKD的特效治疗方法,迫切需要利用中医药优势探索有效的治疗方法来延迟甚至逆转DKD的发生和发展。有证据表明中医药在改善DKD患者的临床症状和影响实验室指标方面优于一般疗法,并且在安全性方面罕有不良反应报道。具备多靶点、多途径作用特点的中药无疑值得进一步深入研究。
国医大师吕仁和教授提出“肾络癥瘕”学说,认为糖尿病的病理基础是热伤气阴,进一步发展为气虚血瘀,瘀阻肾络,最终形成肾络癥瘕[2]。气虚血瘀为消渴病肾病病理过程中重要因素,贯穿于本病始终。当归补血汤由中药黄芪和当归组成,出自李杲的《内外伤辨惑论》卷中:“治肌热,燥热,口渴引饮,目赤面红,昼夜不息,其脉洪大而虚,重按全无。”是补气生血的经典名方。其中黄芪、当归药对按照5∶1组方。方中黄芪补气健脾,以资气血生化之源,取“有形之血,不能自生,生于无形之气”之意。当归甘温质润,补血活血,养血和营。两药合用,益气生血,益气为主,补血次之,气血双补,气旺而血生。当归补血汤的化学主要成分为皂苷类、黄酮类、挥发油等[3]。现代药理研究表明,当归补血汤具有调节免疫、治疗血液病和抗肿瘤等作用[4]。临床研究表明当归补血汤治疗糖尿病肾病具有多方面的作用,如朱正新等[5]证实当归补血汤可以通过抑制肾组织TGF-β1的表达,发挥对糖尿病肾病的肾脏保护作用,帅瑜等[6]研究证实当归补血汤能下调高糖刺激下肾脏组织IRE1α-JNK通路的表达,减轻高糖刺激下肾脏细胞内质网应激,进一步保护肾脏组织,王秀萍等[7]当归补血汤可有效减少DN大鼠肾脏核因子κB、MCP-1的表达及活性,抑制肾脏炎症反应,减轻肾脏损伤。由此可见当归补血汤对于糖尿病肾病的调控是通过多组分、多靶点协同作用而发挥作用。
中药复方具有化学成分多样、调控机制复杂的特点,通过网络药理学技术,筛选出当归补血汤主要化学活性成分,探索其治疗DKD的相关靶点和通路,为后续开展当归补血汤治疗DKD的作用机制的实验工作提供了更丰富的信息和依据。
1 资料与方法
1.1 当归补血汤活性成分的收集和筛选
基于中药系统药理学数据库与分析平台(TCMSP,http://lsp nwu.edu.cn/tcmsp.php),以“黄芪”和“当归”为关键词检索当归补血汤所有化合物组分。按照生物利用度(Oral Bioavailability,OB)≥30%,类药性(Drug-Likeness,DL)≥0.18的筛选条件选取出当归补血汤主要活性成分[8-9]。
1.2 当归补血汤作用靶点的获取和成分-靶点网络的构建
利用TCMSP获取筛选后的当归补血汤活性成分的作用靶点。利用UniProt数据库(https://www.uniprot.org/)对上述靶点信息进行规范化处理,限定物种为人(Homo Sapiens),查找蛋白质的名称,通过基因名称-ID配对获取唯一的UniProt ID[10]。
1.3 DKD相关靶点的获取和疾病-靶点网络的构建
采用GeneCards数据库(https://www.genecards.org/)收集与DKD相关的靶点,在UniProt数据库中通过基因名称-ID配对获取上述靶点对应的UniProt ID。并运用Cytoscape软件构建DKD的疾病-靶点网络[11]。
1.4 成分靶点与疾病靶点共同靶点的获取
通过R软件中的Venn数据包将成分靶点与疾病靶点取交集得到共同靶点,这些共同靶点可能是当归补血汤治疗DKD的关键靶点[12]。
1.5 药物-活性成分-靶点-疾病的网络构建
运用Cytoscape软件构建药物-活性成分-靶点-疾病可视化网络图[13]。将获得的药物、药物的成分、关键的靶基因、疾病及它们之间的相互对应关系导入Cytoscape,通过Cytoscape插件Network Analyzer计算网络中节点的拓扑学特征,包括自由度(Degree)、介数(Betweenness)和中心性(Closeness)等,其中自由度值是较为重要的评价指标[14]。
1.6 蛋白质-蛋白质相互作用(Protein-Protein interaction,PPI)网络
通过公用数据库STRING(http://string-db.org)构建当归补血汤治疗糖尿病肾病关键PPI网络[15]。将物种设置為人(Homo Sapiens),最低阈值设置为0.400,其他参数默认。通过网站在线分析得到PPI图,将文件导入R软件,根据代码脚本计算每一个蛋白相应的拓扑参数值,根据每一蛋白的拓扑参数值排序筛选PPI网络中核心的靶蛋白。
1.7 关键靶点的富集分析
通过R语言软件包ClusterProfiler进行富集分析,采取超几何分布检验。通过基因本体(Gene Ontology,GO)富集分析和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析筛选出相关的生物学过程和信号通路[16]。
2 结果
2.1 筛选当归补血汤主要活性成分和靶点
共获得当归补血汤共有212个成分,其中87个属于黄芪,125个属于当归,通过OB值和DL值的筛选,得到黄芪主要活性成分20个,主要活性成分2个。中药中某些成分具有较好的药性,但是因为其口服生物利用度低或类药性差,容易被筛选过滤掉。因此,在相关文献研究的基础上,将黄芪皂苷I、黄芪皂苷Ⅱ、黄芪皂苷Ⅲ、黄芪皂苷Ⅳ、芒柄花苷以及毛蕊异黄酮苷加入到黄芪的活性成分中,阿魏酸和藁本内酯加入到当归的活性成分中,共纳入黄芪26个成分,当归4个[17-18]。通过TCMSP获取以上30个主要活性成分的相关靶点,导入UniProt经过配对后获得对应的ID并去除重复的靶点,获得100个相关靶点。在Cytoscape软件中构建这30个主要活性成分和100个靶点的“活性成分-靶点”网络。
2.2 获取与筛选当归补血汤治疗DKD靶点
通过检索GeneCards数据库获取3 645个与DKD相关的靶点基因。在UniProt数据库中通过基因名称-ID配对并去除重复后得到3 574个基因名称。通过R软件中的Venn数据包将成分100个靶点基因与疾病3 574个靶点基因取交集,获得71个当归补血汤治疗DKD的作用靶点。见图1。
2.3 构建药物-活性成分-靶点-疾病网络
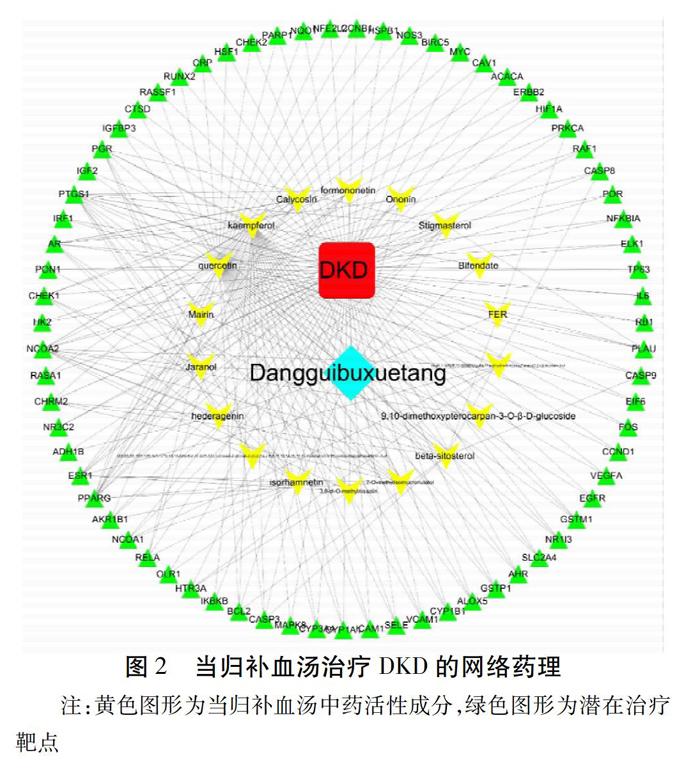
运用Cytoscape 3.7.1软件构建当归补血汤治疗DKD药物-活性成分-靶点-疾病网络可视化图,经Network Analyzer分析,筛选出主要当归补血汤主要成分18个,有12个化合物无对应靶点,靶基因71个。网络具有91个节点(71个为靶点节点,18个为成分节点,1个为疾病,1个为药物),248条边(成分-靶点159条,药物-成分18条,疾病-靶点71条)。从药物的成分看,靶点数量最多的槲皮素(Quercetin)有62个,其次为山柰酚(Kaempferol)有25个潜在靶点,异鼠李素(Isorhamnetin)11个,7-O-甲基-异微凸剑叶莎醇(7-O-methylisomucronulatol)8个,豆甾醇(Stigmasterol)9个,芒柄花素(Formononetin)7个等。从关键基因看,PTGS1基因受到15个活性成分的调控,NCOA2 13个,PPARG 11个,AR 9个,ESR1 8个,PGR 7个。见表1。当归补血汤可能通过作用于这些靶点从而达到治疗DKD的作用。见图2。
2.4 构建PPI网络
得到当归补血汤治疗DKD的靶标蛋白共661个,每个靶标有对应的关联度。见图3。获取其中关联度最高的前30个蛋白,其中涉及糖尿病相关靶标蛋白有IL-6、CAPS3、EGFR、VEGF-A、MAPK8、MYC、RELA、HIF-A、NOS3、ICAM1、NF-KB1A、VCAM1等。以横坐标为关联度,纵坐标为靶蛋白,得到关键蛋白柱形图。见图4。
2.5 关键靶点的富集分析
将当归补血汤治疗DKD的71个作用靶点基因導入R软件,并引用Colorspace,Stringi,以及Bioconductor库中的DOSE,ClusterProfiler,Pathview语言包进行富集分析,具体GO富集分析显示P<0.05的结果共79条,涉及DNA结合转录激活剂活性,RNA聚合酶Ⅱ特异性、近端启动子序列特异性DNA结合、RNA聚合酶Ⅱ近端启动子序列特异性DNA结合等。见图5。其中P值由小到大排列,排名前20条富集结果见表2。KEGG通路富集分析提示P<0.05的信号通路共176条。见图6。在相关文献检索基础上,除外一些细胞中固有通路及肿瘤相关通路,其中与DKD相关的通路前21条,主要涉及炎症过程、氧气调节和凋亡-自噬调节。见表3。
3 讨论
当归补血汤由黄芪和当归组成,主要作用为“补气生血”,现代医家应用于治疗多个系统疾病,临床上也是治疗DKD的常见组方。在本研究中,我们通过网络药理学分析,确定了当归补血汤(黄芪、当归)对应30个关键活性组分。这30个关键成分可能作用于DKD的71个靶基因,通过PPI网络分析发现IL-6、CASP3、EGFR、VEGFA、MAPK8、MYC、ESR1、CCND1、FOS、ERBB2、AR、PPARG、P65、CASP8、PGR、HIF等属于PPI网络的中枢蛋白,可能发挥了关键的作用。此外,通过GO和KEGG富集,发现流体剪切应力与动脉粥样硬化、AGE-RAGE、细胞凋亡、TNF、P53、MAPK、HIF-1、内分泌抵抗、PI3K-AKT、凋亡-多种、细胞衰老、IL-17、松弛素、核因子κB、Th17细胞分化、Ras、EGFR酪氨酸激酶抑制剂受体、ErbB、VEGF、Toll样受体、胰岛素抵抗、T细胞受体、甲状旁腺激素、2型糖尿病、Th1和Th2细胞分化、JAK-STAT、自噬-动物、线粒体-动物、AMPK等信号通路在其中发挥了至关重要的作用,主要涉及炎症、氧调节和凋亡调节等生物学过程。
从“药物-活性成分-靶点-疾病”网络可以看出,当归补血汤中的槲皮素(Quercetin)、山柰酚(Kaempferol)、异鼠李素(Isorhamnetin)作用靶点数目最多,说明了这几个化合物发挥了主要的作用。据报道,槲皮素通过减少细胞内ROS的产生和线粒体功能障碍从而降低氧化应激并且通过减少IL-1α、IL-6、IL-8、TNF-α等炎症介质产生从而发挥抗炎作用[19]。山梨醇通过减轻LPS的毒性作用,抑制了ERK、P38和JNK途径,抑制炎症介质核因子κB的激活,黏附分子的表达从而发挥其抗炎作用。另有相关研究表明,异鼠李素明显降低TNF-α、IL-1β和IL-6浓度,抑制核因子κB信号激活。由此可见,当归补血汤的活性成分从多角度发挥治疗DKD作用[20]。
根据富集的结果,我们将从涉及炎症反应、自噬-凋亡通路和低氧诱导通路3个方面分析当归补血汤治疗DKD的作用机制。
在糖尿病肾脏中,高糖、糖基化终产物(AGEs)和氧化应激激活各种信号传导级联反应,诱导炎性细胞浸润、炎症介质表达增加,以促进炎症介质在糖尿病患者中促进肾脏损害。AGEs结合AGE受体(RAGE)激活一系列信号通路,包括MAPK、JAK/STAT、Caspase-3/7等通路,进一步产生黏附分子和炎症介质、加强炎症反应,促进DKD炎症的进展[21]。丝裂原激活的蛋白激酶(MAPK)可以激活核因子κB从而导致炎症基因的表达增加,核因子κB的下游靶点包括IL-6、TNF-α、MCP1等黏附分子和炎症介质,这些因子均促进DKD的发展[22]。TNF-α是非常重要的炎症介质,在DKD模型的肾小球和近端肾小管上皮细胞TNF的表达水平升高。JAK-STAT信号在肾细胞中也起着关键作用。研究表明,在DKD患者的肾脏组织中,高血糖状态引起的系膜細胞、足细胞和肾小管上皮细胞ROS激活,从而导致JAK-STAT信号被激活,从而减轻内皮细胞的炎症反应[23]。此外,VCAM1和ICAM1的循环水平与DKD进展独立相关,另外T细胞在细胞黏附分子ICAM-1作用下进入肾内皮细胞,上皮细胞,和系膜细胞等促进炎症反应的发生[24]。
自噬是一种生理反应,通过溶酶体和自噬小体的结合降解多余蛋白质、有缺陷的细胞器和可溶性分子[25]。在饥饿、衰老、细胞生长控制、肿瘤抑制、缺氧、能量消耗等条件下,通过氨基酸和必需细胞代谢物的循环以保持细胞能量和物质的供应从而使细胞成活。凋亡是细胞程序性死亡的过程,半胱氨酸蛋白酶Caspase家族是细胞凋亡的主要调节因子[26]。自噬和凋亡密切相关,自噬不足和自噬过度都会导致细胞的凋亡,细胞内溶酶体降解过程在DKD足细胞稳态中起关键作用。自噬作用在维持溶酶体的均匀性和阻断自噬诱导作用中也起着关键作用,若自噬不足可导致大量的溶酶体积聚,进一步导致DKD中足细胞凋亡[27]。另有研究表明,溶酶体功能激活自噬可能有助于DKD新的治疗策略的发展[28]。
近年的研究表明,低氧诱导因子通路在DKD的发生发展中至关重要。在正常细胞内,低氧诱导因子不断被表达和降解[29]。在正常氧气浓度情况下,氧气进入组织细胞,和低氧诱导因子结合使其羟化,低氧诱导因子羟化酶可以识别和氧结合后的低氧诱导因子,从而使其降解。在低氧浓度下,低氧诱导因子无法正常羟化,从而不能使低氧诱导因子羟化酶识别,从而不能被降解。研究表明,2型糖尿病大鼠近端肾小管细胞HIF-1α表达增加[30],DKD患者的肾组织高血糖引起肾小球高滤过,通过SGLT增加肾小管钠和葡萄糖的再吸收,从而提高钠钾ATP酶的活性,从而增加氧耗[31]。另外肾脏自身存在一种抗氧化防御机制以维持输送到肾实质的氧气的恒定,因此糖尿病肾近端肾小管细胞处于慢性缺氧状态,低氧诱导因子(HIF-1a)在组织内含量上升[32-33]。分别通过靶向诱导VEGF-A促进组织内血管形成。但是,VEGF-A也会通过激活酪氨酸激酶受体调节血管内皮细胞的增殖和迁移,增强血管通透性,从而导致早期超滤,是DKD蛋白尿的形成原因之一[34]。另外,肾小管细胞缺氧状态可使肾小管上皮细胞HIF-1α的稳定表达导致肾小管间质纤维化引起糖尿病肾纤维化[35]。
中药复方由具有多成分、多靶点的特点,中药活性成分对于疾病靶点的调控可能存在相互作用,因此中药复方治疗疾病的作用机制难以阐明。网络药理学是通过相关数据库查找中药活性成分、成分靶点、疾病靶点,进一步构建网络,系统地展示药物和疾病之间的相互作用关系,进一步挖掘中药复方治疗疾病的作用机制。我们运用网络药理学的技术,探索当归补血汤治疗DKD的作用机制,可以为今后相关的实验研究提供了一定的思路。
参考文献
[1]International Diabetes Federation.IDF Diabetes Atlas,9th ed[C].Brussels,Belgium:International Diabetes Federation,2019.
[2]刘尚建,刘玉宁,沈存,等.肾络癥瘕聚散理论的三态四期初探[J].中国中西医结合肾病杂志,2015,16(4):350-351.
[3]靳如娜,齐晓甜,孙蓉,等.经典名方当归补血汤的药效物质基础和质量控制研究进展[J].中国实验方剂学杂志,2019,25(16):220-228.
[4]周二付.当归补血汤药理实验研究进展[J].中医临床研究,2016,8(3):137-138.
[5]朱正新,刘朝圣,郑毅春,等.当归补血汤对糖尿病肾病大鼠肾组织TGF-β1表达影响的实验研究[J].中国中医药科技,2018,25(3):339-340,343.
[6]帅瑜,张思泉,沈鑫,等.当归补血汤对糖尿病大鼠肾组织内质网IRE1α-JNK通路的抑制作用[J].中华中医药学刊,2018,36(6):24.
[7]王秀萍,任小旦,张莹雯.当归补血汤对糖尿病大鼠肾组织NF-κB、MCP-1表达的影响[J].天津中医药大学学报,2016,35(3):167-172.
[8]解晶,李丰,石彬彬,等.系统药理学:TCMSP解析中医基础理论研究进展[J].世界中医药,2019,14(10):2627-2635.
[9]Tao W,Xu X,Wang X,et al.Network pharmacology-based prediction of the active ingredients and potential targets of Chinese herbal Radix Curcumae formula for application to cardiovascular disease[J].J Ethnopharmacol,2013,145(1):1-10.
[10]罗静初.UniProt蛋白质数据库简介[J].生物信息学,2019,17(3):131-144.
[11]Fishilevich S,Nudel R,Rappaport N,et al.GeneHancer:genome-wide integration of enhancers and target genes in GeneCards[J].Database(Oxford),2017,2017:28.
[12]Hur B,Kang D,Lee S,et al.Venn-diaNet:venn diagram based network propagation analysis framework for comparing multiple biological experiments[J].BMC Bioinformatics,2019,20(Suppl 23):667.
[13]Shannon P,Markiel A,Ozier O,et al.Cytoscape:a software environment for integrated models of biomolecular interaction networks[J].Genome Res,2003,13(11):2498-2504.
[14]Ge Q,Chen L,Tang M,et al.Analysis of mulberry leaf components in the treatment of diabetes using network pharmacology[J].Eur J Pharmacol,2018,833:50-62.
[15]Szklarczyk D,Morris JH,Cook H,et al.The STRING database in 2017:quality-controlled protein-protein association networks,made broadly accessible[J].Nucleic Acids Res,2017,45(D1):D362-362D368.
[16]Yu G,Wang LG,Han Y,et al.clusterProfiler:an R package for comparing biological themes among gene clusters[J].OMICS,2012,16(5):284-287.
[17]黃红泓,覃日宏,柳贤福.中药当归的化学成分分析与药理作用探究[J].世界最新医学信息文摘(连续型电子期刊),2019,19(58):127,153.
[18]薛倩倩,刘晓节,李科,等.黄芪药材化学成分差异的研究进展[J].山西医科大学学报,2018,49(10):1259-1263.
[19]Chow JM,Shen SC,Huan SK,et al.Quercetin,but not rutin and quercitrin,prevention of H2O2-induced apoptosis via anti-oxidant activity and heme oxygenase 1 gene expression in macrophages[J].Biochem Pharmacol,2005,69(12):1839-1851.
[20]Mahat MY,Kulkarni NM,Vishwakarma SL,et al.Modulation of the cyclooxygenase pathway via inhibition of nitric oxide production contributes to the anti-inflammatory activity of kaempferol[J].Eur J Pharmacol.2010,642(1-3):169-176.
[21]Batkulwar KB,Bansode SB,Patil GV,et al.Investigation of phosphoproteome in RAGE signaling[J].Proteomics,2015,15(2-3):245-259.
[22]Pérez-Morales RE,Del Pino MD,Valdivielso JM,et al.Inflammation in Diabetic Kidney Disease[J].Nephron,2019,143(1):12-16.
[23]Tuttle KR,Brosius FC 3rd,Adler SG,et al.JAK1/JAK2 inhibition by baricitinib in diabetic kidney disease:results from a Phase 2 randomized controlled clinical trial[J].Nephrol Dial Transplant,2018,33(11):1950-1959.
[24]Hojs R,Ekart R,Bevc S,et al.Markers of Inflammation and Oxidative Stress in the Development and Progression of Renal Disease in Diabetic Patients[J].Nephron,2016,133(3):159-162.
[25]Levine B,Kroemer G.Autophagy in the pathogenesis of disease[J].Cell,2008,132(1):27-42.
[26]Ramirez M,Salvesen GS.A primer on caspase mechanisms[J].Semin Cell Dev Biol,2018,82:79-85.
[27]Tagawa A,Yasuda M,Kume S,et al.Impaired Podocyte Autophagy Exacerbates Proteinuria in Diabetic Nephropathy[J].Diabetes,2016,65(3):755-767.
[28]Liu WJ,Gan Y,Huang WF,et al.Lysosome restoration to activate podocyte autophagy:a new therapeutic strategy for diabetic kidney disease[J].Cell Death Dis,2019,10(11):806.
[29]Rosenberger C,Khamaisi M,Abassi Z,et al.Adaptation to hypoxia in the diabetic rat kidney[J].Kidney Int,2008,73(1):34-42.
[30]Blantz RC.Phenotypic characteristics of diabetic kidney involvement[J].Kidney Int,2014,86(1):7-9.
[31]Jerums G,Premaratne E,Panagiotopoulos S,et al.The clinical significance of hyperfiltration in diabetes[J].Diabetologia,2010,53(10):2093-2104.
[32]O′Connor PM,Evans RG.Structural antioxidant defense mechanisms in the mammalian and nonmammalian kidney:different solutions to the same problem?[J].Am J Physiol Regul Integr Comp Physiol,2010,299(3):R723-727.
[33]Takiyama Y,Haneda M.Hypoxia in diabetic kidneys[J].Biomed Res Int,2014,2014:837421.
[34]Luo L,Luo G,Fang Q,et al.Stable expression of hypoxia-inducible factor-1α in human renal proximal tubular epithelial cells promotes epithelial to mesenchymal transition[J].Transplant Proc,2014,46(1):130-134.
[35]Nangaku M.Hypoxia and tubulointerstitial injury:a final common pathway to end-stage renal failure[J].Nephron Exp Nephrol,2004,98(1):e8-12.
(2020-07-28收稿 責任编辑:魏庆双,徐颖)
基金项目:国家自然科学基金项目(81774278);国家自然科学基金项目(81774298)
作者简介:艾思南(1995.02—),男,硕士研究生在读,研究方向:中医药防治肾脏病,E-mail:aisinan223@163.com
通信作者:王耀献(1966.02—),男,博士,主任医师,研究方向:中医药防治肾脏病,E-mail:wyx3203@sina.com;刘伟敬(1977.02—),男,博士,主任医师,研究方向:中西医结合治疗肾脏病及糖尿病,E-mail:liuweijing-1977@hotmail.com
