不同治疗手段对骨髓增生异常综合征的临床疗效研究 及相关因素分析
2021-09-15武琳琳江慧敏李玲玲
武琳琳,江慧敏,李玲玲,许 力
(安徽省第二人民医院血液内科,合肥 230041)
骨髓增生异常综合征(myelodysplastic syndromes,MDS)是一类造血干细胞出现异质性的恶性克隆性疾病,临床表现为无效造血、难治性血细胞减少以及高风险转化为急性髓系白血病(acute myeloid leukemia,AML)。MDS患者常用的危险分层系统包括国际预后积分系统(IPSS)、WHO分型预后积分系统(WPSS)及修订国际预后积分系统(IRSS-R)[1-2]。MDS患者的自然病程及预后评估各有不同,需依据不同分型对患者进行个体化治疗。目前已有多种治疗手段可用于治疗MDS,已被报道的有支持治疗、免疫调节剂治疗、免疫抑制剂治疗、去甲基化药物治疗、传统化疗及干细胞移植等[3-5]。本研究选取中高危MDS患者,比较去甲基化药物和支持治疗两种治疗手段的临床疗效。去甲基化药物一般使用地西他滨和阿扎胞苷,支持治疗包括复方皂矾丸、环孢素、维A酸、促红素、重组人血小板生成素等。本次研究仅讨论接受去甲基化药物(地西他滨、阿扎胞苷)和支持治疗(复方皂矾丸、环孢素)中高危MDS患者的临床疗效,并根据靶向测序结果分析TET2基因、ASXL1基因突变是否对治疗手段的临床疗效有一定的因素影响。
1 资料与方法
1.1 临床资料本次研究选取本院2015年12月~2020年8月经骨髓穿刺涂片、骨髓活检病理及染色体核型分析确诊为MDS的66例患者,且预后分组为中高危组。患者临床诊断标准参照《骨髓增生异常综合征中国诊断与治疗指南(2019年版)》[6],根据患者分型及预后分组确定不同治疗方案,将纳入患者分为去甲基化药物组43例和支持治疗组23例。去甲基化药物组包括地西他滨组30例和阿扎胞苷组13例,支持治疗组包括复方皂矾丸组12例和环孢素组11例。
1.2 纳入与排除标准纳入标准:(1)依据MDS诊断标准确诊为原发性MDS患者;(2)国际预后积分系统(IPSS)危险程度≥1.5分患者;(3)WHO分型预后积分系统(WPSS)危险程度≥2分患者;(4)修订国际预后积分系统(IPSS-R)>3分患者。排除标准:(1)合并重要器官严重异常及恶性肿瘤患者;(2)伴有严重心脑血管疾病病史及精神病患者;(3)研究使用药物过敏体质患者。患者本人及家属均签署知情同意书。本项研究已获得本院伦理委员会批准。
1.3 治疗方法地西他滨组患者采用静脉滴注地西他滨注射剂20mg/m2(正大天晴药业集团,规格25mg,国药准字H20143382),连续给药5d,每4周为1个疗程。阿扎胞苷组患者采用皮下给药注射用阿扎胞苷100mg/m2(维达莎,百济神州,规格100mg,国药准字H20170238),连续给药7d,每4周为1个疗程。复方皂矾丸组患者口服复方皂矾丸9丸/次(陕西郝其军制药股份有限公司,规格0.2 g/丸,产品批号140412),3次/d,连续服用7d,每4周为1个疗程。环孢素组患者采用口服给药,100mg/d,连续给药5d,每2周为1个疗程。各组患者均连续治疗6个疗程。
1.4 观察指标及随访治疗前抽取去甲基化药物组患者骨髓液4mL,使用Snanger测序法检测 DNA/RNA试剂盒检测TET2基因、ASXL1基因[7]。同时将患者骨髓细胞经培养后行染色体核型分析染色体核型分析。各组患者完成治疗疗程后进行临床疗效评估,分为完全缓解(CR,患者血常规检查结果显示骨髓细胞水平基本恢复正常,外周血原始细胞为0,持续至少8周以上),部分缓解(PR,患者骨髓原始细胞较治疗前减少50%及以上,外周血绝对值必须持续至少8周以上),稳定(SD,患者骨髓原始细胞较治疗前减少低于50%,无疾病进展),进展(PD,患者各项指标均无改善,病情进一步加重),统计并计算总缓解率ORR(总有效缓解率=(CR例数+PR例数)/该组病例数*100%)。对患者进行6个月的随访观察,随访指标包括总生存率,转化为急性髓细胞白血病(AML)率及不良反应(包括骨髓抑制、感染、出血、胃肠道反应)总发生率。
1.5 统计学处理数据均采用SPSS 23.0软件进行统计分析,计量资料以均数±标准差表示,组间比较采用t检验;计数资料以率(%)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组患者一般资料比较各组患者的年龄、中性粒细胞计数、 白细胞计数、血小板计数及血红蛋白水平总体比较差异无统计学意义(P>0.05)。见表1。
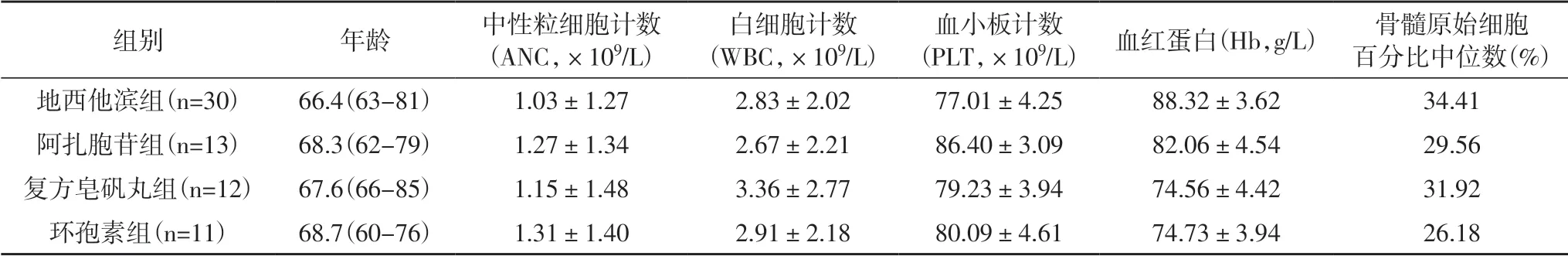
表1 患者一般资料
2.2 各组患者总缓解率比较去甲基化药物组与支持治疗组的临床疗效对比,去甲基化药物组总缓解率高于支持治疗组(P<0.05)。地西他滨组患者接受治疗后完全缓解(CR)15例,部分缓解(PR)5例,总缓解率(ORR)为66.7%;阿扎胞苷组患者接受治疗后CR 4例,PR 3例,ORR 为53.8%。复方皂矾丸组患者接受治疗后CR 3例,PR 1例,ORR为33.3%;环孢素组患者接受治疗后CR 2例,PR 1例,ORR 为27.3%。见表2。
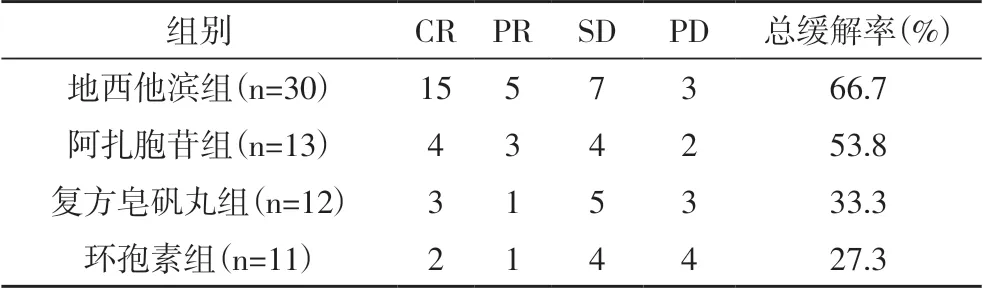
表2 治疗后各组患者临床疗效比较
2.3 接受去甲基化药物治疗组中伴有TET2基因、ASXL1基因突变患者临床疗效对比去甲基化药物治疗组43例患者中,通过靶向测序检测到伴有TET2基因患者8例,ASXL1患者6例,其他基因突变患者4例,无基因突变者25例。伴有TET2基因患者在接受治疗后,CR 5例,PR 2例,ORR为87.5%;伴有ASXL1基因的患者在接受治疗后,CR 2例,PR 1例,ORR为50.0%;无基因突变患者在接受治疗后,CR 10例,PR 4例,ORR 为56.0%。TET2基因突变组的总缓解率明显高于无基因突变组,有统计学意义(P<0.05)。ASXL1基因突变组的总缓解率同无基因突变组比较无明显差异。见表3。

表3 基因突变组患者临床疗效比较
2.4 各组患者随访期内总生存率、转化AML率及不良反应发生率比较6个月的随访期内,去甲基化药物组患者和支持治疗组患者的总生存率无统计学意义(P>0.05)。去甲基化药物组患者的转化AML率明显低于支持治疗组患者,具有统计学意义(P<0.05)。去甲基化药物组和支持治疗组的不良反应总发生率无统计学意义(P>0.05)。见表4。

表4 各组患者随访期内各项指标比较
3 讨论
本研究选取预后分层为中高危组的患者分为去甲基化药物组(地西他滨和阿扎胞苷)和支持治疗组(复方皂矾丸和环孢素)。地西他滨和阿扎胞苷作为常用的去甲基化药物,已有不少报道研究其对高危MDS的疗效。地西他滨作为一种作用于DNA的抑制剂药物,其作用原理为体内阻断甲基化起到治疗效果[8]。另一种常用的去甲基化药物阿扎胞苷,有研究报道地西他滨和阿扎胞苷联合HAAG治疗方案的临床有效率相近[9]。本次研究结果也表明二者总体有效率接近,地西他滨组和阿扎胞苷组患者接受治疗后总体CR、PR、ORR发生率接近,且二者随访期内的OS指标及转化AML率无显著性差异。张稚淳等研究报道了复方皂矾丸联合西药治疗MDS疗效优于单用西药治疗,且临床安全性较好[10]。环孢素作为一种免疫抑制剂在治疗MDS表现出一定疗效[11]。本研究结果显示,去甲基化药物治疗中高危MDS患者疗效优于支持治疗组,并可降低患者转化为AML风险。
目前MDS患者的基因突变情况同临床疗效之间是否存在相关性引起了广泛的关注。傅煜等[12]分析了288例确诊及疑似MDS患者的基因突变谱系,证实ASXL1和TET2等5种基因突变是MDS患者中最为常见检测到的。杨宇娟等研究发现地西他滨治疗DNMT3A、TET2基因突变的老年MDS患者的临床疗效优于无基因突变患者,药物使用后可有效抑制DNMT3A、TET2基因表达[13]。本研究对比了TET2基因、ASXL1基因突变患者接受不同去甲基化药物的病情改善效果,结果表明二者去甲基化药物均可抑制TET2基因、ASXL1基因表达,但二者结果比较无统计学意义。本研究结果显示ASXL1突变组与无基因突变组ORR无明显差异,原因可能是本次研究ASXL1患者病例数较少,导致对比结果存在偏差。去甲基化药物是否抑制ASXL1突变基因表达从而达到较好的治疗效果,还需扩大病例数有待进一步研究。
综上,去甲基化药物和支持治疗在治疗中高危组MDS患者均表现出一定的临床疗效,去甲基化药物治疗可有效降低MDS患者转化为AML的风险,控制患者病情。本研究结果为中高危MDS患者提供了不同治疗方案比较的经验。
