LncRNA-H19通过抑制miR-185-5p的表达促进成骨细胞的增殖
2021-09-15刘翠中
李 峰,刘翠中,伍 媛
(湖南师范大学第一附属医院/湖南省人民医院全科医学科,长沙 410005)
骨是由成骨细胞和破骨细胞动态调节的器官,它们在骨转换中起着重要的调节作用[1]。成骨细胞的主要功能是骨形成,而破骨细胞的主要功能是骨吸收[2]。成骨细胞和破骨细胞功能失衡导致多种骨代谢疾病,包括骨质疏松症[3]。骨质疏松通常伴随着成骨细胞的增殖分化功能下降,骨质流失等。成骨细胞诱导的骨形成在骨转换中起着至关重要的作用[4]。在骨重建过程中,一系列骨转换的标志物被释放出来[5]。越来越多的研究表明,诱导成骨细胞增殖是治疗骨疾病的重要策略。因此,揭示成骨细胞对增殖、凋亡和分化的调控机制具有重要意义。长非编码rna(long non-codingrnas,lncRNAs)是一种长度超过200个核苷酸的非编码rna(ncRNAs)。大量研究表明,lncRNAs在许多疾病中异常表达。它们能调节细胞增殖、凋亡和分化等关键过程,被认为是骨关节炎的新生物学标志物[6]。LNNA可能参与了成骨细胞的生长过程。然而,lncrna H19在成骨细胞表达变化的临床意义却鲜有报道。
miR-185-5p属于非编码的RNA分子,介导转录后基因的表达。先前的研究表明miR-185-5p受H19调控影响MC3T3-E1成骨细胞的分化。然而,miR-185-5p在成骨分化细胞中增殖的潜在调控机制尚不清楚。本文进一步探讨了lncRNA H19通过影响miR-185-5p表达对MC3T3-E1成骨细胞增殖的调控机制。
1 材料与方法
1.1 细胞培养研究用小鼠MC3T3-E1细胞购自上海创新生物技术有限公司(中国上海)。所有细胞在在5%的增湿空气中,以α-最小必需培养基(α-MEM;美国Invitrogen),1%青霉素(100 U/mL,Gibco),链霉素(100μg/mL链霉素,Gibco)在37°C和5%CO2条件下培养。然后,诱导MC3T3-E1细胞分化。对于miR-185-5P的表达抑制:miR-185-5p inhibitor(anti-miR-185-5p)和阴性对照(miRNC和anti-miR-NC)购自Ribobio(中国广州)。用脂质体3000(Invitrogen)导入MC3T3-E1细胞。转染后48小时,收集MC3T3-E1细胞进行进一步分析。
1.2 增殖活性检测用CCK-8试剂(DOJINDO,Kumamoto,Japan)观察细胞增殖活性。用特殊质粒或寡核苷酸处理的MC3T3-E1细胞在96孔板上培养,然后继续培养24h。每个孔加入10μL CCK-8溶液继续培养4 h。通过在微型板分光光度计(BioTek Instruments,Winooski,VT,USA)检测每个孔450 nm波长下的光密度,记录MC3T3-E1细胞的增殖活性。
1.3 western-blot法分离的蛋白质被印迹在膜上(聚偏二氟乙烯;美国马萨诸塞州贝德福德的milipore)。然后,在封闭1h后,用独特的一级抗体在4℃下孵育过夜。第二天,用相应的次级抗体与一级抗体结合,并结合信号通过添加增强化学发光试剂盒(milipore)的试剂出现。抗增殖相关抗原(PCNA,ab92552,1:1000,Abcam),ki67(OCN,1:1000,Abcam),GAPDH(ab9485,1:2500,Abcam)和山羊抗兔二级抗体(ab205718,1:5000,Abcam)用于本研究。
1.4 实时荧光定量PCR(RT-PCR)MC3T3-E1细胞的总RNA通过TRIzol试剂(Invitrogen,USA)提取。用引物脚本一步法RT-PCR试剂盒(Takara,Japan)或miRNA逆转录试剂盒(GeneCopoeia,Guangzhou)合成LncRNA-H19或miR-185-5p的第一链互补DNA,用SYBR预混合二聚体清除试剂盒(Takara)检测LncRNA-H19、miR-185-5p的水平。用2-ΔΔCt法计算miR-185-5p和RNA-H19的表达水平,并以甘油醛-3-磷酸脱氢酶(GAPDH)作为内部对照。
1.5 双荧光素酶报告分析用starbasev3.0预测了miR-185-5p与H19的3' 非翻译区(UTR)的相互作用(http://starbase.sysu.edu.cn/),合成了包含miR-185-5p潜在结合位点的H19序列片段,并将其嵌入载体中(美国威斯康星州麦迪逊市普罗梅加),分别命名为wt-H19与mut-H19。随后,将MC3T3-E1细胞与miR-185-5p或miR-NC与lipofectamine3000(Invitrogen)共同转染并在培养基中继续培养48h后,按照说明书的指示,用双荧光素酶报告试剂盒(Promega)分析荧光素酶活性。
1.6 数据分析每项实验至少重复3次,实验数据结果用mean±SD表示。运用SPSS 22.0软件,对每次试验三个独立的数据进行统计分析(α=0.05)。两组间差异性分析采用t检验。3组及以上组间差异分析采用单因素方差分析(ANOVA),2组间差异性比较采用Student’st检验.。P<0.05认为差异具有统计学意义。
2 结果
2.1 干扰H19对MC3T3-E1细胞增殖的影响对MC3T3-E1细胞进行瞬时转染shRNA,沉默H19的表达,将MC3T3-E1细胞分为sh-NC组与sh-H19组。qRT-PCR检测分析H-19的相对表达水平,结果显示:与对照组相比,sh-H19组H19的表达显著降低(P<0.05)(图1)。ccK8检测细胞的增殖活性,结果显示:与对照组相比,sh-H19组MC3T3-E1细胞增殖活性显著降低(P<0.05)(图1)。细胞内ki67蛋白反应细胞的增殖情况,westerton-blot检测,结果显示:与对照组相比,sh-H19组ki67表达水平显著降低(P<0.05)(图1,C-D)。
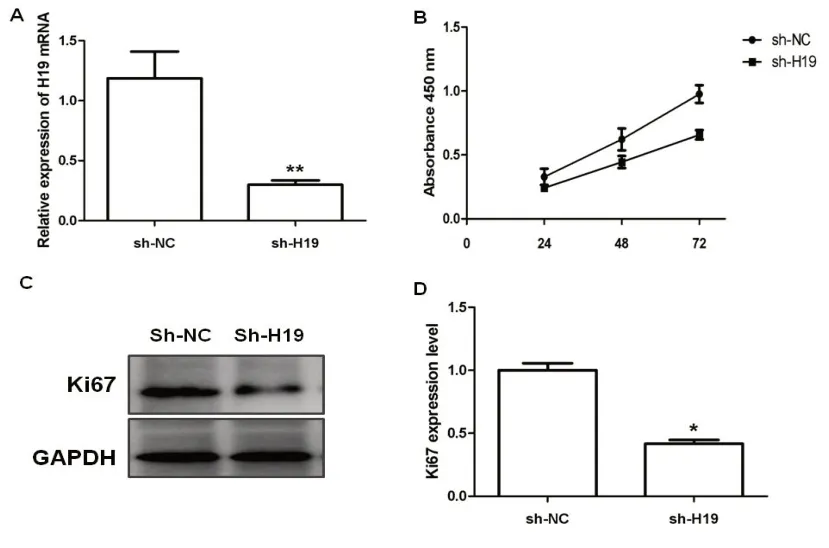
图1 沉默LncRNA H19降低MC3T3-E1细胞增殖活性和ki67蛋白表达
2.2 干扰H19对AKT磷酸化的影响成骨细胞增殖受AKT磷酸化调控,为了探讨MC3T3-E1细胞中LncRNA H19对AKT磷酸化表达的影响,western blot检测结果显示:sh-H19组P-AKT表达水平显著降低(P<0.05)(图2,A-B)。

图2 Western blot检测sh-H19对P-AKT的表达的影响
2.3 LncRNA H19对MC3T3-E1细胞中miR-185-5p表达的影响为了探讨MC3T3-E1细胞中LncRNA H19对miR-185-5p的表达的影响,运用生物学技术对LncRNA H19对miR-185-5p的序列进行预测,预测显示:LncRNA H19与miR-185-5p序列虽然存在高度差异,但是二者之间也存在序列互补性,即二者之间可能存在一定的靶向关系(图3,A)。沉默MC3T3-E1细胞中H19表达,qRT-PCR检测分析显示:MC3T3-E1细胞内sh-H19组miR-185-5p的表达水平显著降低(P<0.05),即LncRNA H19对miR-185-5p的表达呈负调控(图3,B)。进一步验证二者之间的相互作用,荧光素酶报告试验显示:野生型H19结合miR-185-5p组的荧光活性显著低于H 19突变型结合miR-185-5p组(P<0.05)(图3,C)。

图3 qRT-PCR检测LncRNA H19对miR-185-5p表达的影响
2.4 sh-H19 转染与miR-185-5p过表达对MC3T3-E1细胞中P-AKT表达的影响瞬时转染sh-RNA及添加miR-185-5p抑制剂后,western blot检测结果表明:miR-185-5p抑制剂组与miR-185-5p抑制剂+vector组的P-AKT表达水平跟对照组相比显著增高(P<0.05),miR-185-5p抑制剂+ sh-H19组的P-AKT表达水平跟对照组相比差异无统计学意义(P>0.05)(图4)。

图4 Western blot检测sh H19及miR-185-5p抑制剂对P-AKT表达的影响
2.5 sh-H19 转染及添加miR-185-5p抑制剂对MC3T3-E1细胞增殖的影响瞬时转染sh-RNA及添加miR-185-5p抑制剂后,qRT-PCR检测结果表明:miR-185-5p抑制剂组与miR-185-5p抑制剂+vector组的miR-185-5p表达水平显著降低(P<0.05),miR-185-5p抑制剂+ sh-H19组的miR-185-5p表达水平与miR-185-5p抑制剂组相比显著升高(P<0.05)(图5,A)。添加miR-185-5p抑制剂检测细胞增殖活性,结果显示:抑制miR-185-5p表达MC3T3-E1细胞增殖活性显著增加,miR-185-5p抑制剂+ sh-H19组细胞增殖活性miR-185-5p抑制剂组相比,显著降低(P<0.05)(图5,B)。Western blot法检测MC3T3-E1细胞中调控增殖的蛋白ki67表达变化,结果显示:miR-185-5p抑制剂组与miR-185-5p抑制剂+vector组与对照组相比ki67表达增高(P<0.05);miR-185-5p抑制剂+ sh-H19组与对照组相比ki67表达无差异(P>0.05)(图5,C)。

图5 CCK8,western blot法检测 sh H19及miR-185-5p抑制剂对增殖活性的影响
3 讨论
骨折是一种常见的疾病,由创伤引起,并伴有骨脆性。在美国,每年大约有600万成年人患有骨折[7]。骨折的愈合是一个复杂的生理过程,涉及生物和机械因素。成骨细胞是间充质细胞,负责骨基质的合成、分泌和矿化[8,9]。因此,揭示成骨细胞对增殖、凋亡和分化的调控机制具有重要意义。本研究发现:抑制LncRNA H19会抑制AKT的磷酸化,进而抑制成骨细胞的增殖。这对我们骨的增殖分化提供了新的临床思路。
长非编码rna(long non-coding RNAs,LncRNAs)是一种长度超过200个核苷酸,不编码任何蛋白质的rna,在多功能水平上调节基因表达。某些lncRNAs已被广泛用于不同疾病的诊断和治疗,具有潜在和临床实用价值[10]。先前的一项研究表明,lncRNAs可广泛存在于癌症和某些特定非肿瘤性疾病的血液样本(血浆或血清)中[11]。这为探索疾病的发病机制提供了一个新的方向。近年来,许多lncRNAs已被确认并被证明在各种疾病中发挥着重要作用,包括心血管系统疾病[12]、哮喘[13]、急性肾损伤[10]、糖尿病和骨质疏松[14]。LncRNAs在骨代谢中起重要作用,参与骨代谢的发育和转化,尤其是对成骨细胞增殖的调节中[15]。有研究表明,LncRNA H19可以通过激活Wnt信号来促进成骨分化,也可以通过粘着斑激酶(FAK)介导机械张力诱导的成骨作用[16]。我们的研究也发现,H19可以通过促进AKT磷酸化促进成骨细胞增殖。然而,H19在分化成骨细胞中的潜在作用有待进一步扩大研究。
MicroRNAs(miRNAs)是一种小的、非编码的RNA分子,介导转录后基因的表达。此外,miRNAs参与多种细胞过程[17]。越来越多的证据表明,一些miRNAs调节软骨细胞、成骨细胞和破骨细胞的分化过程[18]。这些发现表明miRNAs在骨形成、吸收、重塑和修复中起着不可或缺的中介作用[19]。Waki等人。据报道,与标准愈合骨折相比,一些miRNAs在不愈合骨折中显著上调,即miR-140-3p、miR-140-5p、miR-181a-5p、miR-181d-5p和miR-451a23。近年来,在骨折领域的研究已经证实miR-185-5p参与了成骨分化细胞矿质化。然而,miR-185-5p在成骨分化细胞中增殖的潜在调控机制尚不清楚。lncRNA-miRNA网络在调节细胞功能,包括骨代谢过程中起着重要作用。一项研究报告miR-185-5p通过Dlx2抑制作用与成骨分化相关[20],这与我们的研究结果一致。根据恢复实验,miRNA-185-5p作为H19的下游介质,参与调节矿化相关基因的表达。已经证明,IGF1在成骨细胞成熟过程中促进成骨分化,并刺激成骨细胞增殖[21]。在目前的研究中,我们发现miR-185-5p负调控AKT的磷酸化,进而促进MC3T3-E1细胞增殖。总之,H19-miR-185-5p-AKT调控网络可能存在于成骨细胞的增殖分化过程中,H19通过ceRNA机制发挥作用。成骨细胞增殖促进细胞外基质矿化是成骨细胞骨形成的重要阶段。这些发现也为H19/miR-185-5p/AKT信号轴与成骨甚至骨疾病的关系提供了线索。
Akt是生命系统中一个重要的信号转导分子,可以调节细胞增殖、分化、凋亡和葡萄糖转运[22]。成骨细胞的生物学行为与细胞信号通路密切相关。其中PI3K/AKT信号通路对成骨细胞的增殖和矿化有重要作用。PI3K/AKT信号通路是代谢胰岛素作用的主要效应器,它参与一些基本的细胞过程,包括细胞增殖、矿化、糖异生、糖原合成等[23,24]。
综上所述,我们探讨了lncRNA H19在成骨细胞中的作用。下调H19通过调节miR-185-5p/AKT轴抑制成骨细胞增殖。这一发现将有助于了解骨折愈合的分子机制,为骨折患者的治疗提供新的思路。
