血液透析患者发生肺部感染的临床特征及危险因素分析
2021-09-15倪力军潘卉萱
王 艳,任 伟,赵 宸,姜 俊,倪力军,潘卉萱,方 媛,黄 婷
(中国科学技术大学附属第一医院肾内科,合肥 230001)
维持性血液透析(maintenance hemodialysis,MDH)患者,因尿毒症内环境以及频繁医疗暴露的影响,这些患者常常被认为是慢性免疫力低下人群[1]。对抗感染的能力较低,在透析环境下更容易并发感染。感染是MHD患者常见住院原因,仅次于心血管疾病(Cardiovascular disease,CVD)。根据美国肾脏病数据系统(USRDS)登记,大约27.9%的患者在开始透析治疗后的1年内发生肺部感染[2]。与一般人群相比,MHD患者的预期寿命相对较低。在过去10年中,他们的5年存活率60%[3]。因此,为了改善MHD患者生存预后,有必要了解血液透析合并肺部感染的临床特征及危险因素。
1 资料与方法
1.1 研究对象选取2016年12月~2020年7月在中国科学技术大学附属第一医院血液净化中心接受MHD治疗患者221例。纳入标准:(1)在本院完成规律性碳酸氢盐透析3个月以上,每周透析2~3次,每次4小时,血流量200~280mL/min,透析液流量500mL/min,透析液钙浓度为1.25mmol/L或1.5mmol/L;(2)采用普通肝素或低分子肝素抗凝治疗。排除标准:(1)年龄<18岁;(2)同时接受腹膜透析治疗患者;(3)怀孕;(4)基线时处于其它部位或全身性的严重感染的患者。研究获中国科学技术大学附属第一医院伦理委员会批准。
1.2 研究方法根据研究期间患者是否发生肺部感染分为肺部感染组和非肺部感染组。肺部感染诊断标准[4]:(1)新近出现的咳嗽、咳痰或原有呼吸道疾病症状加重,伴或不伴浓痰、胸痛、呼吸困难及咯血;(2)发热;(3)肺实变体征和(或)闻及湿性啰音;(4)外周血白细胞>10×109/L或<4×109/L,伴或不伴细胞核左移。(5)胸部影像学检查见新出现的斑片状浸润影、叶或段实变影、磨玻璃影或间质改变,伴或不伴胸腔积液。符合1~4项中任何1项和5项,并除外肺结核、肺部肿瘤、非感染性间质性疾病、肺水肿、肺不张、肺栓塞、肺嗜酸性粒细胞浸润症及肺血管炎后,可建立临床诊断。随访截止2020年12月。
1.3 统计学方法数据采用SPSS 23.0进行分析。连续性变量若符合正态分布,采用mean±SD表示,非正态分布采用M(1/4,3/4)表示。方差齐的正态分布资料组间比较采用独立样本t检验;进行配对资料的均数比较时,采用配对t检验。分类资料采用频数和/或百分比表示,组间差异比较采用卡方检验。采用二分类Logistic回归法分析血液透析患者发生肺部感染的危险因素,单因素生存曲线比较两组患者的生存率,多因素生存分析患者死亡的危险因素,以P<0.05视为差异有统计学意义。
2 结果
2.1 两组患者临床资料比较共纳入MHD患者221例,其中男性144例(65.2%),女性77例(34.8%),平均年龄(56.91±14.06)岁。肺部感染组患者人数65例(29.4%)。肺部感染组患者的年龄更大、BMI值更低,合并糖尿病、心功能不全的占比更高,差异均有统计学意义(P<0.05)。见表1。
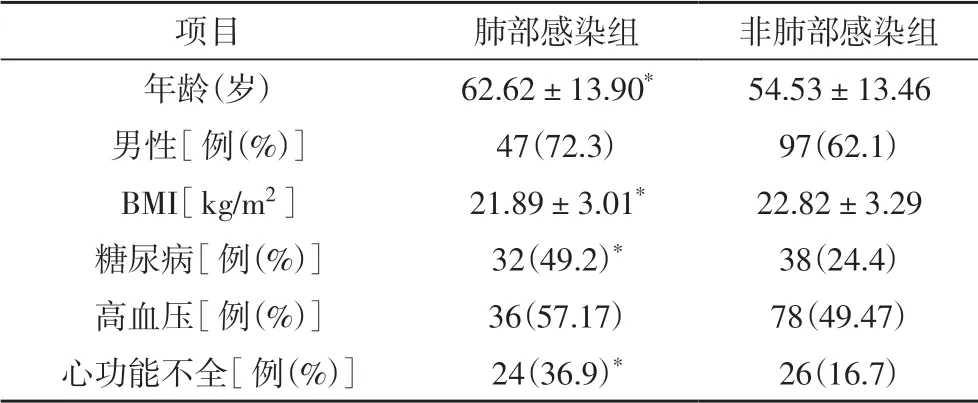
表1 一般临床资料比较
肺部感染组患者的白细胞计数、中性粒细胞百分比水平均更高,淋巴细胞百分比、血白蛋白、血肌酐、血磷、血镁、PTH水平均更低,差异均有统计学意义(P<0.05)。见表2。
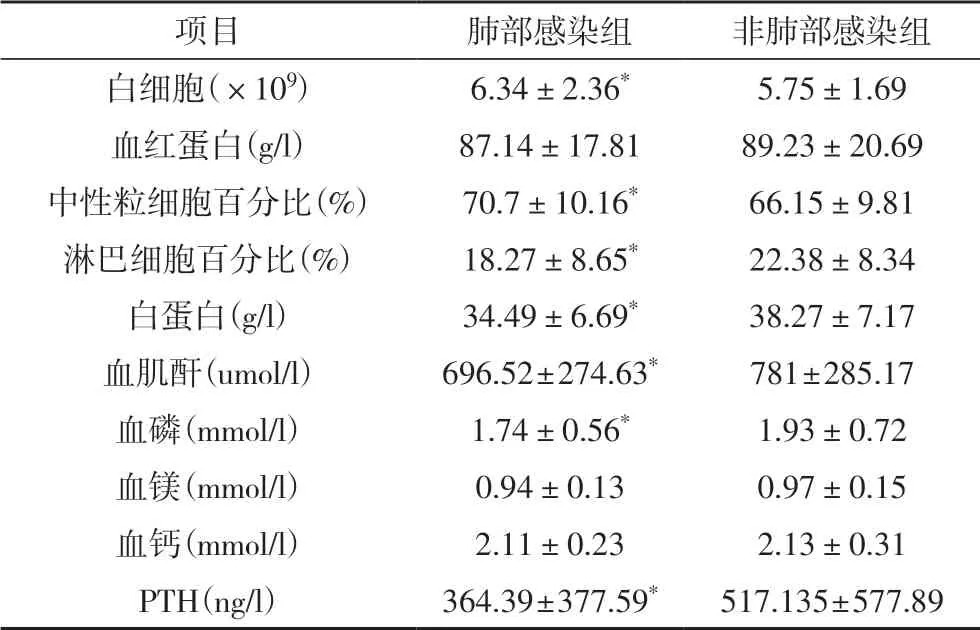
表2 血液和生化指标比较
2.2 血液透析患者发生肺部感染危险因素分析将是否发生肺部感染作为因变量,进行二分类Logistic逐步回归分析。结果显示,合并心功能不全(OR=2.367,95% CI 1.025~5.465,P=0.044),肺部感染风险增高。当血白蛋白每增加1g/l,肺部感染发生风险降低5.9%(OR=0.941,95% CI 0.892~0.994,P=0.029)。当BMI指数每增加1个单位,肺部感染发生风险降低14.6%(OR=0.854,95% CI 0.752~0.969,P=0.014)。
2.3 血液透析患者发生肺部感染后生存分析采用单因素生存曲线比较肺部感染组与非肺部感染组累及生存率的差异,结果显示两组患者48个月累积生存率差异有统计学意义(χ2=11.385,P=0.001)。见图1。
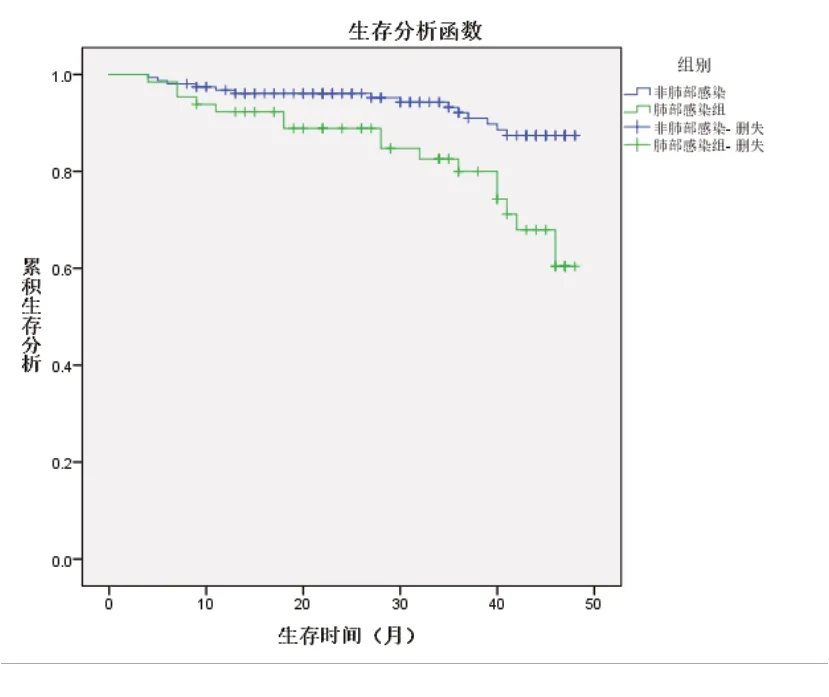
图1 两组患者累积生存率比较
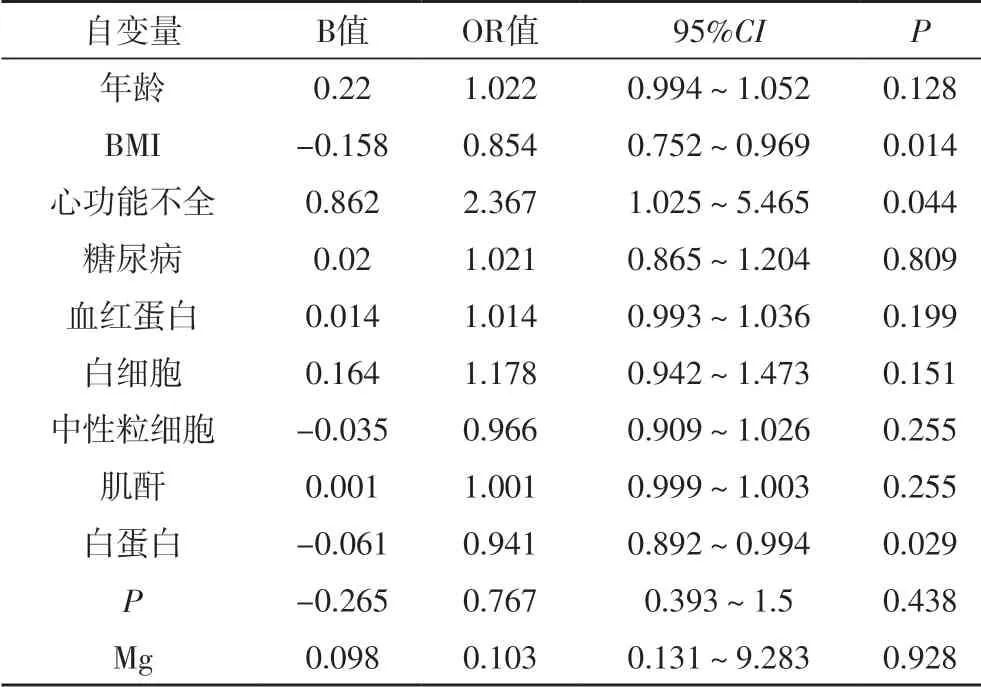
表3 二分类Logistic回归分析
进一步多因素生存分析结果显示血白蛋白水平增高是维持性血液透析患者生存保护因素(HR=0.903,95%CI 0.85~0.96,P=0.001);肺部感染是维持性血液透析患者死亡独立危险因素(HR=2.607,95%CI 1.127~6.029,P=0.025)。
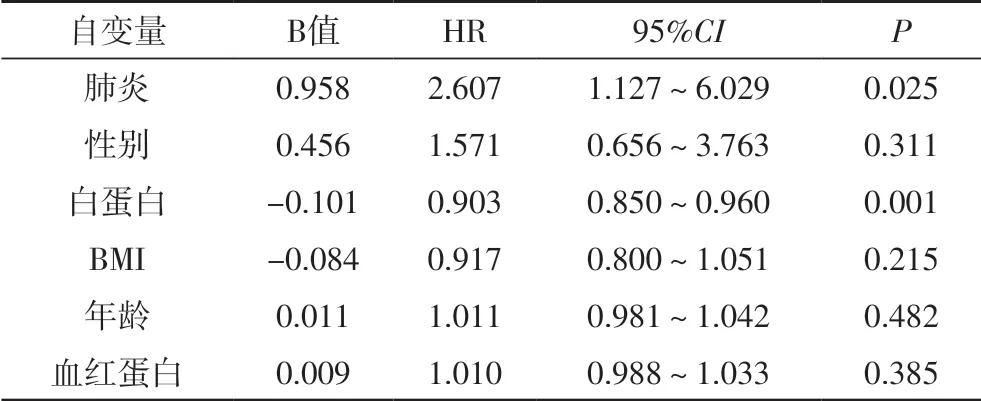
表4 多因素生存分析
3 讨论
终末期肾脏疾病(End-stage renal disease,ESRD)的患病率逐年增高,预计到2030年,需要肾脏替代治疗的人数将增加一倍以上。ESRD患者因体内毒素聚集,T淋巴细胞的免疫功能被抑制,机体免疫能力下降,容易合并感染[5]。因感染导致的死亡人数逐年上升,其中并发肺部感染概率高达50%,肺部感染死亡率比一般人群高14~16倍[6]。因此,早期适当的管理对于降低血液透析患者肺部感染的死亡率至关重要。
文中比较两组患者临床资料发现,肺部感染组患者年龄大,淋巴细胞比例低,合并糖尿病及心功能不全占比更高。国内相关研究发现,大于60岁、合并糖尿病及心功能不全时,肺部感染风险高。MHD患者同时存在细胞免疫及体液免疫功能低下,容易合并感染,死亡率增加[7]。其次,肺被认为是糖尿病的靶器官之一,容易合并糖尿病相关肺损伤,血液透析人群中糖尿病肾病患者更容易并发肺部感染[8]。文中肺部感染发生时,患者血红蛋白、BMI均显著下降,提示患者全身营养状况变差。对MHD患者的流行病学调查显示,BMI升高对MHD患者的潜在保护作用,被称为“反向流行病学”[9]。我们的危险因素分析发现,BMI指数每增加1个单位,肺部感染发生风险降低14.6%,考虑与MHD患者较高BMI具有更好的营养状态有关。文中肺部感染组血镁、血白蛋白、血磷水平低于非肺部感染组,考虑与肺部感染组患者起始营养状况差,磷的摄入减少有关。研究发现,血镁水平增高的患者具有较好的营养状况,与较高的血白蛋白、甘油三酯和血磷水平有关[10]。与本研究结果一致。MorA等研究发现合并心衰患者的肺部感染发生率是无合并心衰患者的1.81倍[11]。本研究发现心功能不全是MHD患者肺部感染发生的危险因素之一,临床上要重视评估患者有无水钠潴留,及时调整干体重,控制血压。国内外研究发现血白蛋白每降低1g/l,MHD患者死亡风险增加40%[12]。与本研究Logistic回归分析结果一致。研究发现,肺部感染后累积存活率降低[13]。与本研究中肺部感染组随访期间累积生存率明显低于非肺部感染组患者累积生存率结果一致。
综上所述,血液透析患者合并肺部感染将会导致患者的生存率明显降低,对于基线时存在白蛋白、BMI等营养状况指标降低的患者,给予早期干预和预防,可能显著减少肺部感染发生风险。同时,提高血白蛋白水平及减少肺部感染的发生,将明显改善患者生存预后。
