非小细胞肺癌放疗前后Th17的变化与临床意义
2021-09-15吴旭左扬松濮娟潘艳祝丽晶侯盼飞
吴旭,左扬松,濮娟,潘艳,祝丽晶,侯盼飞
(南京医科大学康达学院附属涟水人民医院,江苏 涟水 223400)
0 引言
肺癌的发病率和死亡率均位居我国恶性肿瘤之首,据世界卫生组织预测,到2025年,我国肺癌患者总数将超过100万,成为世界第一肺癌大国[1]。放射治疗是治疗肺癌的有效手段之一,然而机体的免疫环境复杂,且在肿瘤发生、发展的各个阶段受到多种因素的影响,了解放疗对肺癌免疫细胞的影响对指导肺癌治疗的意义重大。本研究通过流式细胞术(flowcytometry, FCM)测定非小细胞肺癌(non-small cell lung cancer, NSCLC)外周血中辅助性T细胞17(T helper cells 17, Th17)占CD4+T 细胞百分比,统计分析放疗过程中Th17的变化,为肺癌放疗联合免疫治疗提供新的干预靶点,为肺癌患者提供更精准的个体化治疗方案。
1 资料与方法
1.1 一般资料
选取2019年1月至2019年8月收治于我院的20例非小细胞肺癌(non-small cell lung cancer, NSCLC)作为研究对象,年龄60-80(70.41±6.85)岁。纳入标准:①病理证实NSCLC;②首次确诊;③开始采集标本后1月内只接受单纯放疗的患者。排除标准:①处于慢性疾病的急性加重期;②合并自身免疫系统疾病以及应用免疫抑制剂等药物。选取我院职工查体健康者30例作为对照组,年龄60-80(68.51±7.39)岁。两组在性别和年龄方面差异无统计学意义(P>0.05)。
1.2 血样采集
肺癌组分别于放疗前、放疗期间(每隔6次放疗)清晨空腹抽取外周静脉血2mL(肝素抗凝),对照组采集空腹静脉血2mL(肝素抗凝)。
1.3 放疗方法
运用直线加速器(Varian 23-Ex,美国)对入选患者均采用6MV X 线 IMRT 外照射,常规分割 2.0Gy/f,总剂量 DT 60Gy/30f。
1.4 检测方法
按照试剂盒说明书(Becton, Dickinson and Company,美国)处理标本。分别取肝素抗凝血100μL加入已标记好的流式管,用RPMI 16401:1 等体积稀释, 加入2μLBD LEUKO ACTVTN GolgiPlug (37℃迅速解冻),震荡混匀后置于5%CO2培养箱培养5h。加入20μL CD8 PerCP-Cy5.5和5μL CD3 APC,震荡混匀后室温避光孵育15min;加入100μL Fix&Perm中的Reagent A,室温避光孵育15min,加入3mL PBS1200rpm离心5min,弃去上清,重悬后加入100μL Fix&Perm中的Reagent B后加入20μL的HU IL-17A PE,室温避光孵育15min,加入3mL PBS,1200rpm离心5min,弃去上清,500μLPBS重悬,采用流式细胞仪(Navios,美国)检测Th17占CD4+T淋巴细胞百分比。
1.5 统计学分析
2 结果
2.1 与健康对照组相比,肺癌组外周血Th17占CD4+T淋巴细胞百分比(0.92±0.49)%显著低于健康对照组(2.36±1.14)%(P<0.05), 见表1。
表1 肺癌组与健康组Th17占CD4+T淋巴细胞百分比的比较(±s,%)

表1 肺癌组与健康组Th17占CD4+T淋巴细胞百分比的比较(±s,%)
分组 Th17肺癌组 0.92±0.49对照组 2.36±1.14 t 24.42 P 0.00
2.2 肺癌患者放疗期间各阶段外周血Th17占CD4+T淋巴细胞百分比自放疗后显著下降,与放疗前相比具有显著性差异(P<0.05),见表2。图1显示某一肺癌患者放疗期间运用流式细胞仪检测外周血中Th17的分析图。
表2 放疗各阶段Th17占CD4+T淋巴细胞百分比的比较(±s,%)
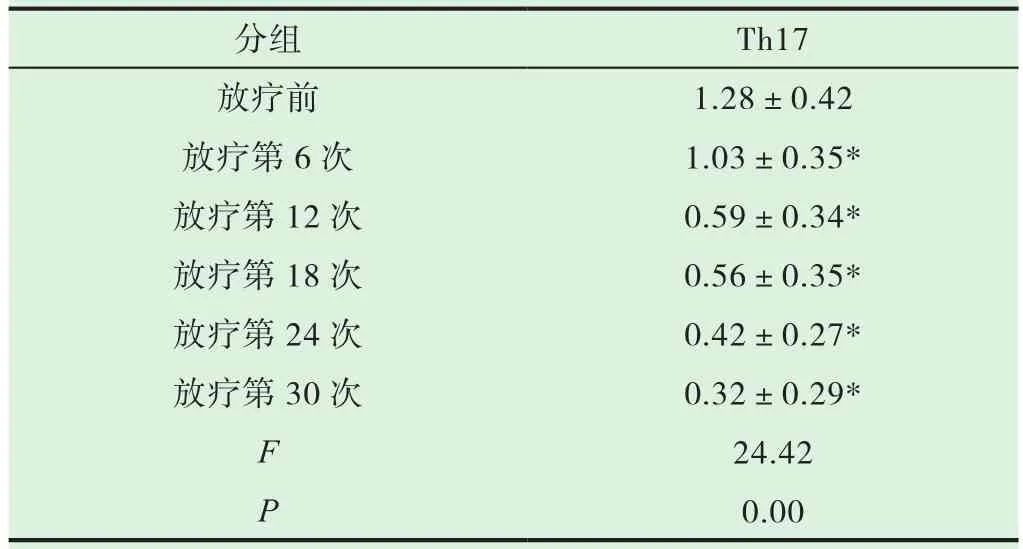
表2 放疗各阶段Th17占CD4+T淋巴细胞百分比的比较(±s,%)
注:*与放疗前相比,差异有统计学意义,P<0.05.
分组 Th17放疗前 1.28±0.42放疗第6次 1.03±0.35*放疗第12次 0.59±0.34*放疗第18次 0.56±0.35*放疗第24次 0.42±0.27*放疗第30次 0.32±0.29*F 24.42 P 0.00
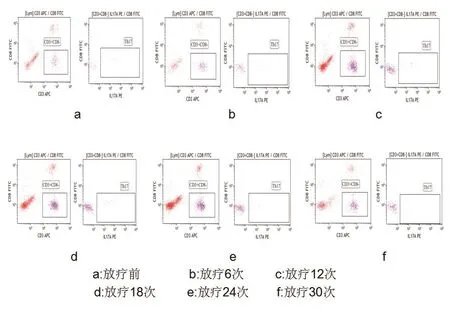
图1 某肺癌患者放疗期间外周血中Th17占CD4+T淋巴细胞比例
3 讨论
CD4+T 细胞是效应 T 细胞的重要成分,根据效应细胞的生物学功能特征,将其分为Th1、Th2、调节性T细胞(regulatory T cells, Treg)和Th17。Th17首次由Harrington等[2]于2005年首次发现,高水平表达 IL-23 受体(IL-23R)、IL-1 受体及 IL-18 受体,它的特异性转录因子是视磺醛酸相关的孤儿核受体 (ROR-γt)[3]。Th17通过分泌 IL-17、IL-21、IL-22、IL-23等多种细胞因子参与感染性、自身免疫性等疾病,近年来,其在肿瘤发生、发展中的作用也成为研究的热点。我们的研究发现,肺癌组外周血Th17占CD4+T淋巴细胞百分比低于健康对照组,这与Horlock[4]等在乳腺癌中的研究结果是一致的。Th17 可依靠细胞因子从外周血募集并活化中性粒细胞,促进内皮细胞分泌趋化因子,从而将细胞毒性T细胞浸润至肿瘤组织,进而抑制肿瘤的生长[5]。然而,也有研究认为在原发性肝癌、胃癌中,Th17的表达是增加的,且与肿瘤淋巴结转移及 TNM 分期、预后不良成正相关。Th17在肿瘤患者升高的原因可能为:肿瘤细胞高表达IL-6、IL-8等有利于Thl7分化和扩增的细胞因子及趋化因子等。Th17数量的增加,引起效应性细胞因子IL-17的分泌增加,诱导血管内皮细胞活化,促进新生血管形成;另外,Thl7也可通过NF-κB/ZEB1信号通路加速肿瘤细胞的侵袭和转移[6-8]。Th17在不同的肿瘤中表现出的作用形式不同,考虑与肿瘤类型的差异有关。Th17与肿瘤之间的关系复杂,促进或抑制肿瘤的过程及机制尚需进一步的探讨,如果明确二者的关系,将有利于发现更有效的肿瘤免疫治疗方法。
肺癌早期诊断较为困难,确诊时只有15%的患者能够手术治疗,对于无法手术的患者,放疗是主要的治疗措施[9]。放疗是利用放射线治疗恶性肿瘤的一种主要手段之一,在临床治疗肿瘤中异常重要。放疗在杀死肿瘤细胞的同时也会引起人体免疫细胞的改变,放疗能够增加部分免疫细胞的浸润,增强或抑制机体的抗肿瘤免疫功能[10]。我们的研究结果显示,肺癌放疗过程中,Th17于放疗早期既开始显著下降,说明Th17对于放疗非常敏感,但放疗期间下降不明显,不排除放疗期间急性肺损伤[11,12]所致,具体的机制尚不明确。在放疗过程中监测Th17的动态演变并适时联合免疫干预,能充分发挥抗肿瘤免疫效应细胞的功能,杀灭肿瘤细胞,改善患者的预后。Th17 联合放疗等治疗手段可能成为治疗肿瘤的免疫疗法的新途径。
