梧州市2019-2020年登革热流行特征分析
2021-09-15盘珍梅黄浩
盘珍梅,黄浩
(梧州市疾病预防控制中心,广西 梧州 543002)
0 引言
登革热是一种由登革病毒感染引起的急性传染病,少数患者可发展为登革出血热、登革休克热等严重类型,导致死亡结局的发生[1]。随着全球气温上升及东南亚国家的经济发展,近年来该病的流行范围呈现不断扩大的趋势,我国登革热流行地区亦逐渐从沿海地区向内陆扩展[2]。广东、广西两个省区近年来登革热疫情频发,而处于两广交界处的梧州市已成为登革热疫情易发生的地区,为了更好开展登革热的疫情防控工作,本文特对2019年1月至2020年12月间梧州市的登革热流行特征进行分析,为防控工作提供科学依据。
1 资料与方法
1.1 病例资料
病例资料来自2019年1月至2020年12月间,国家“疾病监测信息报告管理系统”中进行网络直报的登革热病例个案信息,病例类型包含疑似病例、临床诊断病例和实验室诊断病例。人口学资料来源于梧州市统计局。
样本来源由二级以上医疗机构和疾病预防控制机构对部分病例进行血清和尿液样本采集,由梧州市及岑溪市的疾病预防控制中心实验室进行登革病毒核酸、NS1抗原及IgM、IgG检测。
质量控制所有检验、采样人员均每年接受技术培训,由医疗机构采样后,当地疾控中心人员收样并送疾病预防控制中心实验室进行检测。样本采集后置于4℃内保存并全部在48h内完成检测。
1.2 仪器与检测方法
核酸检测应用ABI 7500荧光定量PCR仪按照《登革热实验室检测指南》进行荧光定量RT-PCR检测;病毒RNA提取使用试剂盒为西安天隆科技有限公司;核酸扩增使用试剂为北京卓诚惠生登革热病毒通用型核酸实时荧光PCR检测试剂盒,登革热Ⅰ型/Ⅱ型/Ⅲ型/Ⅳ型病毒核酸四重实时荧光PCR检测试剂盒。核酸提取、扩增的检测步骤、反应条件严格按试剂说明书进行,使用试剂均在有效期内;检测病毒核酸类型为通用型及Ⅰ-Ⅳ型登革病毒。
抗体检测应用瑞士Teccn-F50酶标仪按照《登革热实验室检测指南》进行NS1抗原、IgM抗体、IgG抗体定性检测;使用试剂为北京万泰登革病毒NS1抗原检测试剂盒(酶联免疫法)、中山生物登革病毒IgM抗体诊断试剂盒(酶联免疫法)、中山生物登革病毒IgG抗体诊断试剂盒(酶联免疫法);检测步骤、反应条件严格按试剂说明书进行,使用试剂均在有效期内。
1.3 统计学分析
将上述数据用Excel整理,通过描述统计分析法分析梧州市登革热发病年龄、性别以及发病地区、发病时间特征。采用SPSS 22.0统计学软件进行统计学分析,计数资料采用百分比进行统计表述,计数值采用χ2值检验,检验水准采用α=0.05。
2 结果
2.1 病例概况
广西梧州市2019年1月至2020年12月间,共报告登革热病例468例,其中2019年共报告99例,2020年共报告369例;均为普通或轻症病例,无重症及死亡病例。468例病例中,18例为输入性病例,其余均为本地病例。输入病例主要来源于本省其它城市(6例)、广东省(5例)、境外(3例)见表1。
2.2 地区分布
全市各城区及下辖各市(县)均有病例报告,以岑溪市的总发病率最高,为4.87/10万,其次为长洲区和万秀区,分别为1.59/10万、0.86/10万,藤县总发病率最低,为0.03/10万。见表1。按照输入病例和本地病例的发病率分别进行聚类,可聚为3类。一类为岑溪市,输入性病例占总体比例居中,但引起较多本地病例;一类为长洲区、万秀区和龙圩区,输入性病例占总体比较高,可引起一定的本地病例;余下的3个县聚为一类,输入性病例占总体比例居中或较低,但只引起少量的本地病例或基本不导致本地病例。
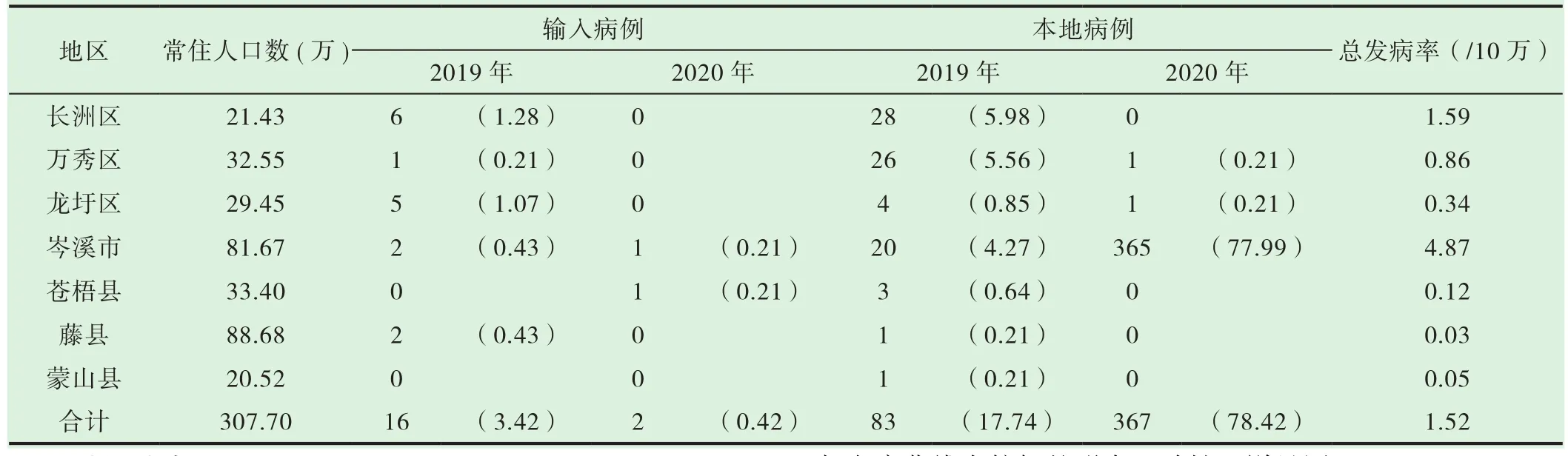
表1 广西梧州市2019-2020年登革热患者感染地区分布(构成比,%)
2.3 时间分布
从发病曲线来看,全年的发病呈现单峰状,秋、冬季发生率明显高于其他季节,输入性病例最早报告可见于5月,绝大部分的输入性病例和本地病例集中在8-11月间出现,其余月份病例报告数量极少。发病曲线与全市的常规伊蚊媒介布雷图平均指数曲线形态存在一定差异,比如2019年4月为当年伊蚊媒介密度最高峰,6-9月仍维持在较高水平,随后呈现下降趋势,而当年的登革热疫情在5月开始,8-11月为高峰,2020年5-6月、9月分别出现两个伊蚊密度高峰,而当年9-10月是登革热疫情的发病高峰。但应急监测的布雷图指数曲线与发病曲线有较好的形态一致性。详见图1。
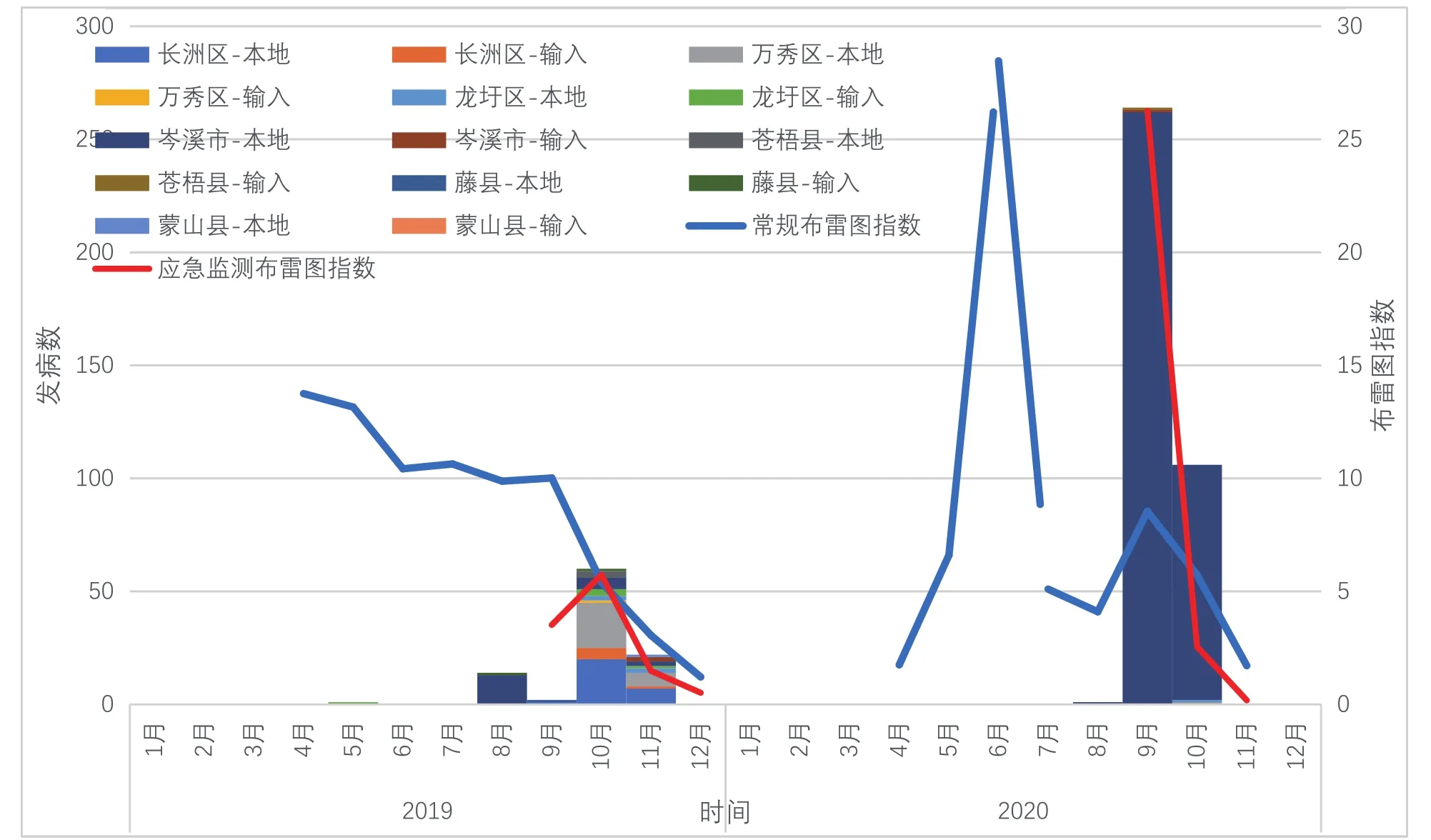
图1 梧州市2019-2020年登革热病例发病时间分布图
2.4 人群分布
本地病例和输入性病例间的年龄分布人群分布差异有统计学意义(χ2=37.645,P=0.000),输入性病例主要波及 20~30岁的人群,本地病例则主要波及10~50岁的人群。但两者均呈现两端低中间高的现象,以青壮年发患者数最多,见表2。本地病例中,波及的职业人群主要是农民工(132例)、儿童及学生(77例)、家务或待业人员(73例)、服务业人员(47例),输入性病例中,波及的职业人群主要为外出务工的农民及工人(9例)和短期外出旅游的无业人员(4例)。
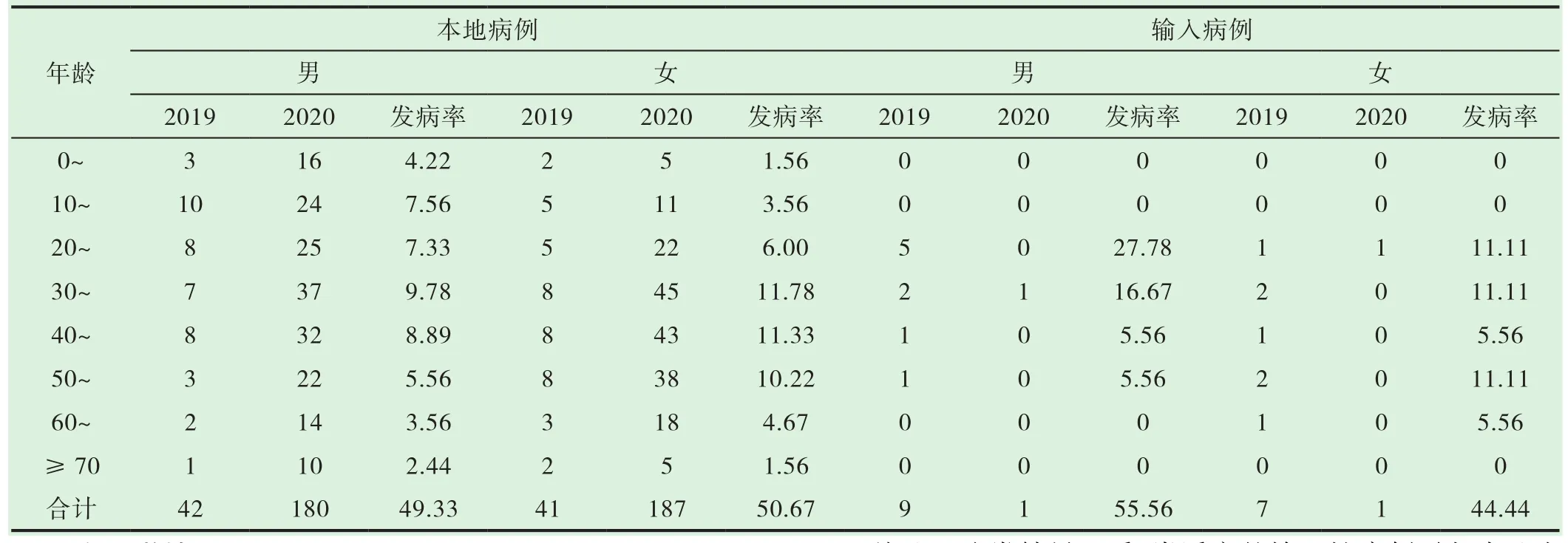
表2 梧州市2019-2020年登革热患者的年龄分布特征(发病率 /10万)
2.5 病原学检测
468例病例中有3例输入性病例为外地报告,因此无病原学检测数据。剩余的465例病例中,病原学检测结果单项阳性的有346例,两项阳性的为89例,三项阳性的为29例,四项阳性的为1例,主要以核酸单项阳性、NS1抗原和IgM两项阳性为主。见表3。核酸结果为阳性的有377例(占总体的81.07%),NS1抗原结果为阳性的有127例(占总体的27.31%),IgM结果为阳性的有106例(占总体的22.80%),IgG结果为阳性的有1例(占总体的0.22%)。2019年核酸分类检测结果全部为登革热病毒Ⅱ型,2020年全部为Ⅰ型。
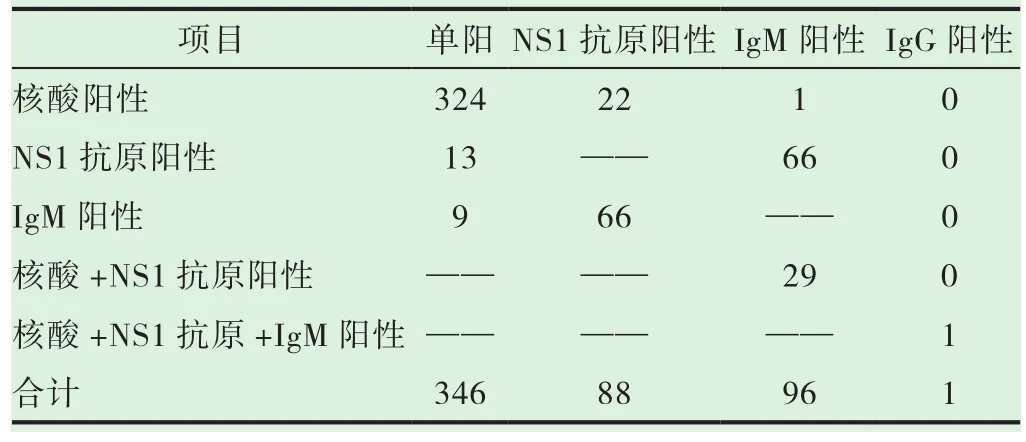
表3 梧州市2019-2020年登革热病例病原学检测结果统计表
3 讨论
梧州市登革热疫情具有明显的季节性的流行特征。本地病例经调查多与输入性病例存在关联,符合输入性病例引起本地疫情的特点[3]。梧州市位于广西东部,属于亚热带季风气候,登革热在东南亚地区的暴发主要与雨季相同,雨季水量充沛,温度适宜等原因给伊蚊媒介提供了天然的繁殖条件,所以东南亚国家中以泰国登革热疫情暴发作为频繁[4]。广西靠近越南和泰国,而热季和雨季往往比热带地区晚来一个月。在正常气候条件下,7-11月是伊蚊媒介活动的高峰季节,此时段的输入性病例引起本地疫情的风险是最高的[5]。但从常规的布雷图监测曲线与发病曲线的拟合程度看,在布雷图指数最高的春夏季出现的输入性病例却未引起大规模的本地疫情,反而在活跃度稍低的月份出现大规模的本地疫情。由此推测,对于非自然疫源地,伊蚊媒介只要其密度保持在一定的风险范围内,出现输入性病例即可引起一定规模的本地疫情。因此伊蚊媒介之外的其它危险因素的作用更应该值得探讨和重视。另外,梧州市仅在2014年出现输入病例引起的小规模本地暴发疫情,此后都只有散发的输入性病例报告,至2019、2020年连续两年均出现本地暴发疫情,综合以上情况,是否与近年来全球气候剧变、高速铁路发展、东南亚旅游业发展迅速、出境务工人员数量增加等因素有关值得进一步研究[6]。
从地区聚类结果上看,岑溪市的输入性病例引起本地发病率高,且连续两年均导致本地的暴发疫情,是登革热的发病热点地区,存在易引起疫情扩散的危险因素。而长洲区、万秀区和龙圩的输入性病例占总体比较高,可引起一定的本地病例,表明在一定的输入疫情压力下存在引起暴发疫情的风险;余下的3个县虽有输入性病例但只引起少量的本地病例或基本不导致本地病例,表明3个县级地区可能存在不利于疫情扩散的因素。有必要对各类地区进行风险因素的研究,以指导防控工作的开展。
从报告病例进行病原学检测的结果来看,核酸检测的阳性率为81.07%,远高于NS1抗原及IgM的阳性率,IgG最低,因此核酸检测具备较好的灵敏度和特异度。其诊断价值要高于抗原抗体等检测技术,应该优先推荐在病例风险监测和病例筛查、人员排查等工作中使用。但465例病例中,有88例病例仅出现NS1抗原和IgM阳性,因此NS1抗原及IgM可以作为核酸检测阴性人员的补充检查,以免出现漏诊。而IgG在现症病例中的阳性率极低,且同时伴有其它检测项目的阳性,其作为辅助诊断的检测手段意义不大。
目前,我国登革热疫情主要是输入性病例引起本地疫情,两广地区均非其自然疫源地,因而周边东南亚的国家和地区是主要的输入性病例来源。从梧州市的输入病例职业分布上看,输入性病例大多数是农民工,该类人员在境外务工,缺乏防病意识,其居住地及工作场所流动性大,受伊蚊叮咬的机率高,非常易受感染。另外,本地病例也以农民工为主,部分农民工经常跨省跨市流动务工,极易造成疾病在省际与城际间的传播。因此需要加强流动人口及外出务工人员的健康宣教,提高其对登革热防治措施的认知水平,从而做好卫生管理以及防蚊措施,从而降低该病的发生率。
