磁性氧化石墨烯对水中Cu(Ⅱ)和Co(Ⅱ)的快速去除与吸附机理①
2021-09-15布林朝克朱艳华
布林朝克,朱艳华,郭 婷,李 波
(1.内蒙古科技大学 材料与冶金学院,内蒙古 包头014010;2.钢铁研究总院 功能材料研究所,北京100081;3.内蒙古包头生态环境监测站,内蒙古包头014010;4.内蒙古科技大学 能源与环境学院,内蒙古 包头014010)
现代工业每年排放大量重金属,造成严重水污染[1-2]。重金属难以生物降解,对人体健康和生态环境造成危害。铜和钴是2种常见重金属。在众多重金属水污染处理技术中,吸附法成本低、效率高、操作简便,研发高效吸附材料具有紧迫性和必要性。氧化石墨烯(graphene oxide,GO)的结构中存在大量含氧官能团,可吸附各种水污染物。然而,石墨烯片层之间的强π-π作用力引起的团聚,以及高度亲水引起的固液分离难题阻碍了其实际应用。引入磁性颗粒是解决上述难题的一条途径。本文制备了磁性氧化石墨烯(MGO),评价了其对水中Cu(Ⅱ)、Co(Ⅱ)的吸附性能,分析了吸附机理。结果表明,MGO对Cu(Ⅱ)、Co(Ⅱ)具有高吸附容量和快速吸附能力。本方法可为开发高效重金属吸附材料提供一定参考。
1 实验原料及方法
1.1 实验原料
主要实验原料:天然鳞片石墨(45μm,青岛美利坤石墨制品厂),K2FeO4、H2O2(30wt%)、KMnO4、EtOH、H2SO4(98wt%)、NH3·H2O(25wt%)、二水合柠檬酸钠(Na3Ct·2H2O)、HCl(38wt%)、NaOH、FCl3·6H2O、FeCl2·4H2O、Cu(NO3)2·3H2O、Co(NO3)2·6H2O,均为分析纯。
1.2 材料制备
采用本课题组改进的Hummers法[3]制备GO水溶胶。
MGO制备流程如下:将GO水溶胶(1.2 mg/mL,100 mL)超声分散20 min;将0.420 3 g FeCl3·6H2O、0.154 6 g FeCl2·4H2O、0.166 6 g Na3Ct·2H2O加入反应容器中,搅拌20 min,使其完全溶解,获得均匀分散溶液;将反应液加热至80℃,随后不时往反应体系中滴加氨水,以使pH值维持在10~11,期间可观察到共沉淀反应产生的Fe3O4黑色沉淀。最后,将反应产物先后用去离子水和无水乙醇清洗数次,60℃下真空烘干,获得目标产物MGO。
共沉淀反应为:
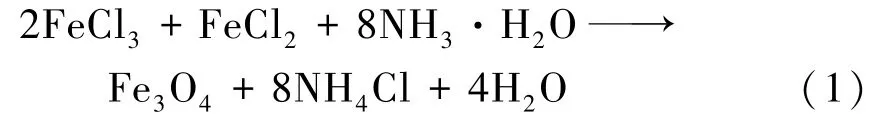
1.3 材料表征
通过X射线衍射(PANalytical,X′Pert PRO,Netherlands)鉴定样品的物相组成;用场发射扫描电镜(JEOL,JSM-6701F,Japan)观察样品形貌;用傅里叶变换红外光谱(Bruker IFS66V,Germany)分析样品的官能团;用X射线光电子能谱(Kratos Axis Supra,England)分析吸附重金属前后的样品的表面元素组成及化学环境;在pH计(上海仪电科学仪器股份有限公司,PHS-3B,中国)的监测下,将重金属离子溶液的pH值调至目标值。
1.4 吸附实验
将2.2832 g Cu(NO3)2·3H2O或2.965 6 g Co(NO3)2·6H2O溶解于1 000 mL去离子水中,获得Cu(Ⅱ)或Co(Ⅱ)浓度为600.53 mg/L的水溶液。将20 mL制得的Cu(Ⅱ)或Co(Ⅱ)水溶液转移至容量为50 mL的锥形瓶中,在pH计的监测下,用0.1 mol/L HCl或NaOH将溶液pH值调至目标值。称取一定量的MGO投入锥形瓶中,将锥形瓶置于预先设置好温度的恒温摇床上,在220 r/min下摇荡。待完成一定接触时间,用一块NdFeB磁铁将MGO吸在锥形瓶底,倒出清澈的吸附后溶液,用原子吸收分光光度计(PerkinE Co Ltd,AA800,USA)测量Cu(Ⅱ)或Co(Ⅱ)浓度。吸附剂用量D、吸附剂对吸附质的吸附率R i和吸附量Q i的计算式为:
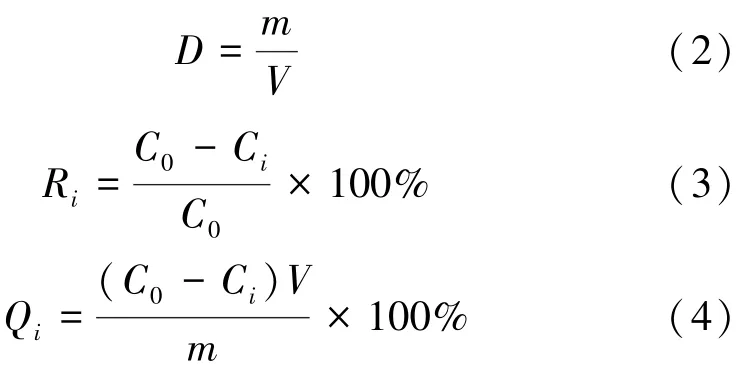
式中i的3种可能取值0,e,t分别表示吸附的初始状态、平衡状态和任意时刻t的状态。C i表示Cu(Ⅱ)或Co(Ⅱ)浓度,mg/L;V表示Cu(Ⅱ)或Co(Ⅱ)溶液体积,mL;m表示MGO质量,g。每个吸附实验均平行进行2次,取平均值。
2 实验结果与分析
2.1 样品分析表征
2.1.1 物相分析
图1为MGO的XRD图谱。位于2θ=23.1°、29.4°、36.0°、43.2°、53.8°和57.5°的峰分别来自Fe3O4的(002)、(220)、(311)、(400)、(422)和(511)晶面的衍射[4],证明MGO中存在Fe3O4。在MGO的XRD图谱中未观察到清晰的石墨烯衍射峰,可能是因为石墨烯中碳原子结晶性差,或因MGO中石墨烯含量低。
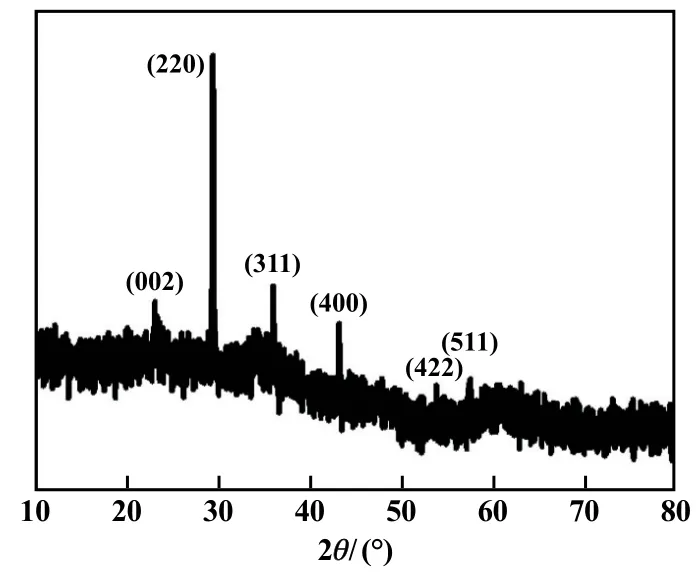
图1 MGO的XRD图谱
2.1.2 形貌分析
图2为MGO的场发射扫描电镜图。石墨烯呈典型的褶皱层状结构,片层边缘、脊线清晰可见。平均直径为40~70 nm的球形Fe3O4颗粒附着在石墨烯片层表面,从而带来2个积极结果:①Fe3O4提供空间位阻,阻碍石墨烯片层之间的堆叠,避免比表面减小和吸附性能退化;②Fe3O4自身被石墨烯片层包裹,减少了团聚和被溶液环境腐蚀的可能,利于维持其磁性。

图2 MGO的场发射扫描电镜图
2.1.3 官能团分析
图3为GO、Fe3O4和MGO的红外光谱(FTIR)图谱。在Fe3O4的FTIR谱中,位于584 cm-1的峰源自Fe—O的伸缩振动[4]。与GO、Fe3O4的FTIR谱对比可知,在MGO的FTIR谱中,位于610 cm-1、1 115 cm-1、1 404 cm-1、1 633 cm-1和3 425 cm-1的峰分别源自Fe—O、C—O、和O—H的伸缩振动[5-6],证明石墨烯和Fe3O4同时存在于MGO中。
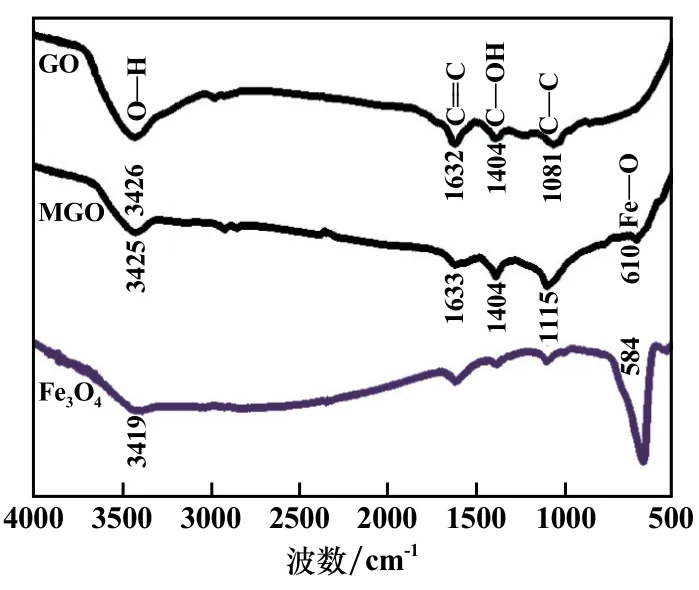
图3 GO、MGO和Fe3 O4的红外光谱图谱
2.2 MGO吸附性能
2.2.1 pH值对MGO吸附性能的影响
对水中重金属的吸附,pH值是重要影响参数之一。pH值对吸附的影响体现在吸附质、吸附剂、吸附介质3个层面。吸附质层面:pH值影响重金属离子在溶液中的形态分布;吸附剂层面:pH值影响吸附剂的表面电荷;吸附介质层面:pH值影响水的电离平衡,导致H+、OH-浓度随pH值变化而此消彼长,而H+、OH-与吸附质竞争吸附位点。
在25℃、吸附剂MGO用量500 mg/L、吸附时间10 min、Cu(Ⅱ)和Co(Ⅱ)初始浓度均为600.53 mg/L条件下,考察了pH值对吸附的影响,结果见图4。图4显示,当3<pH<8时,MGO对Cu(Ⅱ)的吸附随着pH值增大而显著增大,但当pH>8后,MGO对Cu(Ⅱ)的吸附开始显著减少。当3<pH<9时,MGO对Co(Ⅱ)的吸附随着pH值增大而增大;当pH>9后,MGO对Co(Ⅱ)的吸附开始减少。在低pH值下MGO对2种重金属离子的吸附率普遍较低,这是因为低pH值下溶液中存在较多H+,与重金属离子竞争吸附位点;吸附剂表面吸附较多H+而带正电荷,与同样带正电荷的重金属离子产生静电排斥,阻碍吸附。然而,在较高pH值下,重金属开始形成氢氧化物沉淀,导致MGO对重金属的吸附减少。MGO对Cu(Ⅱ)、Co(Ⅱ)吸附的最佳pH值分别为8和10。
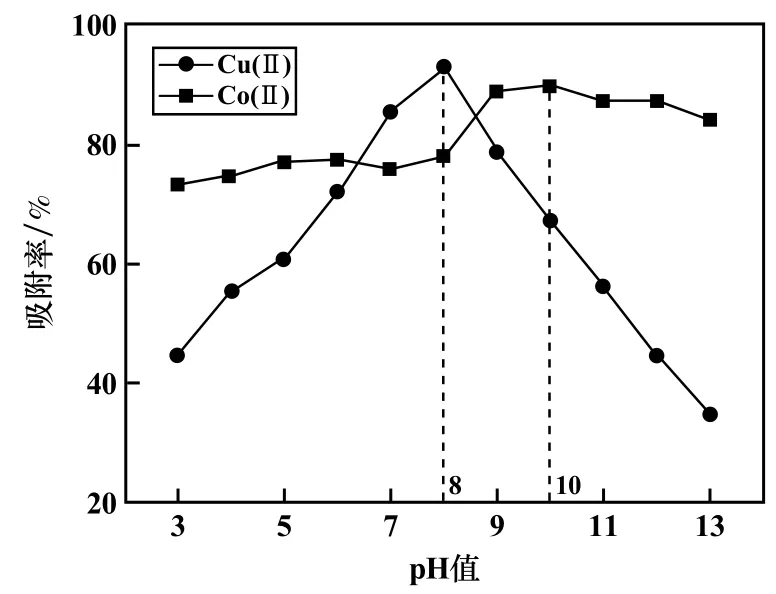
图4 pH值对MGO吸附Cu(Ⅱ)、Co(Ⅱ)的影响
2.2.2 接触时间对MGO吸附重金属离子的影响
吸附剂-吸附质间的接触时间是决定吸附效率的关键参数之一。在Cu(Ⅱ)和Co(Ⅱ)的最佳吸附pH值条件下,其他条件不变,接触时间对MGO吸附Cu(Ⅱ)、Co(Ⅱ)的影响见图5。图5显示,MGO对Cu(Ⅱ)、Co(Ⅱ)的吸附由快变慢,继而达到了吸附平衡,这一点可从吸附质、吸附剂两个层面理解。吸附质层面:在吸附的初始阶段,溶液中尚有大量游离的吸附质,其绝对浓度以及在溶液本体和吸附剂表面之间的浓度梯度均较高,有利于克服传质阻力;吸附剂层面:在吸附的初始阶段,吸附剂表面尚有大量未被占据的吸附位点。MGO对Cu(Ⅱ)、Co(Ⅱ)的吸附分别于7 min、5 min达到平衡;MGO对Cu(Ⅱ)的吸附率和吸附量分别为92.77%和1 114.22 mg/g,对Co(Ⅱ)的吸附率和吸附量分别为88.74%和1 065.81 mg/g。由此可见,MGO对2种重金属具有快速、高效的吸附性能。

图5 接触时间对MGO吸附Cu(Ⅱ)、Co(Ⅱ)的影响
2.3 吸附等温线、动力学、热力学
Freundlich等温吸附模型描述非均匀表面上吸附热不均等的吸附[7]:

式中KF和n分别为与吸附容量和吸附强度有关的Freundlich常数,其中参数n用于判断吸附类型:当n<1为化学吸附,n>1为物理吸附[7]。
准二级(PSO)动力学模型假设,吸附速率与空余吸附位点数量的平方成正比,整个吸附过程受化学吸附控制[8]:
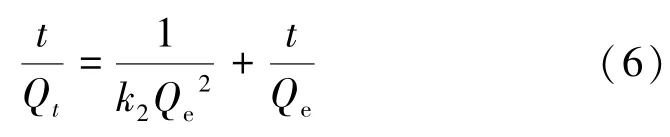
式中k2为准二级动力学速率常数,g/(mg·min)。
用Van′t Hoff方程对不同温度下的平衡吸附数据进行拟合,以计算吸附热力学函数。Van′t Hoff方程为:
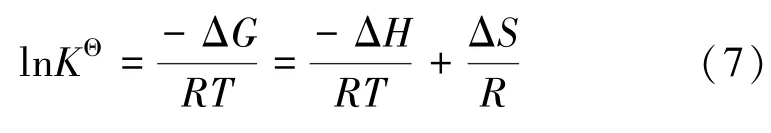
式中R为气体常数,8.314 J/(mol·K);T为热力学温度,K;KΘ为吸附热力学平衡常数,L/g;ΔG、ΔH、ΔS分别为吸附吉布斯自由能变化、焓变、熵变。
Cu(Ⅱ)和Co(Ⅱ)初始浓度均为600.53 mg/L,在Cu(Ⅱ)和Co(Ⅱ)各自最佳吸附pH值条件下,Freundlich、PSO、Van′t Hoff拟合曲线分别见图6~8。
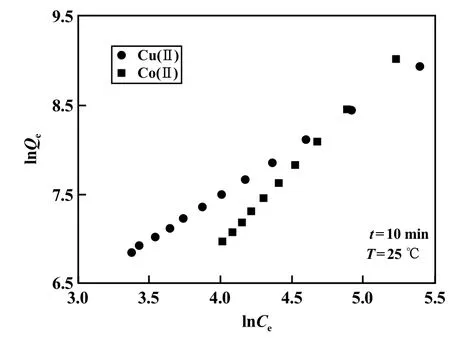
图6 Freundlich模型拟合曲线
Freundlich拟合结果表明,MGO对Cu(Ⅱ)、Co(Ⅱ)的吸附,线性相关系数R2分别为0.999 8、0.999 9,吻合度良好。拟合所得Freundlich常数n值分别为0.970 1、0.592 1,均小于1。由此可知:①MGO对Cu(Ⅱ)、Co(Ⅱ)的平衡吸附宜用Freundlich等温模型描述;②MGO对Cu(Ⅱ)、Co(Ⅱ)的吸附为化学吸附;③MGO对Cu(Ⅱ)、Co(Ⅱ)的吸附为非均匀表面上的吸附。
PSO拟合结果表明,MGO对Cu(Ⅱ)、Co(Ⅱ)的吸附,准二级动力学模型给出的线性相关系数R2分别为0.998 0、0.999 5,吻合度良好。由PSO模型拟合所得MGO对Cu(Ⅱ)、Co(Ⅱ)的吸附容量分别为1 136.37 mg/g、1 075.27 mg/g,与实验值1 114.22 mg/g、1 065.81 mg/g很接近。由此可知:①MGO对Cu(Ⅱ)、Co(Ⅱ)的非平衡吸附更宜用PSO模型描述;②吸附过程受化学吸附控制。
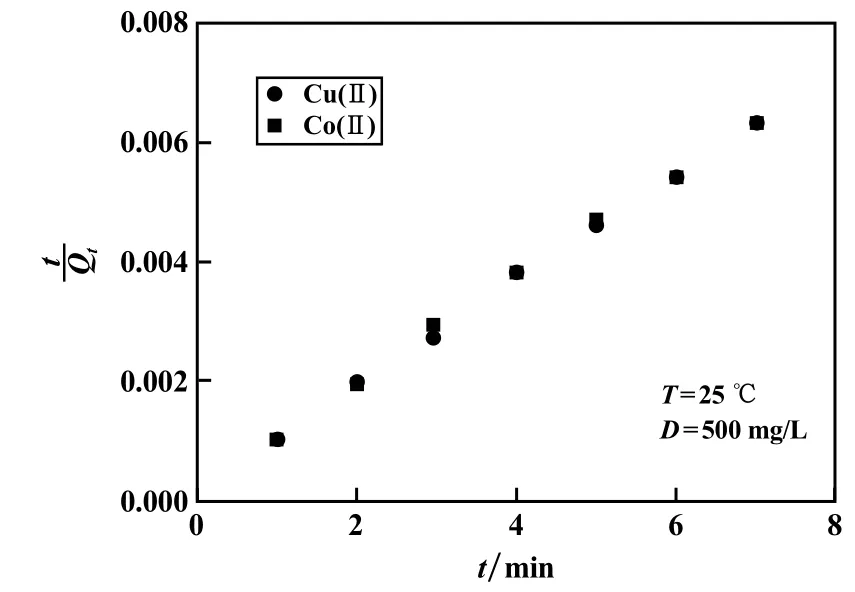
图7 准二级模型拟合曲线
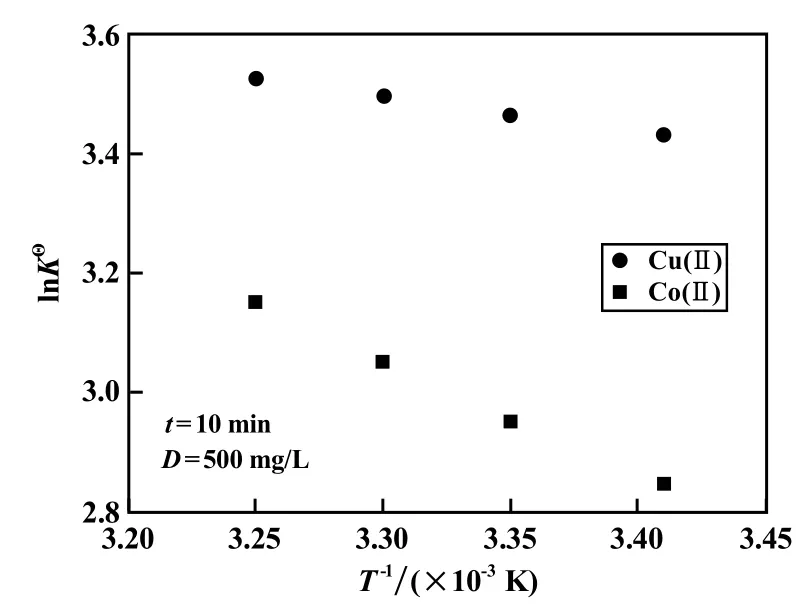
图8 Van′t Hoff方程拟合曲线
Van′t Hoff拟合结果表明:ΔG<0、ΔH>0、ΔS>0,表明吸附为热力学自发、吸热、熵增加的过程。熵增加表明,在吸附过程中水溶液-吸附剂的固液界面上的混乱度增加。随着温度升高,ΔG绝对值增大,即吸附的自发性增强,这说明升温对吸附有利。这是因为升温促进石墨烯表面含氧官能团的电离,从而形成更多的吸附位点;同时升温加快布朗运动,促进吸附质向吸附剂表面的扩散,同时增加吸附质-吸附剂间的碰撞频率。
2.4 吸附机理
对MGO吸附重金属前后的X射线光电子能谱进行了对比。图9为MGO吸附前后的O1s精细谱。显然,吸附Cu(Ⅱ)、Co(Ⅱ)后,MGO的O1s精细谱的峰强、峰形、峰位三要素均发生了显著变化。吸附后峰强显著减弱;吸附前峰形为近乎左右对称的单一峰,吸附后对称性降低,并分裂为两个亚峰;MGO的O1s精细谱峰位位于531.6 eV,MGO-Cu的位于531.5 eV和530.0 eV,MGO-Co的位于532.0 eV和530.3 eV。这些变化表明,Cu(Ⅱ)、Co(Ⅱ)与MGO的含氧官能团之间存在化学作用力,吸附为化学吸附。该结论与吸附等温模型、动力学模型给出的结果互为支撑。
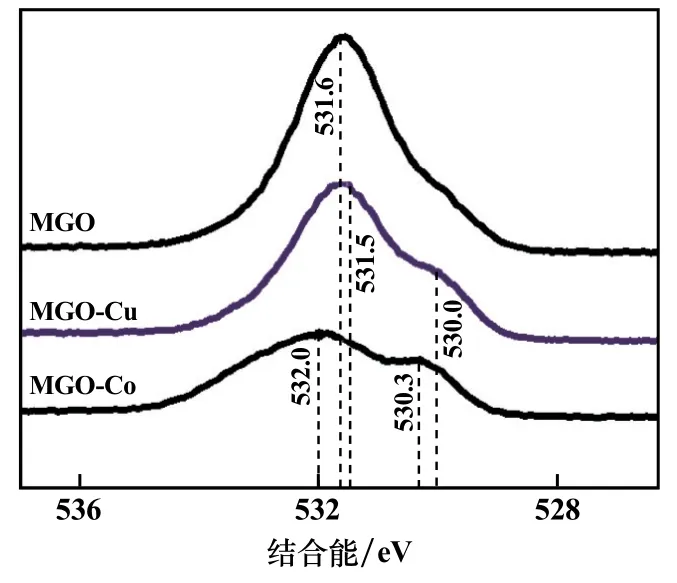
图9 吸附前样品(MGO)和吸附后样品(MGO-Cu、MGO-Co)的O1s精细谱
3 结 论
1)制备了磁性氧化石墨烯(MGO)吸附剂,并用于去除水中的Cu(Ⅱ)和Co(Ⅱ),当MGO用量为500 mg/L时,其对水中Cu(Ⅱ)和Co(Ⅱ)(初始浓度均为600.53 mg/L)的吸附分别于7 min和5 min达到平衡,对Cu(Ⅱ)的吸附率和吸附量分别为92.77%和1 114.22 mg/g,对Co(Ⅱ)的吸附率和吸附量分别为88.74%和1 065.81 mg/g。
2)MGO对Cu(Ⅱ)和Co(Ⅱ)的平衡吸附宜用Freundlich等温模型描述,非平衡吸附宜用准二级动力学模型描述。吸附以化学吸附为主,为热力学自发、吸热过程。吸附基于MGO的含氧官能团对Cu(Ⅱ)和Co(Ⅱ)的化学作用力。
3)MGO吸附剂对水中Cu(Ⅱ)和Co(Ⅱ)具有快速高效的吸附性能,是一种应用前景良好的重金属吸附材料。
