半胱氨酸辅助的酶@ZIF-8固定化酶制备及其特性研究
2021-09-14孙宝婷邱萌霞王子辰王梓源崔建东贾士儒
孙宝婷 邱萌霞 王子辰 王梓源 崔建东 贾士儒
(天津科技大学 省部共建食品营养与安全国家重点实验室,天津 300457)
苯丙氨酸解氨酶(PAL)是苯丙烷类代谢的关键酶和限速酶,主要分布于植物、红酵母中,在一些藻类和原生动物体内也含有一定量的PAL[1]。PAL可催化苯丙氨酸(L-Phe)生成反式肉桂酸(t-CA)和氨。在生物化工行业中,是酶法合成苯丙氨酸的关键酶。在医药行业中,PAL可被用于诊断和治疗部分肿瘤、酪氨酸代谢异常以及苯丙酮尿 症[2-4]。但是,游离的PAL稳定性差,在人体内抗原性强、半衰期短,降低了其应用效果。
有机金属骨架材料(metal-organic frameworks)是一种由金属离子和有机配体通过配位键连接而成的配位聚合物[5-6]。具有可调节的超高孔隙率、高比表面积、高结晶度、高机械稳定性、良好的光电性能等优势特性[7-9],在医药和催化等领域得到了广泛的研究。通常,MOFs被用作气体吸附、分离、催化和药物递送等,近年来在酶的固定化方向有一定的应用,例如脂肪酶[10-11]、葡萄糖氧化酶[12]、甘油脱氢酶[13]、有机磷酸水解酶[14]、尿酶[15]等。有机金属骨架材料中,ZIF-8是材料中研究最广泛的一种,可以在水溶液中以2-甲基咪唑为有机配体,与金属Zn2+构成笼状配位化合物,由于其制备条件温和、多孔的三维结构以及比表面积大等特点,在吸附[16-18]、分离[19-20]、催化[21-23]、生物医学[24-26]和生物检测器[27]等领域展现了广阔的应用前景。
研究表明,ZIF-8可以作为酶固定化的载体,对酶起到一定的保护作用[28-31],固定后酶的稳定性有所提高。以ZIF-8为载体固定酶主要有两种方式,一种是通过吸附的方式将酶固定在预先制备好的ZIF-8上,但是,由于酶通过较弱的作用力(如氢键、范德华力等)结合在ZIF-8表面,酶易从ZIF-8上脱落流失,稳定性差,而且,由于酶直接暴露在载体表面,容易受到外界环境的影响而失活。另一种方式是将酶加入到ZIF-8前体物中,在ZIF-8形成过程中将酶与ZIF-8晶体共沉淀包埋ZIF-8的空隙和网格中,这种方法制备的固定化酶稳定性好,对酶的保护效果好,应用较为普遍。但是,被包埋酶蛋白表面电荷的不同,会直接影响到酶蛋白在ZIF-8中的包埋效率,导致所制备的固定化酶活回收率较低。研究表明,表面电荷低的酶蛋白更容易被包埋在ZIF-8中[28-32]。因此,有必要开发新的方法来提高酶在ZIF-8中的包埋效率和酶活回收率。
研究表明,一些氨基酸可以辅助增强ZIF-8包埋酶的效率[30]。本研究以半胱氨酸(Cys)为辅助剂包裹在PAL表面以遮蔽蛋白表面电荷,然后基于共沉淀包埋策略,利用Cys中的巯基具有富集亲和金属离子的特性,加速Zn2+和2-甲基咪唑在PAL酶蛋白周围结晶形成ZIF-8外壳(图1),从而提高PAL在ZIF-8中的包埋效率和酶活回收率,采用响应面法优化了PAL固定化酶(PAL@ZIF-8)的制备条件,并检测了其催化性能。

图1 半胱氨酸辅助的PAL@ZIF-8制备过程Fig.1 Cysteine-assisted preparation of PAL@ZIF-8
1 材料与方法
1.1 材料
来源于重组大肠杆菌的PAL(0.02 U/mg)保存于本实验室;2-甲基咪唑、聚乙烯吡咯烷酮(MW8000),上海阿拉丁生化科技股份有限公司;醋酸锌、磷酸氢二钠、磷酸二氢钠、柠檬酸、柠檬酸钠,福晨(天津)化学试剂有限公司;L-半胱氨酸、苯丙氨酸,北京索莱宝科技有限公司。所有化学试剂均为分析纯。
场发射高分辨扫描电子显微镜(FEI-Apreo),FEI公司;激光扫描共聚焦显微镜(FV1000),日本Olympus有限公司;冷冻干燥机(LGJ-10),北京松源华兴科技发展有限公司;pH计(FE20),梅特勒-托利多仪器(上海)有限公司;恒温水浴锅(HH6),常州荣华仪器制造有限公司;紫外分光光度计(UV-6100),上海美谱达仪器有限公司;磁力搅拌器(B15-1),上海思乐仪器有限公司;台式高速冷冻离心机(H2050R),湖南湘仪离心机仪器有限公司。
1.2 方法
1.2.1 PAL在ZIF-8的合成 将1 mg的PAL(0.02 U)溶解于2 mL 超纯水中,依次加入2 mg PVP(MW:8 000)和4 mg Cys搅拌至溶解,然后分别加入2 mL 160 mmol/L 2-甲基咪唑和2 mL 40 mmol/L醋酸锌,室温放置4 h,离心收集沉淀,超纯水洗涤3遍。
1.2.2 酶活测定方法 由于PAL转化L-Phe生成的反式肉桂酸在278 nm下有吸光值,并且在一定范围内,反式肉桂酸浓度与吸光值成线性关系。采用紫外分光光度计法测量PAL的酶活,PAL酶活单位(U)定义在一定条件下1 min内催化L-Phe生成1 μmol反式肉桂酸所需要的酶量。测定条件如下:1.5 mL离心管中依次加入490 μL pH 8.8 Tris-HCL、500 μL 50 mmol/L L-Phe和10 μL PAL或PAL@ZIF-8,40℃反应10 min,然后加入40 μL 4 mol/L HCl终止反应,10 000 × g离心后,在278 nm紫外波长下测量上清液的吸光值。绘制反式肉桂酸标准曲线如图2所示,酶活计算公式如下:

图2 反式肉桂酸标准曲线Fig.2 Standard curve of trans-cinnamic acid

式中 C:反式肉桂酸的浓度(mg/L);V:反应体系的体积(mL);MW:反式肉桂酸的分子量(148.16 g/mol);T:反应时间(10 min)。
1.2.3 酶蛋白负载率和酶活回收率

1.2.4 单因素实验
1.2.4.1 2-甲基咪唑浓度对PAL@ZIF-8酶活回收率的影响 将1 mg的PAL(0.02 U)溶解于2 mL 超纯水中,依次加入2 mg PVP(MW:8000)和4 mg Cys搅拌至溶解,然后分别加入2 mL 40 mmol/L醋酸锌和2 mL 100-1 000 mmol/L 2-甲基咪唑,室温放置4 h,10 000 × g离心收集沉淀,超纯水洗涤3遍。参照1.2.2方法进行酶活测定,并计算酶活回收率。
1.2.4.2 醋酸锌浓度对PAL@ZIF-8酶活回收率的影响 将1 mg的PAL(0.02 U)溶解于2 mL 超纯水中,依次加入2 mg PVP(MW:8 000)和4 mg Cys搅拌至溶解,然后分别加入2 mL 10-180 mmol/L醋酸锌和2 mL 200 mmol/L 2-甲基咪唑,室温放置4 h,10 000×g离心收集沉淀,超纯水洗涤3遍。参照1.2.2方法进行酶活测定,并计算酶活回收率。
1.2.4.3 Cys浓度对PAL@ZIF-8酶活回收率的影响 将1 mg的PAL(0.02 U)溶解于2 mL 超纯水中,依次加入2 mg PVP(MW:8 000)和0-9 mg Cys搅拌至溶解,然后分别加入2 mL 60 mmol/L醋酸锌和2 mL 200 mmol/L 2-甲基咪唑,室温放置4 h,10 000 × g离心收集沉淀,超纯水洗涤3遍。参照1.2.2方法进行酶活测定,并计算酶活回收率。
1.2.4.4 PVP浓度对PAL@ZIF-8酶活回收率的影响 将1 mg的PAL溶解于2 mL 超纯水中,依次加入0-9 mg PVP(MW:8 000)和4 mg Cys搅拌至溶解,然后分别加入2 mL 60 mmol/L醋酸锌和2 mL 200 mmol/L 2-甲基咪唑,室温放置4 h,10 000 × g离心收集沉淀,超纯水洗涤3遍。参照1.2.2方法进行酶活测定,并计算酶活回收率。
1.2.4.5 数据处理与统计分析方法 在单因素实验的基础上,采用Design-expert v11.0.4软件进行响应面中心组合试验Box-Behnken做进一步的优化。
1.2.5 PAL@ZIF-8的催化性能
1.2.5.1 最适催化温度 将10 μL游离PAL和PAL@ZIF-8分别加入490 μL 50 mmol/L Tris缓冲液(pH 8.8)和500 μL 50 mmol/L L-Phe反应体系中,在20℃-70℃水浴锅内进行酶促反应10 min,加入40 μL HCl(4 mol/L)终止反应,10 000 × g离心后,测上清液在278 nm下的吸光值,计算酶活,确定最佳催化温度。
1.2.5.2 最适催化pH值 将10 μL游离PAL和PAL@ZIF-8分别加入490 μL不同pH的缓冲液(pH 3.0-11.0)和500 μL 50 mmol/L L-Phe反应体系中,在40℃水浴锅内进行酶促反应10 min,加入40 μL HCl(4 mol/L)终止反应,10 000 × g离心后,测上清液在278 nm下的吸光值,计算酶活,确定最佳反应pH。
1.2.5.3 温度耐受性 取相同酶活的游离PAL和PAL@ZIF-8分别加入490 μL 50 mmol/L Tris缓冲液(pH 8.8)和500 μL 50 mmol/L L-Phe反应体系中,置于50℃水浴锅中,分别在处理10、20、30、40和50 min时取出,冷却至室温,40℃进行酶促反应10 min,加入40 μL HCl(4 mol/L)终止反应,10 000 × g离心后,测上清液在278 nm下的吸光值,计算酶活。
1.2.5.4 pH耐受性 取相同酶活的游离PAL和PAL@ZIF-8分别在50 mmol/L 柠檬酸-柠檬酸钠缓冲液(pH 3.0、5.0)及50 mmol/L Tris-HCl缓冲液(pH 7.0、9.0、11.0)中处理1 h,40℃进行酶促反应10 min,加入40 μL HCl(4 mol/L)终止反应,10 000 × g离心后,测上清液在278 nm下的吸光值,计算酶活。
1.2.5.5 重复使用性 取0.5 mL PAL@ZIF-8,2 mL 50 mmol/L Tris-HCl(pH 8.8)缓 冲 液 和2.5 mL 50 mmol/L L-Phe;40℃反应10 min,10 000 × g离心后,测上清液在278 nm下的吸光值。将所得沉淀用去离子水洗一遍,重新悬浮于2.5 mL 50 mmol/L Tris-HCl(pH 8.8)缓冲液,涡旋使其分散均匀,加入2.5 mL 50 mmol/L L-Phe再次进行酶促反应后测定上清液在278 nm下的吸光值。重复测定10次,确定PAL@ZIF-8重复使用稳定性。
1.2.5.6 储存稳定性 取相同酶活的PAL和PAL@ZIF-8在室温下储存,每隔1 d取出一部分测定酶活,比较二者的储存稳定性。
1.2.5.7 PAL和PAL@ZIF-8的表观动力学 利用双倒数法测定Km和Vmax,即将50 mmol/L L-Phe分别稀释为25 mmol/L、12.5 mmol/L、5 mmol/L、2.5 mmol/L的不同浓度的L-Phe,进行游离PAL、PAL@ZIF-8的催化反应,测其A278nm。
1.2.6 PAL@ZIF-8的表征 利用美国捷克场发射高分辨扫描电子显微镜(FEI Apreo)、日本Olympus激光扫描共聚焦显微镜(FV1000)、德国布鲁克傅里叶变换红外光谱仪(TENSOR 27)对PAL@ZIF-8进行表征。
2 结果
2.1 单因素对PAL@ZIF-8酶活回收率的影响
单因素对PAL@ZIF-8酶活回收率的影响由图3所示。由图3-A可知,随着2-甲基咪唑浓度的增加,PAL@ZIF-8的酶活回收率也在增加,当2-甲基咪唑浓度为200 mmol/L时,PAL@ZIF-8的酶活回收率达到最高,为52.68%,进一步增加2-甲基咪唑浓度,PAL@ZIF-8的酶活回收率反而下降,因此选择200 mmol/L 2-甲基咪唑浓度作为后续优化实验的条件。由图3-B可知醋酸锌浓度过低或过高都不利于PAL@ZIF-8酶活回收率,当醋酸锌浓度为60 mmol/L时,PAL@ZIF-8的酶活回收率达到最高,为55.56%,因此以2-甲基咪唑浓度为200 mmol/L和醋酸锌浓度为60 mmol/L作为后续优化实验的条件。由图3-C得出,在4 mL制备体系中,当Cys的添加量为4 mg时,PAL@ZIF-8的酶活回收率达到最高,为54.66%,因此选用Cys添加量4 mg作为后续优化实验的条件。同时,在4 mL制备体系中,当PVP添加量为2 mg时,PAL@ZIF-8的酶活回收率最高达到54.09%,且随着PVP添加量的继续增加PAL@ZIF-8的酶活回收率并未出现明显增加(图3-D),因此选用PVP添加量2 mg作为后续优化实验的条件。

图3 各因素对PAL@ZIF-8酶活回收率的影响Fig.3 Influence of various factors on the recovery of PAL@ZIF-8 activity
2.2 响应面实验设计与结果
由上述单因素实验结果可知,2-甲基咪唑浓度、醋酸锌浓度和Cys添加量对PAL@ZIF-8的酶活回收率影响较大,且2-甲基咪唑浓度在100-300 mmol/L,醋酸锌浓度在40-80 mmol/L,以及Cys添加量在3-5 mg的范围内时PAL@ZIF-8的酶活回收率较高,因此选定2-甲基咪唑浓度(A,mmol/L)、醋酸锌浓度(B,mmol/L)和Cys添加量(C,mg)为3个实验因素,采用响应面中心组合试验Box-Behnken进一步设计优化不同因素下PAL@ZIF-8的酶活回收率,以PAL@ZIF-8的酶活回收率(Y,%)为响应值探讨各因素对PAL@ZIF-8酶活回收率的影响及其相互作用关系,以期获得PAL@ZIF-8的最优制备条件。响应面实验因素及水平表如表1所示。Box-Behnken实验设计表及响应值如表2所示。

表1 响应面实验因素及水平表Table 1 Test factors and level table of response surface
Design-expert软件对Box-Behnken实验设计结果如表2所示,利用该软件对实验结果进行二次多项回归拟合,得回归方程:Y=-332.8945+1.0551×A + 2.17861×B+107.4455×C-0.000501×AB-0.0191× AC+ 0.1205×BC-0.00231×A2-0.022862×B2-14.06225×C2。

表2 Box-Behnken实验设计及响应值Table 2 Box-Behnken experimental design and response values
公式中Y表示PAL@ZIF-8的酶活回收率,A表示2-甲基咪唑浓度(mmol/L),B表示醋酸锌浓度(mmol/L),C表示Cys添加量(mg)。
通过软件分析,得出的模型方差分析结果如表3所示,模型P<0.0001,失拟项P=0.0581>0.05,此外,该模型的校正确定系数R2=0.9891(表4)。

表4 模型的可信度分析Table 4 Reliability analysis of the model
由表3中方差分析可知,2-甲基咪唑浓度、醋酸锌浓度和Cys含量的一次项P值均小于0.01,模拟交互项中,BC影响显著(P<0.05),模拟平方项中A2,B2,C2影响极显著(P<0.01)。

表3 Box-Behnken实验设计方差分析表Table 3 Analysis for regression equation of Box-Behnken design
各因素在合成PAL@ZIF-8过程中对PAL@ZIF-8酶活回收率影响的3D和等高线分析图见图4,PAL@ZIF-8酶活回收率随着2-甲基咪唑浓度、醋酸锌浓度和Cys含量的增加而增加,当达到各因素的峰值时,随之减小。
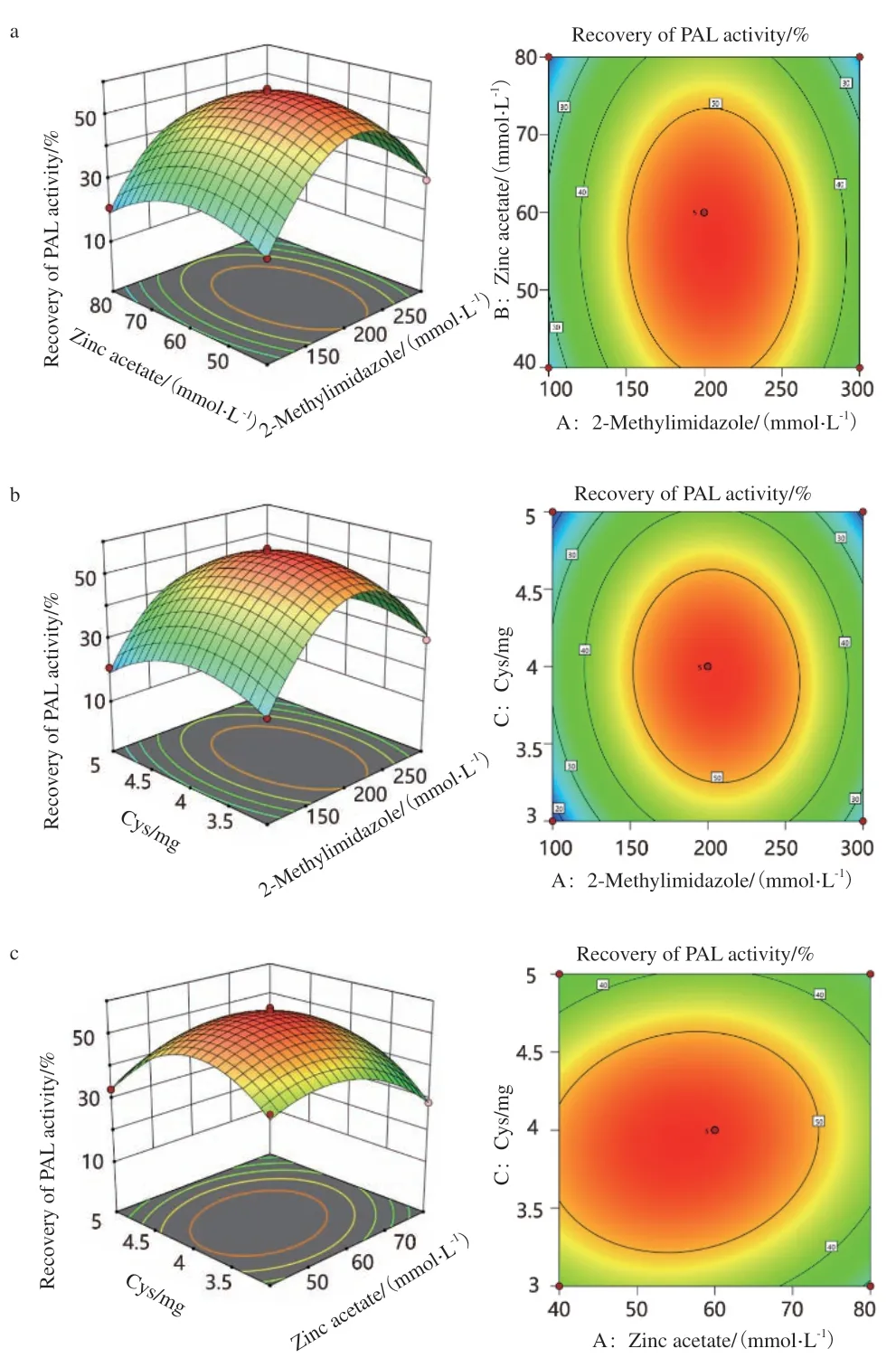
图4 各因素交互作用对苯丙氨酸解氨酶酶活回收率影响的响应面图和等高线图Fig.4 Response surface plot and contour plot of the effect of interaction of various factors on the recovery of PAL activity
由以上结果可得,半胱氨酸辅助的最佳PAL@ZIF-8制备条件为:200 mmol/L 2-甲基咪唑、60 mmol/L醋酸锌和4 mg Cys,2 mg PVP。
2.3 PAL@ZIF-8的表征
由图5-B可见,半胱氨酸参与合成的PAL@ZIF-8呈球体,大小约为5-8 μm,而常规方法合成的ZIF-8为正十二面体型(如图5-B所示),直径大约为1 μm。此外,利用荧光显微镜下观察经异硫氰酸荧光素(FITC)标记的PAL制备出的PAL@ZIF-8,可以清晰地看到PAL@ZIF-8颗粒散发出绿色荧光(图6)。能谱仪对元素的分析结果如图7所示,PAL和ZIF-8中都不含S元素(图7-a和7-b),但是,L-Cys含有硫元素(图7-c),同时在半胱氨酸辅助的PAL@ZIF-8中也含有S元素(图7-d)。这个结果证明L-Cys参与了PAL@ZIF-8的合成。

图5 PAL@ZIF-8扫描电镜图Fig.5 Scanning electron microscope(SEM)of PAL@ ZIF-8

图6 PAL@ZIF-8激光扫描共聚焦显微镜图Fig.6 Laser scanning confocal microscopy of PAL@ZIF-8

图7 ZIF-8、PAL、L-Cys和PAL@ZIF-8的能谱图Fig.7 Energy disperse spectroscopy spectrum of ZIF-8,PAL,L-Cys and PAL@ZIF-8
2.4 PAL@ZIF-8催化性能研究结果
由图8中A、C可知,PAL@ZIF-8与游离PAL最适催化温度和最适催化pH值相同,但PAL@ZIF-8的温度和pH适用范围比游离的PAL更广泛。另外,在50℃处理条件下(图8-B),随着时间的延长,游离PAL与PAL@ZIF-8的酶活残留率呈递减趋势,当处理至30 min时,游离PAL的酶活残留率只剩15.81%,而PAL@ZIF-8的酶活残留率还能保留41.96%。图8-C表明,游离PAL和PAL@ZIF-8的最适催化pH都为9.0。但是,游离PAL表现出比PAL@ZIF-8都低的酸碱耐受性(图8-D),在酸性条件下,游离PAL基本丧失酶活,而PAL@ZIF-8仍能保持50%-60%的残留酶活,在pH值为11的条件下,游离PAL的酶活残留率为62.47%,PAL@ZIF-8的残留酶活为83.96%。与游离PAL相比,PAL@ZIF-8的Km值较大,反应速率降低(表5)。

表5 PAL与PAL@ZIF-8的表观动力学常数Table 5 Comparison of apparent kinetic parameters of free PAL and PAL@ZIF-8
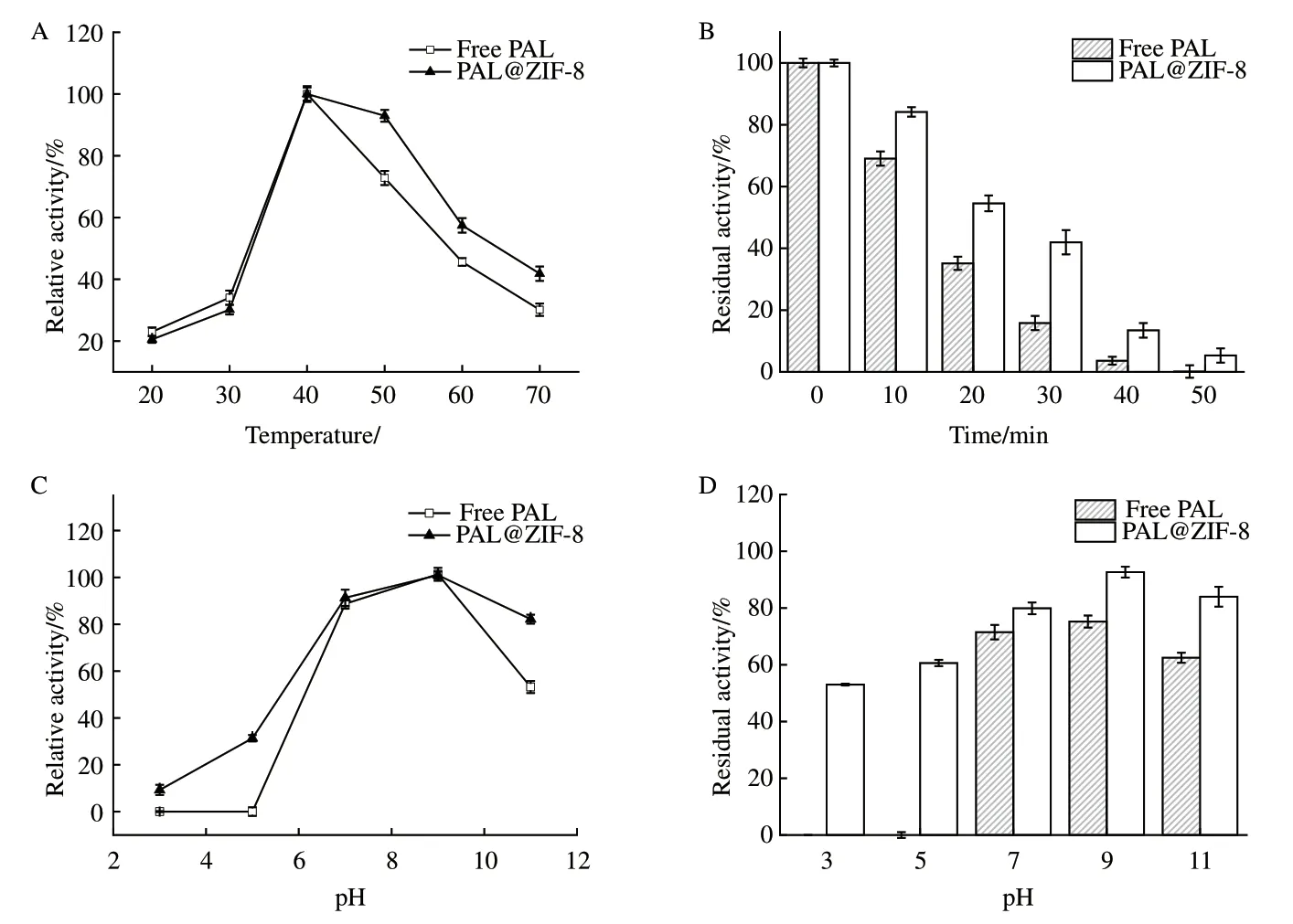
图8 PAL@ZIF-8的催化性能Fig. 8 Catalytic performance of PAL@ZIF-8
另外,与不添加Cys的传统共沉淀包埋法相比,在相同PAL浓度条件下,Cys辅助制备的PAL@ZIF-8酶蛋白负载率增加了12%,酶活回收率增加了40%(表6)。表明该方法可以高效将酶蛋白包埋在ZIF-8中。

表6 负载率及酶活回收率对比Table 6 Comparison of load rate and recovery of PAL activity
图9-A是PAL@ZIF-8的重复使用稳定性结果,结果表明PAL@ZIF-8残留酶活率随着使用次数的增加逐渐降低,在重复使用了7次之后,PAL@ZIF-8仍保留初始酶活的60%以上,表明PAL@ZIF-8有较好的重复使用稳定性。同时,储存稳定性结果表明,PAL@ZIF-8在室温下储存19 d仍可保持70%以上的初始酶活,但游离PAL已经失活(图9-B)。说明PAL@ZIF-8储存稳定性良好。

图9 PAL@ZIF-8重复使用性及储存稳定性Fig. 9 Reusability and storage stability of PAL@ZIF-8
3 讨论
3.1 单因素对PAL@ZIF-8酶活回收率的影响
固定化苯丙氨酸解氨酶的其他方法中,酶活回收率低,或分散性较差[33-34],对进一步的应用有所限制。而使用传统合成PAL@ZIF-8方法,虽分散性较好,但所得酶活回收率为13.38%,按照1.2.1中Cys参与PAL@ZIF-8的初始合成方法,所得酶活回收率为30.16%±3.24%,不能满足后续应用需要,因此对Cys参与PAL@ZIF-8的合成方法进行优化。合成过程中,2-甲基咪唑浓度太低,难以形成ZIF-8,不能将PAL充分包埋在ZIF-8中,但是,2-甲基咪唑浓度过高,碱性过强,易使PAL酶失活,导致PAL@ZIF-8的酶活回收率降低。其中,醋酸锌的浓度过低或过高都不利于PAL@ZIF-8酶活回收率。当Cys添加量为4 mg时,酶活回收率最高,在该合成过程中,Cys中的巯基富集金属离子,添加量过大,影响蛋白与金属离子的结合,因此酶活回收率变低,当添加量较少时,金属Zn2+对PAL的酶活力有影响,对PAL的活性中心的保护作用较小,因此当Cys添加量为4 mg时,可得到最高的酶活回收率。而PVP在合成过程中有利于各个组分的分散,达到一定量后,酶活回收率不再升高。因此,选用200 mmol/L 2-甲基咪唑、60 mmol/L醋酸锌、4 mg Cys、2 mg PVP作为后续优化实验的条件。
3.2 响应面实验设计与结果
通过软件分析,得出的模型方差分析结果,模型P<0.0001,表明对PAL@ZIF-8酶活回收率所建立的二项式模型具有显著性,失拟项P=0.0581>0.05,无失拟现象,说明在本实验中,使用该方程预测PAL@ZIF-8酶活回收率的方法是可行的。此外,该模型的校正确定系数R2=0.989 1,表明模型可以解释98.91%的响应值的变化,实验误差小,因此可用该方程对实验结果进行分析。
由表中方差分析可知,2-甲基咪唑浓度、醋酸锌浓度和Cys含量的一次项P值均小于0.01,说明这3项对PAL@ZIF-8的酶活回收率影响达到了极显著的水平,模拟交互项中,BC影响显著,模拟平方项中A2,B2,C2影响极显著,说明这3项对苯丙氨酸解氨酶的酶活回收率影响顺序为醋酸锌浓度>2-甲基咪唑浓度>Cys添加量。
由各因素在合成PAL@ZIF-8过程中对PAL@ZIF-8酶活回收率影响的3D和等高线分析图可知,PAL@ZIF-8酶活回收率随着2-甲基咪唑浓度、醋酸锌浓度和Cys含量的增加而增加,当达到各因素的峰值时,随之减小。图中,醋酸锌浓度的等高线图较2-甲基咪唑浓度和Cys含量的等高线更密集,说明醋酸锌浓度对PAL@ZIF-8酶活回收率影响更显著,与方差分析结果一致。
综合分析以PAL@ZIF-8酶活回收率为响应值的拟合模型,预测出最佳PAL@ZIF-8制备条件为:200 mmol/L 2-甲基咪唑、60 mmol/L醋酸锌和4 mg Cys,2 mg PVP,在此条件下预测所得PAL@ZIF-8酶活回收率为56.97%。同时在此条件下,进行了3次平行验证实验,测得PAL@ZIF-8酶活回收率为(56.15±0.94)%,与预测值相符,表明响应面Box-Behnken设计的最佳条件可靠,具有准确性和实用性。
3.3 PAL@ZIF-8的表征
Cys参与合成的PAL@ZIF-8呈球体,与传统ZIF-8多面体型[35]或十字花型不同[36],且直径较传统PAL@ZIF-8大,这种形态上的变化可能是由于Cys上丰富的巯基富集了Zn2+,改变了2-甲基咪唑与Zn2+的结合状态,同时,Cys在酶蛋白周围的包裹遮蔽了酶蛋白表面电荷,使酶蛋白与ZIF-8间的作用减少,从而导致ZIF-8的形态发生变化。通过荧光显微镜观察到被FITC标记的PAL被包埋在ZIF-8颗粒中,因此成功制备出PAL@ZIF-8固定化酶。Cys中的巯基对多种重金属有高度的亲和性[37],巯基中含有硫元素,因此可以通过测定PAL@ZIF-8中是否含有硫元素来验证Cys是否参与合成PAL@ZIF-8。通过能谱仪对元素的分析结果可知,空载体ZIF-8、游离PAL都不含有硫元素,但在Cys和PAL@ZIF-8中都观察到了硫元素,这个结果表明Cys参与了PAL@ZIF-8的合成。
3.4 PAL@ZIF-8催化性能研究结果
Cys参与合成的PAL@ZIF-8与游离PAL相比,最适催化温度和最适催化pH值相同,但其温度耐受性和pH耐受性优于游离PAL,PAL@ZIF-8耐受高温及极端pH环境的能力比游离PAL更强,耐受范围更广。Cys参与合成的PAL@ZIF-8稳定性的提高可能是由于酶在固定化过程中,被ZIF-8致密的纳米孔腔包围,使酶的构象在孔内保持稳定,可以维持一定的酶活性,因此表现出良好的温度耐受性及pH耐受性,且Cys参与合成的PAL@ZIF-具有较好的重复使用性和储存稳定性,但是,与游离PAL相比,由于载体的存在,PAL@ZIF-8的Km值较大,表明底物与PAL@ZIF-8间的传质阻力大,亲和力小,从而造成PAL@ZIF-8反应速率降低。Cys参与的PAL@ZIF-8与传统PAL@ZIF-8相比,蛋白负载率和酶活回收率都有提高,表明该方法可以高效将酶蛋白包埋在ZIF-8中。
4 结论
通过Cys辅助法制备了PAL@ZIF-8,在单因素实验的基础上,通过响应面设计优化得到了PAL@ZIF-8最佳制备条件:0.17 mg/mL PAL,0.33 mg/mL PVP(Mw:8 000),0.67 mg/mL Cys,60 mmol/L醋 酸锌和200 mmol/L 2-甲基咪唑,在此优化条件下所得PAL@ZIF-8固定化酶酶活回收率为56.15±0.94%,比优化前提高了近25%。该方法所得的PAL@ZIF-8具有良好的温度和pH耐受性,室温储存稳定性以及良好的重复使用性,酶的负载率及酶活回收率均有提高,是一种高效的酶固定化策略。
