一色齿毛菌漆酶LacT-1的分离纯化与性质研究
2021-09-14田嘉慧封佳丽卢俊桦毛林静胡著然王莹楚杰
田嘉慧 封佳丽 卢俊桦 毛林静 胡著然 王莹 楚杰
(1 齐鲁工业大学(山东省科学院)生物研究所,济南 250103;2山东省碧蓝生物科技有限公司,宁阳 271400)
漆酶(laccase,EC 1. 10. 3. 2)属于蓝多铜氧化酶(blue multi-copper oxidases,BMCOs)家族,是一种含铜多酚氧化酶[1]。相较于其他来源的漆酶,真菌产漆酶具有底物范围广、作用条件较温和、活性稳定、无副产物等特点。漆酶在生物体内参与多种代谢过程,如木质素降解、细胞壁构建等[2]。漆酶具有较广泛的应用前景,在降解染料、造纸、食品、农业、环境保护、生物传感器等方面都可以发挥比较大的作用[3]。
真菌产漆酶的方式主要有固体发酵和液体深层发酵,真菌漆酶的大小一般为50-90 kD,其最适温度范围为25-80℃,最适pH在2.0-5.0之间,Fe2+对真菌漆酶有强烈抑制作用,其他化合物也可以不同程度的抑制漆酶的催化进程[4-7]。不同来源漆酶的酶学性质存在一定差异,作用条件也各不相同,因此,分离纯化出一种活性不易受到其他外界因素影响且作用及保存条件较温和的漆酶是十分必要的。
近年来对一色齿毛菌漆酶的研究取得了一定的进展,研究内容主要集中在以下两个方面:一是提高漆酶产量,主要方法有基因调控[8]、优化分离纯化方式[9]、使用不同波长光照或者添加诱导物等手段调控发酵条件[10-11]等;二是拓展漆酶的应用范围,Deniz等[12]研究了漆酶对染料的脱色效率与染料种类和发色基团的关系,Anna等[13]发现一色齿毛菌漆酶具有抗白血病细胞活性,Polak等[14]研究发现漆酶可以合成具有抗菌和抗氧化活性及良好染色性能的新型纺织染料。本研究以漆酶活性较高的一色齿毛菌为试验对象,玉米秸秆为碳源对其进行液态发酵,通过(NH4)2SO4沉淀、疏水层析(phenyl sepharose fast flow)、离子层析(DEAE sepharose fast flow)、凝胶层析(TSK gel G2000SWxl)对漆酶进行分离纯化,然后对漆酶酶学性质进行研究,并利用纯化后漆酶降解8种常见的染料,探讨一色齿毛菌的生产潜力及漆酶的应用潜力。
1 材料与方法
1.1 材料
1.1.1 菌株 试验用菌株一色齿毛菌,由山东省科学院生物研究所工业微生物实验室提供,并进行18S rDNA鉴定(Accession number:MW150799)。
1.1.2 设备和试剂 AKTA purifier 蛋白纯化系统(GE);HiTrap Phenyl FF(GE);HitrapTMDEAE(GE);GEL G2000SWxl(TSK);紫外分光光度计(普析TU-1901);酶标仪(TECAN infinite M200PRO)。 2,2’-联氮-双-3-乙基苯并噻唑啉-6-磺酸,简称ABTS,Solarbio;其他试剂均为国产分析纯,国药集团有限公司。
1.1.3 培养基及培养条件 液态发酵培养基(pH 5.0):酵母浸粉(2.0 g/L),NaNO3(3.0 g/L),KH2PO4(0.8 g/L),K2HPO4(0.2 g/L),CuSO4·5H2O(0.0125 g/L),MgSO4·7H2O(0.5 g/L),MnSO4(0.034 g/L),玉 米秸秆2.15 g/L。
培养条件:250 mL三角瓶装50 mL培养基接种一色齿毛菌于28℃、180 r/min摇床培养。
1.2 方法
1.2.1 酶活测定方法 本试验采用ABTS法测定漆酶活力:2.79 mL的乙酸缓冲液(0.05 mol/L,pH 3.8)与60 μL 0.05 mol/L的ABTS混合,再加入150 μL待测酶液,混合均匀于30℃反应1 min,420 nm条件下测定吸光度。

V总:表示反应体系的总体积,单位为mL;ΔOD表示吸光度在1 min内的变化量;ε表示摩尔消光系数,ABTS的吸光系数为36 000 L/(mol·cm);V酶表示加入待测酶液的体积,单位为mL;Δt为1 min;n为待测酶液稀释倍数。
1.2.2 漆酶的分离纯化 2 L发酵液上清依次经过饱和度为60%的(NH4)2SO4沉淀、疏水层析(0.05 mol/ L NaCl+0.02 mol/L、pH 7.0的NaH2PO4&Na2HPO4缓冲液(PB缓冲液)、DEAE离子层析(0.2 mol/L NaCl+0.02 mol/L、pH 7.0的PB缓冲液)、凝胶层析(0.1 mol/L Na2SO4+0.1 mol/L、pH 5.8的PB缓冲液)将漆酶LacT-1进行分离纯化,试验过程中样品的脱盐步骤均使用10 kD的超滤柱来完成。分离纯化后的漆酶进行SDS-PAGE电泳验证。
1.2.3 酶学性质研究
1.2.3.1 最适温度和温度稳定性 最适温度:在不同温度(0-70℃,梯度为10℃)下测定纯化后的漆酶活性,以活力最高值为100%,计算各组相对酶活。
温度稳定性:将纯化后的酶液在不同温度(0-70℃,梯度为10℃)保温1 h后,在最适温度条件下测漆酶活性,以活力最高值为100%,计算各组相对酶活。
1.2.3.2 最适pH和pH稳定性 最适pH:将纯化后的酶液在60℃、不同pH(3.2-8.0)条件下测漆酶活性,以活力最高值为100%,计算各组的相对酶活。
pH稳定性:将纯化后的酶液在不同pH(3.2-8.0)条件下,4℃保存24 h后,在60℃、pH4.8条件下测漆酶活性,以活力最高值为100%,计算各组的相对酶活。
1.2.3.3 离子对漆酶活性的影响 在反应体系中加入1 mmol/L金属离子(K+、Ca2+、Fe3+、Co2+、Zn2+、Mn2+、Cu2+、Mg2+、Fe2+),在最适温度和pH条件下测定漆酶活性,以未添加金属离子组为对照组,分析各金属离子对漆酶活性的影响。
1.2.3.4 化合物的影响 在反应体系中分别加入1 mmol/L或10 mmol/L的SDS、β-ME、DEAE-2Na、H2O2、抗坏血酸、草酸、TCA溶液,在最适温度和pH条件下,测定漆酶活性,以未添加化合物的LacT-1的酶活为100%,分析各化合物对漆酶活性的影响。
1.2.3.5 动力学常数的测定 在最适反应温度和pH条件下,改变ABTS浓度(0.25%-2.25%),测定漆酶反应初速度。通过Lineweaver-Burk双倒数图得到1/[V]和1/[S]的关系方程,计算米氏常数Km和酶被底物饱和时的速度Vmax。V表示反应速度(mmol/(L·min)),S表示底物浓度(mmol/L)。
1.2.3.6 染料降解 配制10 g/L的甲基橙、酸性红1、刚果红、活性黑5、考马斯亮蓝R250、孔雀石绿、结晶紫、溴酚蓝母液,将其稀释为100 mg/L,以去离子水为对照,在酶标仪紫外可见光区(200-900 nm)进行全波长扫描得到染料最大吸收波长。
反应体系为6 mL:60 μL染料(10 g/L),10 μL ABTS(0.05 mol/L),4.93 mL乙酸缓冲液(pH4.8,0.05 mol/L),1 mL的LacT-1酶液。反应体系置于40℃、150 r/min的摇床,每隔2 h测一次染料在其特征波长处的OD值,以未添加酶液的体系为对照[15],染料降解率计算公式如下:

A0表示未添加酶液反应体系的OD值,Ai表示添加酶液反应一定时间的OD值。
2 结果
2.1 LacT-1的分离纯化
通过产酶曲线(图1)可得,一色齿毛菌连续培养第7天时,漆酶活性最高为8 395.66 U/L。收集发酵上清,经(NH4)2SO4沉淀、疏水层析、离子层析、凝胶层析,最终收集到的样品通过SDS-PAGE电泳验证发现为单条带,大小约为65 kD,表明经过以上实验过程得到了电泳纯的漆酶(图2)。该酶比活力为41.31 U/mg,纯化倍数为21.86,酶活回收率达到6.57%(表1)。

表1 一色齿毛菌漆酶各纯化步骤的纯化效率Table 1 Purification efficiency of each purification step of laccase from C. unicolor

图 1 一色齿毛菌的产酶曲线Fig.1 Enzyme production curve of C. unicolor

图2 SDS-PAGEFig.2 SDS-PAGE
2.2 LacT-1酶学性质
2.2.1 最适温度和温度稳定性 根据图3可知,LacT-1最适温度为60℃,在40℃时,漆酶的酶活可达71.75%,在80℃,酶活仍可保持65.64%;由图4可知,漆酶在40℃保存1 h后,LacT-1还具有65.57%的活性。

图 3 LacT-1的最适温度Fig.3 Optimal temperature of LacT-1

图4 LacT-1的温度稳定性Fig.4 Temperature stability of LacT-1
2.2.2 最适pH和pH稳定性 根据图5可知,Lac- T-1最适pH为4.8,在pH 4.0-5.0范围内,漆酶的酶活可达80%以上:由图6可知,LacT-1在pH 5.4-8.0保存24 h后,漆酶活性仍可保持在80%以上。

图5 LacT-1的最适pHFig.5 Optimal pH of LacT-1
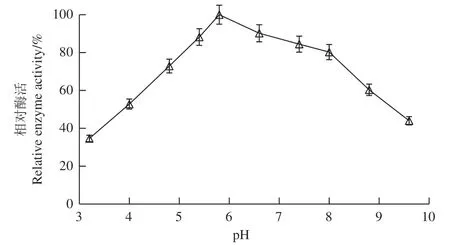
图6 LacT-1的pH稳定性Fig.6 pH stability of LacT-1
2.2.3 不同金属离子对LacT-1活性的影响 由图7可知,相同浓度的Na+、Cu2+对漆酶活性有不同程度的促进作用;K+、Ca2+、Fe3+、Co2+、Zn2+、Mn2+、Mg2+对漆酶酶活有不同程度的抑制,抑制程度由大到小依次为Mn2+>Fe3+>Zn2+>Co2+>Mg2+>K+>Ca2+,Fe2+则完全抑制漆酶活性。

图7 金属离子对LacT-1活性的影响Fig.7 Effect of metal ions on LacT-1 activity
2.2.4 化合物对LacT-1活性的影响 根据表2可知,不同的化合物对漆酶酶活均有一定程度的抑制作用,1 mmol/L β-ME完全抑制LacT-1活性;添加1 mmol/L SDS时,LacT-1活性仅保持在29.32%,SDS浓度增加到10 mmol/L时,LacT-1活性完全被抑制;DEAE-2Na浓度为1 mmol/L时,LacT-1活性仍保持89.64%,当浓度提高到10 mmol/L时,LacT-1活性仍可达到61.55%;1 mmol/L的H2O2对LacT-1活性有促进作用,而10 mmol/L的H2O2抑制漆酶活性;草酸对LacT-1的作用与H2O2相反,浓度为1 mmol/L时,草酸对LacT-1有抑制作用,当浓度增加到10 mmol/L时,草酸对LacT-1有较小程度的促进作用;TCA对LacT-1则是促进作用,当浓度达到10 mmol/L时,活性可达145.95%。

表2 化合物对LacT-1活性的影响Table 2 Effect of compounds on the activity of LacT-1
2.2.5 动力学常数的测定 在60℃和pH为4.8的条件下,添加不同浓度的ABTS(0.25%-2.25%),测定漆酶反应初速度。通过Lineweaver-Burk双倒数图得1/[V]和1/[S]的关系方程(图8),最终通过计算得到Km为0.075 mmol/L,Vmax为250 000 mmol/(L·min)。

图8 LacT-1酶学动力常数Fig.8 Kinetic enzyme constant of LacT-1
2.2.6 染料降解 由表3可知,LacT-1对孔雀石绿和结晶紫的降解率均达到90%以上,对甲基橙、酸性红1、活性黑5、考马斯亮蓝和溴酚蓝的降解率为70%以上,对刚果红的降解率仅有48.59%。

表3 LacT-1对染料的降解Table 3 Degradation of dyes by LacT-1
3 讨论
真菌漆酶自身氧化还原电动势高于其他生物产的漆酶,可以催化木质素、酚类、芳香族化合物等物质的降解,而这些物质处理不当会造成环境污染,因此,漆酶在实际生活中具有广阔的应用前景。迄今为止,关于漆酶的研究虽然取得了一定成果,但是大部分漆酶存在酶活不稳定、对一些化合物耐受力不强等问题,对漆酶基础和应用的研究需进一步发展。
本研究对一色齿毛菌进行液态发酵,发酵液上清经(NH4)2SO4沉淀、疏水层析、DEAE离子交换层析和凝胶层析纯化得到漆酶LacT-1,其大小约为65 kD,与Pleurotus eryngii var Tuoliensis漆酶的大小相同[4]。LacT-1的纯化倍数为21.86,回收率为6.57%。Bagewadi等[16]和马倩倩[17]研究表明,Trichoderma harzianum HZN10和Pleurotus ostreatus漆酶的纯化倍数分别为25,27.5,回收率分别为7%,6.5%,与本研究的纯化参数相近,但是与Wang等[18]发现的C. unicolor GSM-01漆酶纯化倍数30.64,回收率33.9%有一定差距。C. unicolor GSM-01发酵上清经DEAE Cellulose、SP-Sepharose、Q-Sepharose、Superdex 75实现纯化,其中DEAE Cellulose的纯化倍数为5.26,高于其他各方式的纯化倍数[18];根据表1,对比本文各纯化方式的纯化倍数可知,DEAE层析的纯化效率最高,所以在进行漆酶分离纯化的研究中,可
以考虑优先使用DEAE层析。
以ABTS为底物,LacT-1最适温度为60℃,与Pleurotus sp MAK-II[19]、Pleurotus ostreatus yu 6[20]和Echinodontium taxodii[21]的漆酶最适温度相同,但不同漆酶对温度的耐受性不同,Pleurotus sp MAKII漆酶在30-70℃保存1 h后活性可保持在50%以上,Pleurotus ostreatus yu 6在60℃保存0.5 h剩余酶活约50%,而Echinodontium taxodii漆酶在60℃保存1 h后剩余酶活只有30%。LacT-1在0-40℃的条件下保存1 h,其活性仍保留65.57%,所以LacT-1最佳实际应用温度为40℃。LacT-1的最适pH为4.8,与Pholiota nameko SW-01最 适pH相 同[22],而Pleurotus sp MAK-II、Echinodontium taxodii的 最适pH值分别为4.5、3.0。Pholiota nameko SW-01仅在弱酸环境中有较高活性,Pleurotus sp MAK-II漆酶在pH 3.5-6.0范围内保持其初始活性的60%以上,当pH > 7.5时,几乎没有活性;Echinodontium taxodii漆酶在pH 4.0-6.0条件下保存2 h后剩余酶活为80%以上;LacT-1在pH 5.4-8.0条件下保存24 h后,活性仍可保持在80%以上。与上述漆酶相比,LacT-1的pH稳定性更强,贮存条件对pH的要求比其他漆酶要广泛,并且其最适pH呈弱酸性,在实际应用中LacT-1对pH要求较低,在保证较高的活性同时节约了成本。
终浓度为1 mmol/L 的金属离子Cu2+、Na+对LacT-1有不同程度的促进作用,K+、Ca2+、Fe3+、Co2+、Zn2+、Mn2+、Mg2+对酶活有抑制作用,Fe2+则完全抑制酶活。Cu2+对LacT-1有一定促进作用,与刘芹等[23]发现的Cu2+对Pleurotus ostreat漆酶的作用一致,而窦隆等[24]研究发现Cu2+对sathyrella candollean漆酶有抑制作用,说明Cu2+对不同漆酶作用不同。由于漆酶属于蓝多铜氧化酶,可以以此为切入点,进一步对漆酶的催化机制进行研究[25]。此外,若想在实际应用中提高LacT-1活性,可以在反应体系中加入一定量的Na+。有研究表明,Fe2+有较强的还原性,对漆酶的抑制属于竞争性抑制,当Fe2+全部被氧化成Fe3+时,漆酶恢复催化作 用[5,26-27],在以ABTS为底物或介体时,可以利用Fe2+来延缓漆酶的氧化催化进程。
一些常见的化合物如SDS、β-ME、DEAE-2Na、抗坏血酸对LacT-1均有明显的抑制作用,其中以β-ME、抗坏血酸的抑制作用最为明显,在1 mmol/L时就可完全抑制漆酶活性,而10 mmol/L SDS也可以完全抑制漆酶活性。当DEAE-2Na浓度为1 mmol/L时,LacT-1活性为89.64%,当浓度提高到10 mmol/L,LacT-1还可剩余61.55%活性;在1 mmol/L的H2O2作用下LacT-1活性提高了23.66%,而同等浓度的H2O2则会抑制Treametes. pubescens MB89漆酶活性的9%[28];浓度为10 mmol/L的草酸可使LacT-1活性提高3.80%,而该浓度条件下的草酸完全抑制Flammulina velutipes漆酶活性[29];1 mmol/L TCA可以使LacT-1活性提高11.41%,10 mmol/L TCA则可以提高45.95%,而7.5 mmol/L的TCA可以抑制Bcillus thuringiens漆酶约50%活性[30]。综上所述,在利用LacT-1进行催化氧化作用时,要特别注意β-ME、SDS、抗坏血酸的存在,在浓度较低的DEAE-2Na、草酸环境中,LacT-1活性受的影响不是很大,若想提高LacT-1活性,则可以在反应体系中添加适宜浓度的H2O2和TCA。
LacT-1对ABTS的Km为0.075 mmol/L,低于Ganodermatsugae Murr(0.909 mmol/L)[7],Pleurotuseryngii(0.087 mmol/L)[25],Pleurotus ostreatus Het- erosis-2(2.1 mmol/L)[5],高于psathyrella candolleana(0.016 mmol/L)[31],Armillariella tabescens(0.018 mmol/L)[32],Km值表示与底物结合的能力,LacT-1对ABTS结合能力较强,为漆酶与ABTS构成介体系统进行实际应用提供了可能。
合成染料具有着色力强、色泽鲜艳、成本低等特点,目前已广泛应用于纺织、造纸、印刷等行业,但每年有10%-15%染料以废水的形式排放[33],对环境造成了极大地损坏。本文选择了甲基橙、酸性红1、刚果红、活性黑5、考马斯里亮蓝R250、孔雀石绿、结晶紫、溴酚蓝这8种比较常见的染料为降解对象,以ABTS为介体,试验结果表明,LacT-1对孔雀石绿、结晶紫的降解效果比较突出,降解率分别为95.17%、90.61%,Cerrena unicolor GSM-01[18]漆酶24 h后对孔雀石绿的降解率为86.2%,Cerrena unicolor BBP6[33]漆酶对结晶紫的最大降解率为83.97%,比LacT-1对孔雀石绿、结晶紫的降解效果稍差一些。而LacT-1对甲基橙、酸性红1、活性黑5、考马斯亮蓝和溴酚蓝的降解率均在70%以上,对刚果红的降解率也有48.59%,说明LacT-1在染料降解领域有比较大的应用潜力。
4 结论
本文所分离纯化的漆酶LacT-1活性较高,在温度为0-30℃保存1 h或pH 5.4-8保存24 h后酶活仍可保持80%以上,大部分金属离子对其影响不大,TCA对该酶酶活有明显的促进作用,LacT-1催化ABTS的Km值较低,对孔雀石绿、结晶紫降解率分别为95.17%、90.61%。但本文所采取的分离纯化方式仍需进一步改进,在未来的研究中可以进一步优化一色齿毛菌的发酵条件以及漆酶的分离纯化方式来获得高产漆酶,或者还可以对漆酶基因进行调控或修饰以改善漆酶的酶学性质。
