陆地棉耐碱基因GHZAT12的克隆、表达及生物信息学分析
2021-09-14范亚朋芮存张悦新陈修贵陆许可王帅张红徐楠王晶陈超叶武威
范亚朋 芮存 张悦新 陈修贵 陆许可 王帅 张红 徐楠 王晶 陈超 叶武威
(中国农业科学院棉花研究所 棉花生物学国家重点实验室,安阳 455000)
棉花作为一种重要的自然纤维经济作物在全世界广泛种植。与其他作物相比,棉花具有一定的耐盐碱性[1]。盐碱胁迫是危害农作物产量的一个重要因素。据统计,每年受盐碱胁迫危害的土地面积大约为8.31 × 109hm2,这个面积还在增加[2]。盐碱胁迫分为盐胁迫和碱胁迫,其中盐胁迫是由NaCl和Na2SO4造成的,碱胁迫是由Na2CO3和NaHCO3造成的。先前的研究主要集中在对于盐胁迫的研究,对于碱胁迫的研究知之甚少。研究发现,碱胁迫比盐胁迫的危害更严重[3]。
锌指蛋白(ZFPs)是植物中重要的一类蛋白,根据半胱氨酸和组氨酸残基的数量和位置可分为不同的种类,包括C2H2、C2HC5、C2C2、CCCH、C3HC4、C4、C4HC3、C6和 C8[4]。C2H2是ZFPs中的重要一类,植物中第一个C2H2锌指蛋白是在拟南芥中发现的[5]。拟南芥C2H2型锌指蛋白家族包括176个成员,是植物中最大的转录因子家族之一[6]。植物C2H2型转录因子包含了一个保守的QALGGH基序,可以参与识别下游靶基因启动子中的顺式调控元件[7]。研究发现,C2H2转录因子家族在植物的生长、发育以及非生物胁迫中起着重要的作用[4,8]。在水稻中,C2H2型转录因子ZFP182参与ABA介导的抗氧化防御系统[9]。在大豆中,两个C2H2型转录因子GmZFP1和GmZF1能增强转基因拟南芥对干旱和冷胁迫的耐受性[10-11]。在拟南芥中,GmZFP3基因的表达降低了干旱胁迫的耐受性,增加了拟南芥对PEG和ABA的响应[12]。ZFP182基因的表达受低温、干旱和ABA诱导,在烟草和水稻中异源表达该基因可以提高植物对高盐胁迫的耐性[10]。拟南芥STZ基因有两个C2H2结构域,其表达受到干旱、低温、高盐和ABA诱导。过表达STZ基因能提高拟南芥的抗旱性[13]。在拟南芥中过表达棉花C2H2型锌指蛋白GhDi19-1、GhDi19-2能增强对高盐胁迫和ABA的敏感性[14]。棉花中编码C2H2型锌指蛋白的基因GhCSTZ在棉花幼苗受到盐胁迫时表达[15]。
ZAT12基因作为C2H2锌指蛋白家族的一个成员,研究发现,其主要参与逆境胁迫。研究发现,ZAT12主要与氧化应激相关[16],ZAT12可以上调与ROS信号转导相关基因APX1、ZAT7、WRKY25,同时在拟南芥中,锌指蛋白Zat12是抗坏血酸过氧化物酶1在氧化应激过程中的表达所必需的。在非生物胁迫处理中,ZAT12和APX1的共同表达可以调控抗坏血酸(ascorbic acid,AsA)代谢[17]。在拟南芥中,ZAT12在活性氧和非生物胁迫中起核心作用,可以调节拟南芥对强光和氧化应激反应[18]。ZAT12基因能增强抗氧化性,更能适应干旱胁迫[19]。另外ZAT12还作为ROS信号转导的一个重要的组分,与其他基因相互作用来消除ROS[20]。由此可见,ZAT12基因在逆境胁迫中发挥了重要的作用。
本研究克隆了一个C2H2家族的基因GhZAT12(Gh_D03G1247.1),利用烟草瞬时表达系统对GhZAT12-GFP融合蛋白进行了亚细胞定位,发现其定位于细胞核,通过实时定量PCR技术分析了GhZAT12在不同部位的表达水平以及在NaHCO3处理下基因表达水平的变化,表明GhZAT12可能在碱胁迫中发挥重要的作用。
1 材料与方法
1.1 材料
棉花材料为陆地棉中9807,由中国农业科学院棉花研究所抗逆鉴定课题保存并提供。
1.2 方法
1.2.1 胁迫处理 采用沙培法进行育苗,沙子事先用清水洗去杂质并置于120℃烘箱中烘干,棉花种子放置于16 h光照/8 h黑暗的28℃恒温人工气候箱30 d。对三叶期棉花幼苗进行125 mmol/L NaHCO3碱胁迫处理,对照为清水处理。
1.2.2 RNA的提取和cDNA的制备 取“三叶一心”期的棉花幼苗的根、茎和叶用于RNA提取和基因克隆。采用北京Aidlab的RN38 EASYspin Plus植物提取试剂盒提取样品中的RNA,具体步骤见试剂盒说明书。提取到的RNA放置在-80℃超低温冰箱中保存。使用Thermo SCIENTIFIC的RevertAidTM第一链cDNA Synthesis试剂盒制备cDNA,具体步骤见说明书,制备好的cNDA-80℃冰箱中保存备用。
1.2.3 GhZAT12基因的克隆 从cottonFGD数据库中下载GhZAT12的序列信息,用Primer 5软件设计基因全长引物,分别命名为GhZAT12-F和GhZAT12-R(表1),引物预期长度为474 bp。以反转录获得的cDNA为模版,用Vazyme的2×Phanta Max Master Mix扩增GhZAT12全长mRNA序列。PCR程序设定如下:94℃预变性5 min;94℃ 20 s;56℃ 15 s;72℃ 90 s;34个循环;72℃ 10 min。4℃保存。获得的PCR产物使用Magen的HiPure Gel Pure DNA Kits进行胶回收,胶回收产物与连到Peasy-Blunt Cloning Vector载体上,并采用热激法转化大肠杆菌感受态Trans1-T1 Phage Resistant Chemically Competent Cell。挑取白色阳性克隆接种于含有抗生素的LB液体培养基中,200 r/min,37℃培养6 h左右,用M13 Forward Primer 和M13 Reverse Primer对阳性克隆进行PCR检测,正确的菌液用M13F引物测序。对测序结果进行分析,提取质粒获得克隆载体GhZAT12-T。

表1 实验所用引物Table 1 Primer pairs used in the experiments
1.2.4 GhZAT12基因序列的生物信息学分析 使用在线分析软件Protparam(https://web.expasy.org/protparam/)分析GhZAT12蛋白的理化性质。使用ProScale(https://web.expasy.org/protscale/)分析GhZAT12蛋白的亲疏水性。使用SignalP(https://www.cbs.dtu.dk/services/SignalP-3.0/) 分 析GhZAT12蛋白的信号肽。使用NetPhos3.1(https://www.cbs.dtu.dk/services/NetPhos/)来预测GhZAT12蛋白的磷酸化位点。使用TMHMM v2.0(https://www.cbs.dtu.dk/services/TMHMM/)进行跨膜结构预测。使用SOPMA对GhZAT12蛋白质二级结构进行预测。使用Swiss-Model Workspace对蛋白三级结构进行预测。利用WoLF PSORT 软件(https://wolfpsort.hgc.jp/)进行亚细胞定位预测。
1.2.5 实时荧光定量PCR 以反转录获得的cDNA为模板,进行荧光定量实验。引物序列见表1。所用试剂盒为北京全式金的TransStart Top Green qPCR SuperMix,qRT-PCR所用设备为Applied Biosystems@7500 Fast。每个反应中包含100 ng cDNA,引物(10 μmol/L)0.4 μL,SuperMix 10 μL,PassiveDye 0.4 μL,加ddH2O至20 μL。扩增程序为94℃预变性30 s,94℃变性5 s,60℃退火15 s,72℃延伸34 s,40个循环。实验组(3个生物学重复,3个技术重复)与对照组相对差异倍数计算利用2-ΔΔCt法[21]。
1.2.6 GhZAT12亚 细 胞 定 位 烟 草(Nicotiana tabacum L.)种子用0.5%的次氯酸钠浸泡消毒10 min,再用灭菌ddH2O清洗5-7次。将种子均匀点播于1/2 MS培养基上,25℃,16 h光照/8 h黑暗条件培养。待培养基上的烟草长出两片子叶,将其移栽至营养土中,继续培养,至5-7片真叶。取适量活化后的含有目的基因的亚细胞定位载体的农杆菌加入到含有卡那霉素(50 mg/L)和利福平(25 mg/L)的LB液体培养基中培养至OD600=1.0左右。离心收集菌液并用重悬液重悬菌体。侵染后,先将烟草避光培养24 h,再正常培养。3 d后,在烟草叶片注射部位附近,撕下表皮,使用激光共聚焦观察绿色荧光,确定靶标蛋白表达部位。使用DNAMAN构建亚细胞定位引物,酶切位点为Xba I和Kpn I,引物序列见表1。
2 结果
2.1 GhZAT12的克隆
以陆地棉品种中9807cDNA为模板,扩增陆地棉GhZAT12基因的开放阅读框(open reading frame,ORF)并进行测序。结果显示GhZAT12的ORF全长为474 bp,编码157个氨基酸(图1)。

图 1 GhZAT12的PCR扩增产物的琼脂糖凝胶电泳分析Fig.1 Agarose gel electrophoretic analysis of PCR product of GhZAT12
2.2 GhZAT12基因的多重序列对比与进化树分析
在NCBI中通过blastp对GhZAT12基因进行同源性比对,找到了与GhZAT12基因同源性最高的其他物种的14个蛋白序列。通过DNAMAN软件进行多重序列比对分析(图2),结果显示GhZAT12的N端第11-19位氨基酸含有保守的L-BOX,序列为DMANCLMLL。同时在第35-55、80-100位氨基酸还含有两个保守的锌指结构Zinc Finger Motif,序列分别为CKTCDKKFSSFQALGGHRASH和CSICGLEFAIG QALGGHMRRH。在C端第129-136位氨基酸有一个核心的EAR-motif,序列为LDLSLTSW。在GhZAT12的锌指结构中含有保守的QALGGH序列,表明GhZAT12可能是C2H2型转录因子。以往的研究发现,QALGGH序列可能与转录因子的DNA结合能力有关[22]。GhZAT12蛋白与其他物种的蛋白序列之间的序列相似度比较高,说明该蛋白在进化上比较保守。为了进一步研究ZAT12在不同物种的进化关系,利用MEGA7.0软件邻接法构建进化树(图3)。分析表明,15个物种的ZAT12蛋白可分为4大类,陆地棉与海岛棉、亚洲棉和雷蒙德氏棉的亲缘关系较近,陆地棉与可可的亲缘关系较近,这与前人的研究相一致[23]。

图2 GhZAT12蛋白同源氨基酸序列多重比对Fig.2 Multiple sequence alignment of homologous amino acids in GhZAT12 protein
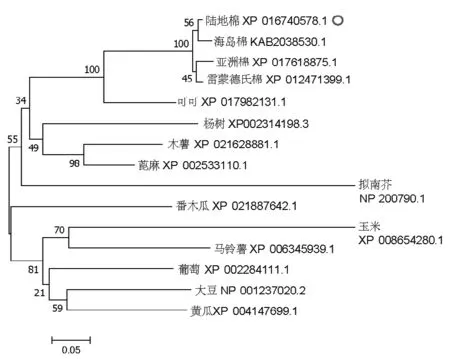
图3 不同物种中ZAT12同源蛋白的系统进化树Fig.3 Phylogenetic tree of ZAT12 homologous proteins in different species
2.3 GhZAT12蛋白的理化性质分析
通过Protparam网站分析,GhZAT12的分子式为C736H1205N219O223S12,分子量为17.074 kD,理论等电点为8.57,19个带负电荷残基总数(Asp+Glu),22个带正电残基总数(Arg + Lys),因此该蛋白带正电,预测该蛋白为酸性蛋白。不稳定系数为31.74,脂肪系数为80.13,亲疏水性平均系数(GRAVY)为-0.296,表示该蛋白是亲水蛋白。亮氨酸(Leu)含量最高为11.5%,谷氨酰胺(Gln)的含量最低为1.9%。
2.4 GhZAT12蛋白的亲疏水性分析
使用ProScale对GhZAT12蛋白的亲/疏水性进行预测(图4),结果表明,GhZAT12蛋白在55位S亲水性最小分值为-2.578,在86位F疏水性最大分值是1.733,推测在蛋白序列中亲水性氨基酸数量大于疏水性氨基酸,因此GhZAT12蛋白是一种亲水蛋白。

图4 GhZAT12蛋白亲/疏水性分析Fig.4 Hydrophilic/hydrophobic analysis of GhZAT12 protein
2.5 GhZAT12蛋白的信号肽预测和磷酸化位点 分析
通过SignalP来预测GhZAT12的信号肽,发现GhZAT12不存在信号肽(图5)。通过NetPhos 3.1对GhZAT12的磷酸化位点进行预测(图6)。结果显示,丝氨酸Ser位点有5个,苏氨酸Thr位点有2个,酪氨酸Tyr位点有0个。

图5 GhZAT12蛋白的信号肽分析Fig.5 Signal peptide analysis of GhZAT12 protein

图6 陆地棉GhZAT12蛋白磷酸化位点分析Fig.6 Phosphorylation site analysis of GhZAT12 protein of G. hirsutum L.
2.6 GhZAT12蛋白的跨膜分析
通过TMHMM网站对GhZAT12蛋白的跨膜结构域进行分析(图7),结果表明,GhZAT12没有跨膜结构域,属于非跨膜蛋白。在使用SignalP对信号肽进行预测的时候,发现Signal peptide probability为0.017 6,other值为0.982 4,表明GhZAT12蛋白无信号肽,因此认为该蛋白为非分泌型蛋白。

图7 陆地棉GhZAT12蛋白跨膜螺旋预测Fig.7 Transmembrane helical projections of GhZAT12 protein of G. hirsutum L.
2.7 GhZAT12蛋白的二级结构和三级结构分析
通过SOPMA对GhZAT12蛋白的二级结构进行预测(图8),共有6个α螺旋结构包含37个氨基酸残基,占总氨基酸数的23.57%,无规则卷曲包含88个氨基酸占56.05%,6个链状延伸链,包含29个氨基酸,占18.47%。使用Swiss-Model Workspace对GhZAT12蛋白的三级结构进行预测,从图中可知,与二级结构预测结果一致(图9)。

图8 GhZAT12蛋白的二级结构预测Fig.8 Secondary structure prediction of GhZAT12 protein

图9 GhZAT12蛋白的三级结构预测Fig.9 Tertiary structure prediction of GhZAT12 protein
2.8 GhZAT12蛋白的亚细胞定位分析
为了研究GhZAT12蛋白的亚细胞定位,构建了GhZAT12-GFP载体。通过对烟草叶片注射GhZAT12-GFP融合蛋白的方法来进行实验。同时以GFP空载的融合蛋白作为对照。注射叶片3 d后,利用荧光共聚焦显微镜观察融合蛋白的位置。结果(图10)显示,GFP空载在细胞核和细胞质中均有分布,GhZAT12-GFP只分布在细胞核中。结果表明GhZAT12蛋白定位在细胞核中。

图10 GhZAT12在烟草叶片中的亚细胞定位Fig.10 Subcellular localization of GhZAT12 in tobacco leaves
2.9 GhZAT12的组织表达特异性分析
为了研究GhZAT12基因的组织表达模式,对三叶期的棉花幼苗的根、茎、叶进行了实时定量PCR。结果(图11-A)显示,GhZAT12在根茎叶中均检测到信号,但其表达量存在显著差异。GhZAT12在根中的表达量最高;其次是叶,在茎中的表达量最低。
为了研究GhZAT12基因在碱胁迫下的表达分析,通过对三叶期的棉花幼苗进行125 mmol/L的NaHCO3碱胁迫,通过实时定量PCR分析,结果表明,碱胁迫对GhZAT12的表达具有明显的诱导作用,但在根、茎、叶中的表达模式略有不同。根和叶的基因表达先上升后下降,茎部的表达先下降再上升,在处理时间6 h时表达量最低,当处理时间延长至24 h时达到最高(图11-B)。结果表明,GhZAT12基因受碱胁迫诱导,可能在棉花对碱胁迫应答中起重要作用。

图11 棉花GhZAT12基因在不同组织不同碱胁迫时间的相对表达量Fig.11 Relative expressions of GhZAT12 gene in different tissues and different times of alkaline stress in G. hirsutum L.
3 讨论
棉花是盐碱地的先锋作物,具有一定的耐盐碱性。随着全球土壤盐碱化的日益严重,因此研究非生物胁迫机制对于培育棉花耐盐碱胁迫新材料具有重要的意义。研究发现,转录因子是植物响应环境胁迫信号通路的主要调控因子[24]。在棉花中已经报道过许多与逆境胁迫相关的转录因子,如bZIPs[25],WRKYs[26-28],MYBs[24]等。先前关于C2H2转录因子在棉花中主要参与一些逆境胁迫。GhSTOP1基因在棉花中对铝、质子胁迫以及根系发育中起了重要的作用[29]。棉花中GhSIZ1基因可能在响应低温、高盐、干旱等非生物胁迫中起着重要的作用[22]。棉花中的GhBsr-d1Ls基因可能在响应大丽轮枝菌胁迫时起重要的作用[30]。
本研究以陆地棉中9807为研究材料,克隆了GhZAT12基因的编码区序列。对GhZAT12蛋白的理化性质、生物信息学信息、亚细胞定位进行了分析。GhZAT12是一个编码157个氨基酸的亲水蛋白质。亚细胞定位在细胞核内,没有信号肽。磷酸化位点分析显示,GhZAT12蛋白中丝氨酸位点有5个,苏氨酸位点有2个,酪氨酸位点有0个。同时又对棉花和其他物种中ZAT12蛋白进行了序列比对和进化分析,结果发现,棉花与可可的亲缘关系较近,这与前人的研究相一致。在GhZAT12中有几个保守结构域,在N端有一个保守的L-BOX,序列为DMANCLMLL,该结构可能与蛋白质互作有关[31]。在N端还有一个保守的EAR-Motif,序列为LDLSLTSW。以往的研究表明含有EAR-Motif的锌指蛋白能够激活下游基因的表达[32],如水稻中发现的ART1基因[33]和小盐芥中发现的ThZF1基因[34]。但是研究发现,大多数的蛋白却具有转录抑制作用,如拟南芥AZF1、AZF2、STZ/ZAT10等[35]。本实验中GhZAT12基因是否对下游基因的表达起调控作用,是否具有转录激活或者抑制作用有待进一步的验证。
除了盐、干旱和生物胁迫之外,碱胁迫是危害作物生长的一个重要的非生物胁迫因素。研究发现MsCBL4在根中的表达量最高,并由盐和盐碱胁迫(NaHCO3)诱导,盐碱胁迫更能诱导MsCBL4的表达[36]。Ca2+传感器SCaBP3/CBL7调节质膜H+-ATP酶活性,促进拟南芥耐碱能力[37]。SsMT2基因在除花外的所有器官中均有表达,并且在CdCl2、NaCl、NaHCO3和H2O2处理下均能诱导SsMT2基因表达[2]。棉花中耐碱的研究目前还鲜有报道,Zhang等[38]通过对不同盐碱胁迫下的棉花进行转录组分析,初步揭示了棉花盐碱差异。因此分析棉花C2H2型转录因子在碱胁迫下的表达模式,有利于拓宽了解棉花C2H2型转录因子的盐碱作用机制。
对ZAT12目前并没有耐碱胁迫的相关研究,在水稻中,OsZAT12的表达具有明显的组织特异性,在根部表达量较高,而在茎、叶、剑叶、穗和壳中几乎没有表达[39]。本研究发现GhZAT12基因在根、茎、叶中均有表达,在根和叶中的表达量较高,在茎中的表达量较低,具有明显的组织表达特异性。对碱胁迫下不同时间段GhZAT12基因表达进行了荧光定量分析,结果发现,碱胁迫下GhZAT12基因在根、茎、叶中的表达量随处理时间的不同而改变,这说明GhZAT12基因受碱胁迫的调控。本研究对GhZAT12基因进行初步的克隆和表达模式分析,为以后进一步研究基因的功能提供一定的参考。
4 结论
从陆地棉中克隆出了胁迫诱导基因GhZAT12,含474 bp的开放阅读框,编码157个氨基酸。亚细胞定位显示GhZAT12蛋白定位在细胞核。GhZAT12基因受碱胁迫的诱导,具有明显的组织表达特异性。
