复凝聚法制备西番莲果皮花色苷微胶囊及其性质分析
2021-09-14范方宇张雪春
孙 雪,张 蕊,范方宇,郭 磊,张雪春
(西南林业大学生命科学学院,云南昆明 650224)
西番莲是一种营养丰富的热带水果,其在加工中产生的大量果皮造成了一定的环境污染。西番莲果皮富含花色苷,花色苷具有抗氧化、抗肿瘤,预防糖尿病和心血管疾病等功效[1],是一种优秀的天然可食用色素。以西番莲果皮为原料利用其花色苷,不仅可开发优秀的天然色素,还可解决废弃物的综合利用难题。
目前对西番莲果皮花色苷的研究以提取、分离纯化及对其稳定性的研究为主。如陈旭丹等[2]研究了西番莲果皮色素稳定性,揭示了西番莲果皮花色苷的稳定性较差。微胶囊技术可保护芯材,防止其被外界环境破坏,控制芯材释放[3],微胶囊技术可为西番莲果皮花色苷的稳定性提供保障[4]。微胶囊的制备方法有原位聚合法、喷雾干燥法、复凝聚法、界面聚合法等[5]。其中复凝聚法是用两种或多种水溶性高分子材料的溶液,在适当的条件下,电荷中和,材料在溶液中凝聚,并将芯材包埋形成微胶囊。复凝聚法制备微胶囊工艺简单、条件温和、成本低高产率等[6],在花色苷制备微胶囊技术中大量使用[7]。复凝聚法制备西番莲果皮花色苷微胶囊,可保障花色苷的稳定性,且为花色苷产品的多样化提供技术支撑。
基于此,以西番莲果皮花色苷为芯材,明胶和阿拉伯胶为壁材,采用复凝聚法制备西番莲果皮花色苷微胶囊,并分析了微胶囊的粒径、水分含量、形态及热稳定性等性质,以期为西番莲花色苷的应用提供参考。
1 材料与方法
1.1 材料与仪器
西番莲 云南省景洪市;乙醇(纯度≥99.7%)分析纯,广东光华科技股份有限公司;明胶 化学纯,国药集团化学试剂有限公司;阿拉伯胶 生化试剂,国药集团化学试剂有限公司;柠檬酸 分析纯,天津市风船化学试剂科技有限公司;盐酸 分析纯,成都金山化学试剂有限公司;冰乙酸(纯度≥99.5%) 分析纯,广东光华科技股份有限公司;100 U/g 的谷氨酰胺转氨酶(TG 酶) 泰兴市东圣食品科技有限公司。
HH-S4 磁力搅拌水浴锅 常州朗越仪器制造有限公司;JRA-650 超声波细胞破碎仪 无锡杰瑞安仪器设备有限公司;FJ200-SH 数显高速分散均质机上海沪析实业有限公司;B-290 喷雾干燥机 瑞士Buchi 公司;760CRT 紫外分光光度计 上海精密科学仪器有限公司;Hydro 2000Mu 激光粒度仪 英国Malvern 仪器有限公司;SK2009 光学显微镜 深圳赛克数码科技开发公司;SPX-150B 恒温恒湿培养箱天津泰斯特仪器有限公司;SC-4800 扫描电镜 日本日立;DSC204F1 差示量热扫描仪 德国耐驰仪器制造有限公司。
1.2 实验方法
1.2.1 西番莲果皮花色苷的制备 参考杨宗玲[8]的方法制备西番莲果皮花色苷。选取新鲜、色泽一致的西番莲果皮。50 ℃干燥12 h,干燥果皮粉碎,过60 目筛,取筛下样品,4 ℃密封保存。取干燥西番莲果皮粉,以液料比10 mL/g,加入86%酸性乙醇(0.054%盐酸+0.100%柠檬酸),以提取温度50 ℃、超声时间37 min、超声功率190 W 提取花色苷,提取液5000 r/min 离心10 min。取上层清液,浓缩,将浓缩液(即粗提物)于−18 ℃避光保存备用。
1.2.2 花色苷微胶囊制备 参考纪秀凤[9]的研究方法,略有修改。分别配制一定浓度的明胶和阿拉伯胶溶液,按比例将明胶溶液与西番莲果皮花色苷混匀,10000 r/min 高速分散1 min,40 ℃水浴,加入一定比例阿拉伯胶溶液,混匀;10%冰乙酸调节反应pH,在一定反应温度下,200 r/min 搅拌30 min;将溶液迅速冷却至15 °C,加入一定量TG 酶固化3 h 即得复凝聚微胶囊。取反应后底部微胶囊溶液进行喷雾干燥,得西番莲果皮花色苷微胶囊样品。喷雾干燥条件:进风温度180 °C,出风温度90 ℃,进料流速9 mL/min。
1.2.3 花色苷含量测定 微胶囊中总花色苷测定[10]:取0.50 g 微胶囊样品溶于15.0 mL 蒸馏水,振荡溶解;滤液分别用pH 1.00 盐酸-柠檬酸缓冲液和pH 4.50 柠檬酸-柠檬酸钠缓冲液稀释4 倍[11];置于暗处平衡30 min,510 nm 和700 nm 测吸光值,利用公式(1)计算微胶囊中总花色苷含量。
微胶囊表面花色苷含量测定[12]:取0.50 g 微胶囊样品,用15.0 mL 振荡洗涤、过滤;滤液分别用pH1.00 的盐酸-柠檬酸缓冲液和pH4.50 的柠檬酸-柠檬酸钠缓冲液稀释4 倍;置于暗处平衡30 min,510 nm和700 nm 测定吸光值,利用公式(1)计算微胶囊表面花色苷含量。
采用pH 示差法[13−14]测定花色苷含量,以式(1)计算:
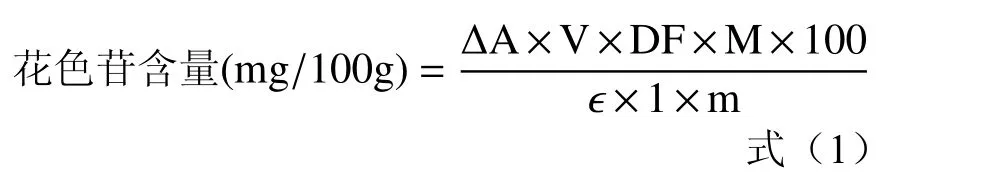
式中:ΔA-吸光度值之差,(A510–A700)pH1.00–(A510–A700)pH4.50;V-稀释最终体积,L;DF-稀释倍数,4;M-矢车菊素-3-葡萄糖苷相对分子质量,449.2;ε-矢车菊素-3-葡萄糖苷摩尔消光系数,26900;m-样品质量,g。
1.2.4 单因素实验 以包埋率为指标,固定条件为:芯壁比1:4、壁材质量比(明胶:阿拉伯胶质量比)1:1、壁材浓度1.5%、复凝聚pH 3.50、反应温度40 °C、反应时间30 min、TG 酶25 U/g 明胶。分别研究芯壁比1:2、1:3、1:4、1:5、1:6,壁材质量比2:1、3:2、1:1、2:3、1:2,壁材浓度0.5%、1.0%、1.5%、2.0%、2.5%,pH 2.50、3.00、3.50、4.00、4.50,反应温度20、30、40、50、60 ℃,反应时间15、30、45、60、75 min,TG 酶添加量15、20、25、30、35 U/g 明胶对西番莲果皮花色苷微胶囊包埋率的影响。
1.2.5 Box-behnken 响应面优化试验 根据单因素实验结果,选择对微胶囊包埋率影响显著的芯壁比、壁材质量比和复凝聚pH 为自变量,以包埋率为响应值,设计三因素三水平的响应面分析实验,优化工艺参数。因素和水平见表1。

表1 Box-Behnken 实验设计Table 1 Experiment design of Box-Behnken
1.2.6 性质的测定
1.2.6.1 包埋率 参考唐璐等[15]的方法,测定微胶囊包埋率,以式(2)计算:

1.2.6.2 粒径测定 将花色苷微胶囊在乙醇介质中分散均匀,采用激光粒度仪测定样品粒径。
1.2.6.3 水分含量 参考GB5009.3-2016《食品中水分的测定》直接干燥法测含水量。
1.2.6.4 形貌分析 将样品粘结在含导电胶的观测台,喷金,采用扫描电镜(SEM)在放大倍数3000 倍条件下观察微胶囊形态。加速电压设定10 kV。
1.2.6.5 热稳定性 利用差示扫描量热仪(DSC)分析微胶囊的热稳定性。取5~10 mg 微胶囊样品于铝制坩埚中,空坩埚为空白对照,扫描温度25~200 ℃,升温速度10 ℃/min,氮气流速20 mL/min[16]。
1.3 数据分析
实验数据均进行3 次平行。利用软件Design-Expert.V8.0.6.1 进行设计,软件IBM SPSS Statistics 20 对数据进行显著性分析,软件Origin 2017 对实验数据进行绘图。
2 结果与分析
2.1 单因素实验
2.1.1 芯壁比对微胶囊包埋率影响 图1 可见,随壁材增加,微胶囊包埋率呈先上升后下降趋势。芯壁比为1:5 时,微胶囊包埋率达到最大,为96.00%,芯壁比为1:6 时微胶囊包埋率显著(P<0.05)下降。原因为壁材用量较低时,溶液中壁材含量较少,复凝聚反应时形成的凝聚物较少[17],芯材未被完全包裹,造成芯材泄露附着在微胶囊表面,包埋率下降;当壁材过多时,微胶囊芯材相对较少,形成部分空囊,造成壁材浪费[18]。为确定适宜的芯壁比,选择1:4、1:5、1:6为响应面三水平。
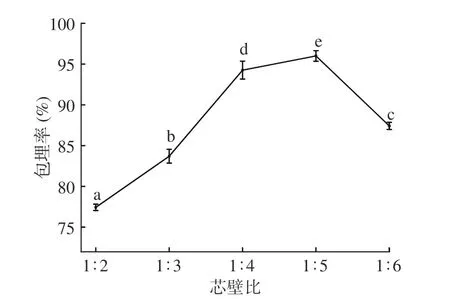
图1 芯壁比对微胶囊包埋率的影响Fig.1 Effects of core/wall ratio on embedding efficiency of microcapsules
2.1.2 壁材质量比对微胶囊包埋率影响 图2 可见,随着阿拉伯胶用量增加,微胶囊包埋率呈先上升后下降的趋势。明胶:阿拉伯胶=1:1 时,包埋率上升至最高,为94.25%;当壁材比小于1:1 时,微胶囊包埋率显著(P<0.05)下降,在明胶与阿拉伯胶质量比为1:2 时,包埋率下降到75.54%,下降了19.85%。明胶含量逐渐增加时,溶液中正电荷增多,正电荷与负电荷结合形成的复合物增加,当明胶:阿拉伯胶为1:1 时,溶液中净电荷含量最低,故包埋率最大,明胶含量逐渐减少,体系正电荷减少,包埋率降低[19]。为确定适宜的壁材质量比,选择3:2、1:1、2:3 为响应面三水平。
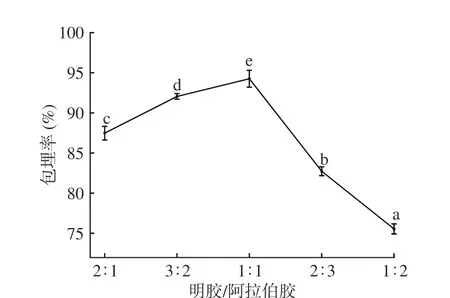
图2 壁材质量比对微胶囊包埋率的影响Fig.2 Effect of gelatin/gum Arabi ratio on embedding efficiency of microcapsules
2.1.3 壁材浓度对微胶囊包埋率的影响 图3 可见,壁材浓度0.5%~1.5%时,随壁材浓度的增加,微胶囊包埋率显著(P<0.05)增加,壁材浓度在1.5%时,出现峰值,包埋率为94.18%。因为壁材浓度过低,未能形成足够包裹芯材的微胶囊,存在空白复聚物,因此包埋率低。当壁材浓度大于1.5%时,微胶囊包埋率显著(P<0.05)下降。因为壁材浓度过大,囊壁变厚,离子浓度增加,壁材自身形成大块凝胶,使包埋率下降[20]。故壁材浓度1.5%为宜。
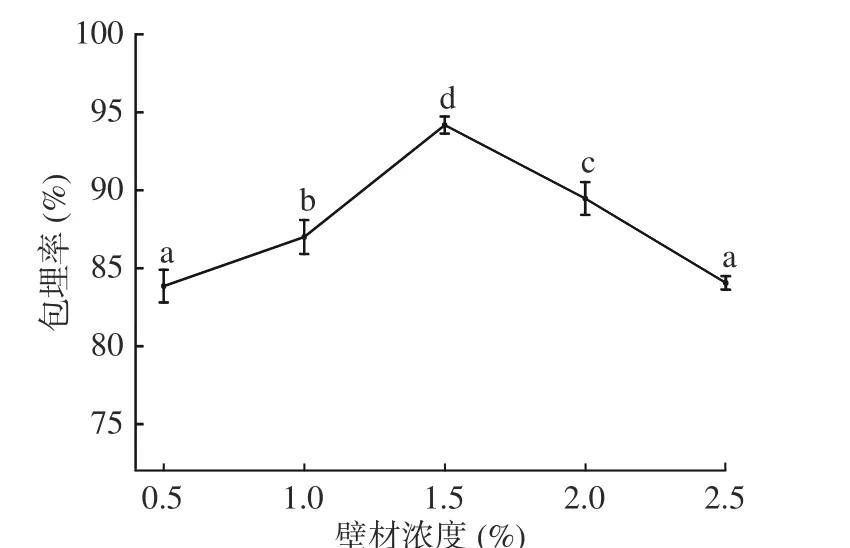
图3 壁材浓度对微胶囊包埋率的影响Fig.3 Effects of the wall material concentration on embedding efficiency of microcapsules
2.1.4 pH 对微胶囊包埋率的影响 图4 可见,当pH为3.50 时,包埋率最大,为94.23%。pH<3.5 时,与pH为3.5 相比,微胶囊包埋率差异不显著(P>0.05)。因为阿拉伯胶分子结构上带有的-COOH 使其水溶液呈弱酸性,在水溶液中带负电[21]。明胶属于两性天然高分子材料,适当降低pH,可以使明胶分子电离正离子,加入与其电荷相反的阿拉伯胶,使明胶溶解度下降,形成微胶囊[20]。pH>3.50 时,微胶囊包埋率显著(P<0.05)下降,因为明胶所带净电荷较少,难以与阿拉伯胶反应,微胶囊难以形成[22],包埋率降低。为确定适宜的复凝聚pH,选择3.00、3.50、4.00 为响应面三水平。
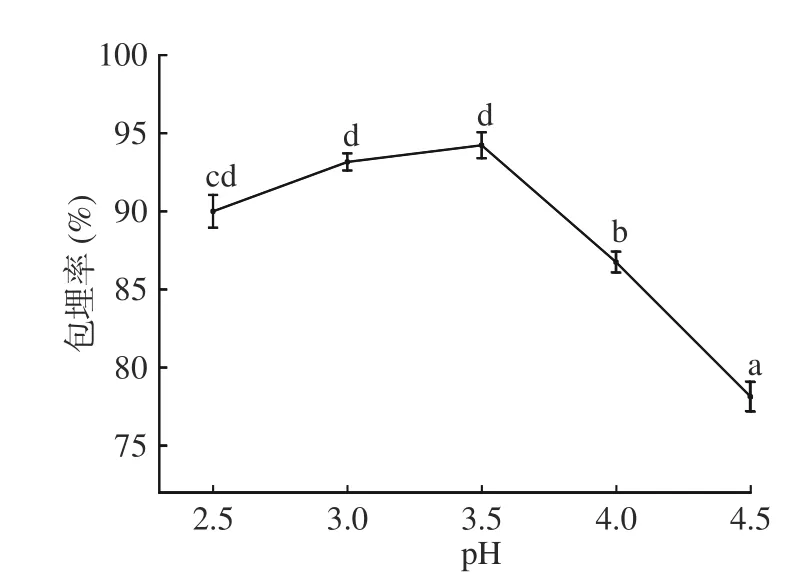
图4 pH 对微胶囊包埋率的影响Fig.4 Effects of pH value on the embedding efficiency of microcapsules
2.1.5 反应温度对微胶囊包埋率的影响 图5 可见,在20~40 ℃时,随着反应温度的升高,微胶囊包埋率显著(P<0.05)上升。当反应温度在40 ℃时,包埋率最大,为94.18%。原因为较低温度使壁材分子运动减弱[23],不能形成完整微囊,芯材流出,包埋率下降。当温度大于40 ℃时,包埋率显著(P<0.05)下降,原因为温度过高,壁材稳定性下降,更易溶于溶液中,使壁材更易被破坏[24],造成包埋率下降。故反应温度选择40 ℃为宜。
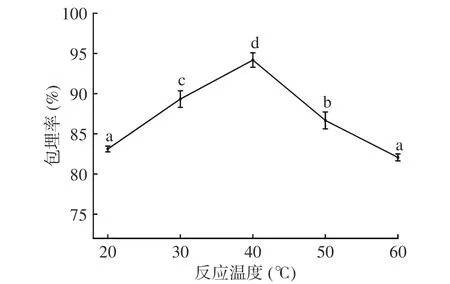
图5 反应温度对微胶囊包埋率的影响Fig.5 Effects of temperature on the embedding efficiency of microcapsules
2.1.6 反应时间对微胶囊包埋率的影响 图6 可见,在15~30 min 时,随着反应时间的延长,微胶囊包埋率显著(P<0.05)上升,在30 min 时包埋率最大为94.23%,当时间超过30 min 时,微胶囊包埋率显著(P<0.05)下降,在反应温度在75 min 时,包埋率下降为79.87%,下降了14.36%。原因为适当延长反应时间有利于微胶囊形成,但时间过长,已形成微胶囊黏连聚集,导致囊壁有破裂[25],包埋率下降。故反应时间选择30 min 为宜。
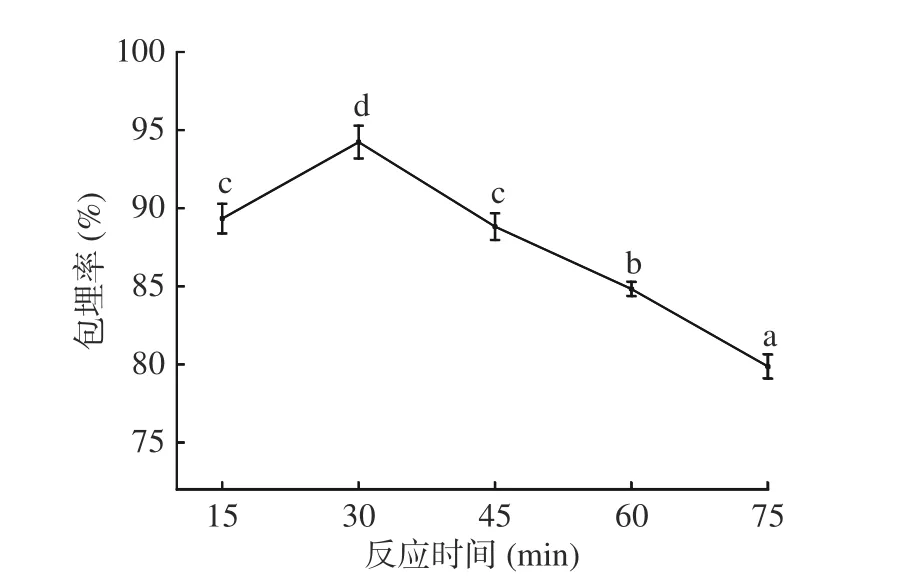
图6 反应时间对微胶囊包埋率的影响Fig.6 Effects of time on the embedding efficiency of microcapsules
2.1.7 TG 酶添加量对微胶囊包埋率的影响 图7可见,TG 酶添加量在15~25 U/g 明胶时,随着TG 酶添加量增大,微胶囊包埋率显著(P<0.05)上升,当TG 酶添加25 U/g 明胶时,包埋率最高为94.19%。因为酶与蛋白质的作用位点充分结合,发生共价交联,微胶囊结构稳定[26],包埋率达到最高;TG 酶添加量大于25 U/g 明胶时,微胶囊包埋率显著(P<0.05)下降,因为TG 酶添加量持续增加,酶添加量过高,使蛋白质交联过度,微胶囊粘连[27],包埋率降低。故TG 酶添加量选择25 U/g 明胶为宜。
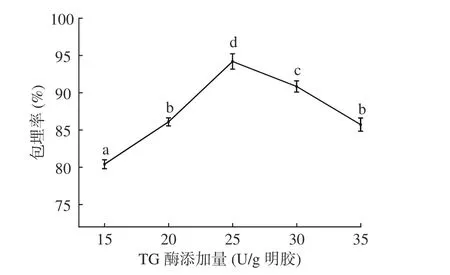
图7 TG 酶添加量对微胶囊包埋率的影响Fig.7 Effects of transglutaminase dosage on the embedding efficiency of microcapsules
2.2 响应面试验设计结果分析
2.2.1 模型建立与显著性分析 西番莲果皮花色苷微胶囊包埋率的响应分析实验根据Box-behnken 设计得到17 组实验,设计方案及结果见表2。利用软件Design-Expert.V8.0.6.1 进行回归拟合,得出以包埋率为响应值的回归方程(3):
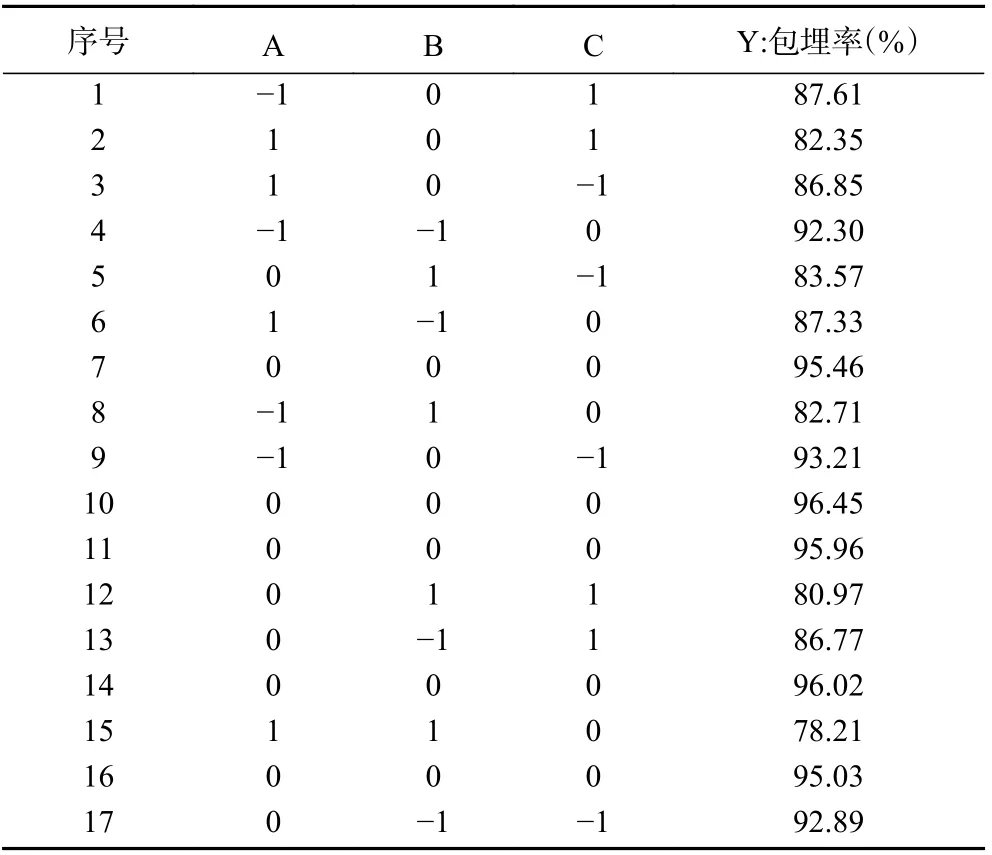
表2 响应面设计方案及结果Table 2 Experimental design and results for response surface analysis

式中,A 为芯壁比,B 为壁材比,C 为复凝聚pH。
对模型进行方差分析,结果见表3。由表3 可以看出,实验选用模型具有高度的显著性(P<0.0001),失拟项=0.1817>0.05,失拟项不显著,表明回归方程对实验拟合较好,无失拟因素存在,各因素之间存在较强的交互作用;决定系数R2=0.9858,实验误差非常小,表明该模型拟合程度好,可对复凝聚法制备西番莲果皮花色苷微胶囊工艺过程的分析及预测。

表3 回归模型方差分析Table 3 Analysis of variance for the fitted regression equation
该模型可以看出A、B、C、A2、B2、C2对西番莲果皮花色苷微胶囊包埋率影响极显著(P<0.01),BC影响显著(P<0.05),AB、AC 不显著。
2.2.2 响应面交互作用分析 通过Design-Expert.V8.0.6.1 软件分析,各因素对西番莲果皮花色苷微胶囊包埋率影响的大小可通过响应面3D 图曲面图陡峭程度判断,曲面越陡峭,影响越大,反之则越小。由图8(a)响应面最为平滑,说明A、B 交互作用最小;图8(b)响应面较平滑,说明A、C 交互作用较弱;图8(c)响应面较陡峭,说明B、C 之间的交互作用最大。响应面结果与表3 中方差分析结果相吻合。根据表3 的分析结果,各交互因素对西番莲果皮花色苷微胶囊包埋率影响程度排序为:BC>AC>AB。

图8 各因素交互作用的响应面图Fig.8 Response surface plots for the interaction of various factors
2.2.3 验证试验 在壁材浓度1.5%、反应温度40 °C、反应时间30 min、 TG 酶25 U/g 明胶时,响应面实验结果表明,复凝聚法制备西番莲果皮花色苷微胶囊优化工艺参数为:芯壁比1:4.7,壁材质量比6:7,复凝聚pH 3.31,微胶囊预测包埋率为97.43%。
验证实验中,pH 取3.30 作为较佳的工艺参数。三次验证实验的微胶囊包埋率为96.83%±0.21%,与预测值相比,包埋率减小0.6%,结果基本一致,表明采用响应面法优化工艺获得的参数可靠,具有一定的实用价值。
2.3 西番莲果皮花色苷微胶囊的性质
2.3.1 微胶囊的基本性质 研究中西番莲果皮花色苷微胶囊的包埋率为96.83%±0.21%。微胶囊平均粒径为12.15±0.85 μm。Mahdavi 等[28]研究指出,微胶囊产品的水分对微胶囊的流动性、黏性及贮存期都有较大影响,本实验测得微胶囊水分含量仅为2.69%±0.35%,低于食品应用中粉末最低要求(4.00%)[29]。低水分能有效防止产品结块,使其具有良好的储藏稳定性。
2.3.2 表面形态分析 图9 可见,西番莲果皮花色苷微胶囊呈球形和椭圆球形,表面存在凹陷,褶皱较多,因为喷雾干燥过程中,水分快速蒸发,壁材不均匀收缩[30]。从图9 中分散的微胶囊可以看出,表面无裂痕、孔洞,结构完整,表明壁材对西番莲果皮花色苷具有良好的保护作用。

图9 微胶囊SEM 照片Fig.9 The SEM pictures of microcapsules
2.3.3 热稳定性分析 温度对微胶囊的稳定性有重要的影响。有研究表明西番莲果皮花色苷适宜在50 ℃以下保存[8]。图10 可见,微胶囊熔融温度为82.51 ℃,高于普通储藏温度(25 ℃),也高于西番莲果皮花色苷的适宜储藏温度(50 ℃)。研究表明微胶囊技术可以保护芯材,确保花色苷贮藏过程中的热稳定性,对西番莲果皮花色苷起到更好的保护作用。

图10 微胶囊DSC 曲线Fig.10 DSC curves of microcapsules
3 结论
本文通过Box-Behnken 响应面法优化西番莲果皮花色苷微胶囊的制备工艺,以包埋率为指标,建立的工艺为:芯壁比1:4.7,壁材质量比6:7,壁材浓度1.5%,复凝聚pH3.30,反应温度40 ℃,反应时间30 min,TG 酶25 U/g 明胶,此条件下,微胶囊的包埋率为96.83%。其粒径为12.15 μm、水分含量为2.69%,扫描电镜分析显示该微胶囊的表面光滑且呈球形结构、其熔融温度为82.51 ℃,常温下利于保存。
