不同乳酸菌对葡萄酵素发酵特性及代谢产物的影响
2021-09-14丁玉峰马艳莉李素萍席晓丽孙剑锋刘亚琼牟建楼
丁玉峰,马艳莉,2,*,李素萍,席晓丽,孙剑锋,刘亚琼,牟建楼
(1.河北农业大学食品科技学院,河北保定 071000;2.南阳理工学院河南省张仲景方药与免疫调节重点实验室,河南南阳 473000)
食用酵素是以动物、植物、菌类等为原料,添加或不添加辅料,经微生物发酵制得的含有特定生物活性成分可供人类食用的酵素产品[1]。近年来,由于人们保健意识加强,越来越多的酵素产品受到消费者的欢迎。葡萄(Vitis vinifera),属葡萄科,落叶藤本植物,是世界栽培面积最大的水果,也是世界上产量仅次于柑橘的第二大水果,遍及亚洲,欧洲和美洲[2]。作为季节性较强的浆果,葡萄贮藏期短,需进行深加工。目前市场上葡萄制品主要有鲜食葡萄、葡萄酒、葡萄汁、葡萄干和葡萄果醋等。因此,开发新型葡萄酵素有利于丰富葡萄深加工产品类型,延长葡萄产业链。葡萄富含膳食纤维、维生素、矿物质、酚酸、类黄酮和花青素等,将葡萄通过微生物发酵制成葡萄酵素,基质中的糖类、维生素和花色苷等营养成分转变为小分子活性物质如有机酸、酶类和单体酚,不仅保留了天然果香还增加了营养密度[3−4]。
酵素中微生物由于酵素原料的不同,在发酵过程中微生物类型也不相同,果蔬酵素的微生物主要是酵母菌、醋酸菌和乳酸菌[5−7]。乳酸菌,作为益生菌被广泛的研究,对维持人体肠道菌群平衡、提高免疫力具有重要作用。除了益生功能,乳酸菌在酵素发酵过程中主要包括同型乳酸发酵和异型乳酸发酵,同型乳酸发酵通过分解糖类产生乳酸,而异型乳酸发酵产物除了乳酸之外还有乙醇、乙酸、琥珀酸和二氧化碳等,通过发酵,乳酸菌产生大量乳酸,使得发酵液pH 降低,较高的酸度能抑制微生物的增长,保护发酵液不腐败变质,延长保质期。此外,乳酸发酵过程中产生的风味更加柔和、不酸涩,且也产生的一些醇、醛、酮等物质,使得发酵产品风味更加浓郁[8−9]。
目前,酵素在日本和台湾地区研究较多,我国大陆地区处于初始发展阶段,相关研发企业还比较少,市场上的酵素产品大多采用自然发酵,但该方法耗时长,微生物群落不稳定,发酵过程不易控制,易污染杂菌,其所导致的产品品质不稳定,不利于工业化生产[10−11]。因此本文以葡萄为原料,通过跟踪监测不同的乳酸菌对葡萄酵素发酵过程中总糖、总酸、pH、可溶性固形物、超氧化物歧化酶(SOD)活力、β-葡萄糖苷酶活力和有机酸的变化情况来研究乳酸菌对葡萄酵素发酵的影响,旨在筛选出适合葡萄酵素发酵的乳酸菌,以期为葡萄酵素的开发提供相关理论依据,这对葡萄的深加工具有重要意义。
1 材料与方法
1.1 材料与仪器
夏黑葡萄(Summer Black) 购于河南省南阳市某超市;植物乳杆菌ATCC 14917(Lactobacillus plantarumATCC 14917) 、 植 物 乳 杆 菌 ACCC 11095(Lactobacillus plantarumACCC 11095)、植物乳杆菌GDMCC 1.380(Lactobacillus plantarumGDMCC 1.380)、干酪乳杆菌ATCC 334(Lactobacillus caseiATCC 334)、类干酪乳杆菌CICC 20109(Lactobacillus paracasei)、短乳杆菌GDMCC 1.288(Lactobacillus brerisGDMCC 1.288) 北京微生物保藏中心;果胶酶(酶活力500 U/mg) 诺维信有限公司;草酸、酒石酸、苹果酸、丙酮酸、乳酸、乙酸、柠檬酸、琥珀酸 色谱纯,美国Sigma 公司;磷酸 色谱纯,上海阿拉丁生化科技股份有限公司;对硝基苯酚、邻苯三酚、4-硝基苯基-β-D-吡喃葡萄糖苷 分析纯,麦克林生化科技有限公司;乳酸菌通用培养基(MRS)、琼脂粉 北京奥博星生物技术有限公司。
Neofuge 15R 高速冷冻离心机 上海力申科学仪器有限公司;SPX 生化培养箱 宁波东南仪器有限公司;PHS-3C 精密酸度计 杭州齐威仪器有限公司;UV752N 紫外可见分光光度计 上海精密科学仪器有限公司;QL-861 涡旋机 海门市其林贝尔仪器制造有限公司;1260 安捷伦高效液相色谱(配备有四元泵,自动进样器,DAD 检测器) 安捷伦科技有限公司。
1.2 实验方法
1.2.1 葡萄酵素的制备 取20 μL 保藏在甘油管的乳酸菌菌液于MRS 固体平板上,培养2~3 d,待长出单菌落后,挑取单菌落于已灭菌的液体培养基中进行扩大培养,37 ℃培养至对数生长期,即得到菌种活化液[12]。
挑选完好无破损的葡萄洗净、晾干,并用搅拌机打浆。用盐酸调pH 为3.6,加入75 mg/mL 的果胶酶酶解40 min,之后进行巴氏灭菌(60 ℃灭菌30 min)。待灭菌后的原料冷却,分别接3%的培养至对数生长期的乳酸菌于葡萄基质中,30 ℃下发酵5 d[13]。每隔1 d 取样,对发酵液的还原糖、可溶性固形物、pH、可滴定酸、β-葡萄糖苷酶、SOD 酶、有机酸、活菌数进行测定。
1.2.2 乳酸菌生长曲线的测定 将活化好的6 株乳酸菌菌的菌液(菌液浓度>106cfu/mL)以3%的接种量接入MRS 液体培养基,置于37 ℃恒温摇床培养24 h,于0、2、4、6、8、10、12、14、16、18、20、22、24 h取样,测定OD600nm值,以不加菌的MRS 培养液为空白对照。
1.2.3 pH 对乳酸菌生长的影响 根据食用酵素生化指标规定,食用酵素pH 不应高于4.0[14],因此需要考察pH 对不同乳酸菌生长的影响。活化后的菌液以(菌液浓度>106CFU/mL) 1%的接种量接入MRS 液体培养基(分别用盐酸调配pH 至3.0、3.5、4.0、4.5、5.0)中,混合均匀,置于37 ℃恒温培养箱中培养48 h,测定OD600nm,以不加菌的各pH 的MRS 培养液为空白对照。
1.2.4 不同乳酸菌发酵性能测定 还原糖采用3, 5-二硝基水杨酸(DNS)法测定[15],即取稀释一定倍数的样品1 mL 与1.5 mL 的DNS 混合,沸水浴显色5 min,待冷却后将体积定容到10 mL,550 nm 处测定吸光值,以1 mL 蒸馏水做空白对照。可溶性固形物的测定参照NY/T 2637-2014《水果和蔬菜可溶性固形物含量的测定》,结果以Brix°表示。使用pH 计测定葡萄酵素发酵过程中样品的pH,可滴定酸含量的测定参照GB/T 12456-2008,结果以乳酸质量浓度计。
1.2.5 SOD 和β-葡萄糖苷酶活力的测定 SOD 活力按照邻苯三酚自氧化法GB/T 5009.171-2003《保健食品中超氧化物歧化酶(SOD)活性的测定》操作;β-葡萄糖苷酶活力的测定参照文献中的方法[16]。
1.2.6 有机酸含量的测定 取2.5 mL 的样品于50 mL的容量瓶中,加入1 mL10.6%的亚铁氰化钾溶液和1 mL 30%的硫酸锌溶液,用去离子水定容,静置30 min,之后取上清液离心,离心后的液体经0.45 μm膜和C18柱过滤,上HPLC 分析。
检测条件:色谱柱Eclipse XDB-C18(4.6 mm×250 mm,5 μm);流动相:0.02 mol/L 磷酸二氢钠,用磷酸调pH 至2.1;流速:0.9 mL/min;柱温:30 ℃;进样量:10 μL;检测波长:210 nm;检测器:二极管阵列检测器[17]。
1.2.7 活菌数的测定 为了考察不同乳酸菌在葡萄基质中的生长情况,对乳酸菌在基质中发酵5 d 后的活菌数进行测定。乳酸菌活菌数的测定按照平板计数法GB 4789.35-2016 操作。
1.3 数据处理
实验数据以平均值±标准差表示。采用Origin软件进行图形绘制,利用SPSS 20.0 软件进行单因素方差分析(Duncan’s test),P<0.05 为显著性差异。
2 结果与分析
2.1 不同乳酸菌的生长曲线
采用比浊法对6 株不同的乳酸菌的生长进行了测定并绘制生长曲线,确定菌株的最佳接种时间,生长曲线如图1 所示。
由 图1 可 知GDMCC 1.288 和ATCC 334 在6 h 左右进入对数生长期,菌株生长较为平缓,且都在20 h 进入对数生长稳定期。ATCC 14917、GDMCC 1.380、ACCC 11095 和CICC 20109 在4 h左右进入对数生长期,随后菌数呈指数上升。GDMCC 1.380、ATCC 14917 和ACCC 11095 在22 h进入对数生长稳定期,而CICC 20109 在18 h 进入对数生长稳定期。
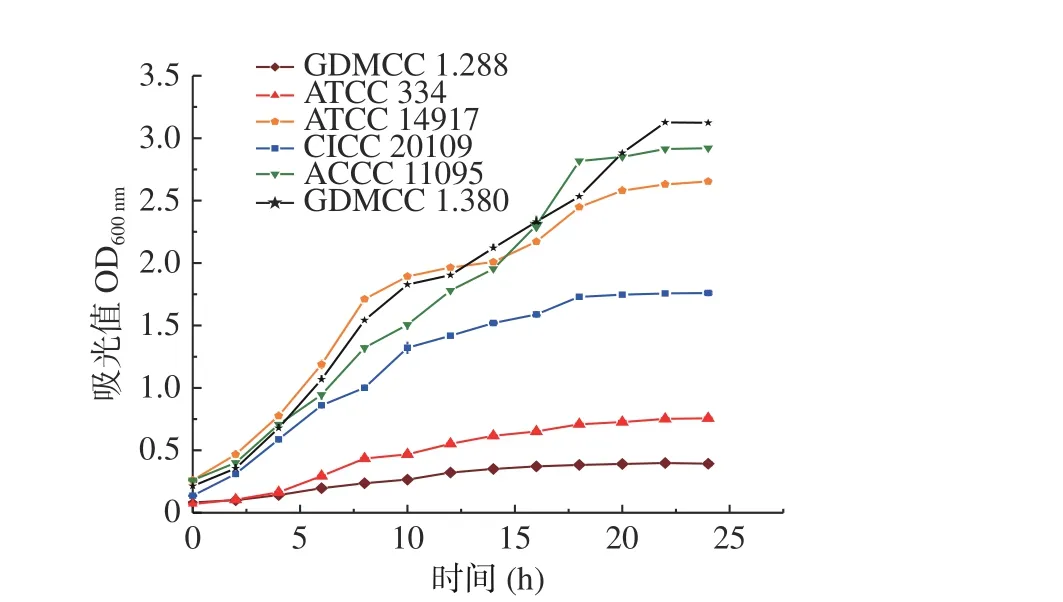
图1 不同乳酸菌的生长曲线Fig.1 Growth curve of different strains of lactic acid bacteria
2.2 pH 对乳酸菌生长的影响
通过测定6 株乳酸菌在不同pH 条件下的OD600nm,考察乳酸菌在不同pH 条件下的生长情况,结果如图2 所示。

图2 pH 对乳酸菌生长的影响Fig.2 Effect of pH value on the growth of lactic acid bacteria
由图2 可知,pH 越低,6 种菌株的生长情况越差,不同菌株在同一pH 的条件下生长情况存在显著差异(P<0.05),且低pH(3.0、3.5、4.0)显著抑制了菌体生长(P<0.05),GDMCC 1.288 的抑制作用尤为明显。当pH 为3 时,ATCC 14917 的生长情况相对较好,OD600nm最大,为0.172。随着pH 的增大,不同菌株的OD600nm有不同程度的增加,ACCC 11095的增长趋势最大。CICC 20109 和ATCC 14917 在不同pH 条件下变化趋势基本一致,ATCC 334 和GDMCC 1.380 的生长情况也基本相似。因此6 株乳酸菌中耐酸性较好的是ACCC 11095,其次为CICC 20109 和ATCC 14917,然后是ATCC 334 和GDMCC 1.380,最后是GDMCC 1.288。
2.3 不同乳酸菌发酵葡萄酵素理化性质变化
2.3.1 还原糖动态变化 通过测定6 株乳酸菌发酵过程中的还原糖含量,考察不同菌株的糖代谢能力,如图3 所示。

图3 不同菌株发酵过程中还原糖含量的变化Fig.3 Changes of reducing sugar content of different strains during fermentation
由图3 可知,6 株乳酸菌发酵过程中还原糖的含量呈逐渐下降趋势,表明6 株菌均有代谢糖的能力。初始葡萄汁中的还原糖含量为32.06 g/L,发酵第1 d,不同菌株的发酵液还原糖含量降低了55%~68%,存在显著差异(P<0.05),发酵第2 d,GDMCC 1.288 的残糖量趋于0,ACCC 11095 残糖量为13.32 g/L,其余菌株残糖量在3.11~3.58 g/L 之间,ACCC 11095 显著高于其它菌株(P<0.05),发酵3 d 后除ACCC 11095 之外,其余菌株还原糖含量趋于0。综上所述,GDMCC 1.288 降解糖的能力最强,CICC 20109、ATCC 334、ATCC 14917 和GDMCC 1.380 降解糖的能力类似,其次是ACCC 11095。
2.3.2 可溶性固形物动态变化 由图4 可知,不同菌株发酵过程中的可溶性固形物呈逐渐下降的趋势,最后趋于5 左右,这与陈华丽等[18]的研究结果类似。葡萄基质中初始可溶性固形物为15.43 Brix°,发酵1 d 后,ACCC 11095 降低了4%,其余菌株降低了15%~20%,发酵第2 d,ACCC 11095 降低了26.6%,其余菌株下降了34%~59%,发酵第3 d,ACCC 11095 发酵液的可溶性固形物为6.23 Brix°,其余菌株下降至5 Brix°左右,随后保持稳定,不同菌株发酵过程中可溶性固形物存在显著差异。

图4 不同菌株发酵过程中可溶性固形物的变化Fig.4 Changes of Brix°of different strains during fermentation
2.3.3 pH 动态变化 pH 在一定程度上可以反映微生物是否正常生长。不同菌株发酵过程中pH 的动态变化趋势如图5 所示,发酵过程中pH 呈先降低再升高后趋于稳定的趋势,不同菌株发酵过程中pH 差异显著(P<0.05)。由图5 可知,初始pH3.6,发酵第1 d,pH 迅速下降,ATCC 14917 发酵液显著降低(P<0.05),为3.37,发酵第2 d,所有菌株发酵液的pH 持续降低,ATCC 14917 的发酵液达到了最低值,为3.28,其次是GDMCC 1.380,发酵第3~4 d,不同菌株发酵液的pH 呈上升趋势,这可能是由于微生物的作用,发酵基质发生了物质转变,如酚类物质[19],发酵第4~5 d,不同菌株发酵液pH 逐渐趋于平稳。ATCC 14917、ACCC 11095 和GDMCC 1.380 发酵结束时pH 为3.33~3.35,而CICC 20109、ATCC 334 和GDMCC 1.288 发酵结束时pH 为3.51~3.58,表明前者产酸能力比后者更强。

图5 不同菌株发酵过程中pH 的变化Fig.5 Changes of pH value of different strains during fermentation
2.3.4 总酸含量的动态变化 总酸在一定程度上可以反映微生物生长代谢情况,由图6 可知,总酸含量为11.07~12.74 g/L,与pH 变化趋势相反,不同菌株发酵过程中总酸含量呈先升高后降低的趋势。发酵第1 d,不同菌株发酵液总酸含量由5.69 g/L 上升到5.78~8.40 g/L,这是由于基质中碳源充足,乳酸菌迅速消耗碳源生成乳酸。随着发酵的进行,乳酸菌经历对数平稳期到衰亡期,基质中的总酸含量缓慢上升,发酵第2~4 d,总酸含量略有下降,到发酵后期,乳酸菌逐渐衰亡,酸度趋于稳定。由图6 可知,不同菌株产酸能力存在显著差异(P<0.05),其中ACCC 11095产酸能力显著高于其它菌株(P<0.05)。

图6 不同菌株发酵过程中总酸含量变化Fig.6 Changes of total acidity in different strains during fermentation
2.4 不同乳酸菌发酵葡萄酵素酶活力变化
2.4.1 SOD 活力的动态变化 由于食用酵素是一个多元复杂发酵体系,原料经过微生物发酵后,获得一些代谢产物,如功能性酶类物质,目前研究最多的主要是SOD,它是一种以超氧阴离子为底物的金属酶,是体内O2-的天然清除剂[20−21]。因此对葡萄酵素发酵过程中的SOD 活力进行了监测,考察乳酸菌是否对SOD 活力有影响,不同菌株发酵过程中SOD 活力的变化如表1 所示。
由表1 可知,CICC 20109、ATCC 334 和ACCC 11095 的发酵液在发酵过程中SOD 活力呈先波动上升后下降的趋势,这与之前的报道趋势相近[22−23]。而ATCC14917、GDMCC 1.380 和GDMCC 1.288这三个发酵组在发酵过程中SOD 活力呈先上升后下降最后趋于平稳的趋势。不同菌株发酵过程中的SOD 活力存在显著差异(P<0.05)。未接种前,葡萄汁中的SOD 活力为9.68 U/mL,发酵第1 d,CDMCC 1.380 的发酵液SOD 活力最先达到了最大值为58.33 U/mL,发酵第2 d,ATCC 14917 和GDMCC 1.288 的发酵液SOD 活力达到了最大值,分别为46.94 和17.79 U/mL。发酵第3 d,ACCC 11095 和ATCC 334 的发酵液SOD 活力达到了最大值,分别为37.50 和19.17 U/mL,发酵第4 d,接种CICC 20109 的酵素SOD 活力达到了最大值,为37.50 U/mL,由于菌株产酸能力不同,因此SOD 活力达到最高点所需时间不同,且后期乳酸的积累,达不到SOD 的最适pH,导致酶活力有不同程度的降低。乳酸菌发酵结束时,GDMCC 1.380 的发酵液酶活最高,为37.50 U/mL,其次是ATCC 14917,为30.00 U/mL。

表1 不同菌株发酵过程中SOD 活力的变化(U/mL)Table 1 Changes of SOD activity of different strains during fermentation(U/mL)
2.4.2β-葡萄糖苷酶活力的动态变化β-葡萄糖苷酶能催化烷基糖苷、芳基糖苷、纤维素和纤维低聚糖等结合于糖链末端非还原性的β-D-葡萄糖苷键水解,使其释放出具有香气的游离糖苷配体[24−25],因此β-葡萄糖苷酶对葡萄酵素的香气形成有重要的作用。Marta 等[26]报道了乳酸杆菌属和双歧杆菌属可以通过β-葡萄糖苷酶水解蔬菜中的β-糖苷,这种酶也被认为是酚类化合物结构中糖苷键断裂的第一步,而葡萄中含有丰富的酚类物质,因此有必要考察不同乳酸菌对β-葡萄糖苷酶产生的影响。
由表2 可知,除GDMCC 1.288 外,其它菌株的发酵液在发酵过程中β-葡萄糖苷酶活力呈先上升后下降的趋势,而接种GDMCC 1.288 的发酵液β-葡萄糖苷酶仅在最后1 d 被检测到,为10.52 μU/mL。不同菌株产生的β-葡萄糖苷酶在10.52~501.29 μU/mL之间,曾子毅等人比较了5 株植物乳杆菌产β-葡萄糖苷酶的特性,结果表明植物乳杆菌产生的β-葡萄糖苷酶在4.630~14.168 U/g[27]。这可能是由于菌株及生长基质的差异。在发酵第2 d,ATCC 14917,β-葡萄糖苷酶活力显著高于其它菌株(P<0.05),为501.29 μU/mL,发酵结束后,ACCC 11095 发酵液的β-葡萄糖苷酶活力最高,为400.70 μU/mL。

表2 不同菌株发酵过程中β-葡萄糖苷酶活力的变化(μU/mL)Table 2 Changes of β-glucosidase activity of different strains during fermentation (μU/mL)
2.5 不同乳酸菌发酵葡萄酵素有机酸含量变化
益生菌可以通过发酵分解糖,形成有机酸,这些有机酸是许多微生物属在食品发酵过程中大量繁殖的重要二级碳源[28]。不同菌株发酵过程中有机酸含量的变化如表3 所示。乳酸的产生是发酵是否成功的标志。不同菌株发酵后乳酸含量都有不同程度的增加,发酵后乳酸的含量在0.38~11.72 g/L,这与之前的报道相一致[29]。其中ACCC 11095 发酵产生的乳酸含量最多,是其它菌株的1.2~30 倍,其次是ATCC 14917、 GDMCC 1.380 和 CICC 20109, GDMCC 1.288 发酵产生的乳酸含量最少。乳酸和低酸碱度会破坏细胞壁和细胞膜,改变膜电位和主动运输,从而导致能量消耗和细胞死亡,因此产乳酸能力较高的乳酸菌对酵素的保存可能是有利的[30]。

表3 不同菌株发酵过程中有机酸含量的变化Table 3 Changes of organic acid of different strains during fermentation
苹果酸是乳酸菌发酵过程中重要的有机酸,因为苹果酸也可被代谢为乳酸。发酵结束后,与未发酵的基质相比,苹果酸含量下降了5%~100%,尤其是ATCC 14917、ACCC 11095 和ATCC 334 完全转化了苹果酸,Markkinen 等[31]用乳酸菌发酵火龙果、沙棘中也有类似的结果。这主要是在苹果酸脱羧酶的作用下,乳酸菌能够依赖NAD+和Mn2+通过脱羧作用代谢苹果酸[32]。
柠檬酸是葡萄浆果中重要的有机酸,第0 d 时,柠檬酸含量为0.55 g/L,不同菌株发酵过程中柠檬酸波动变化。除ATCC 334 外,发酵第2 d 柠檬酸含量突然增多,随着发酵时间的延长,柠檬酸含量有不同程度的下降,但是发酵结束后柠檬酸累积,含量为1.4~2.4 g/L。柠檬酸和苹果酸都可以用作第二碳源被乳酸菌利用,通常,柠檬酸的代谢与糖或其它能源的消耗相结合,在本研究中使用的乳酸菌似乎更倾向于使用苹果酸,焦媛媛等[33]用干酪乳杆菌和植物乳杆菌发酵梨汁中也有类似的结果。
酒石酸是葡萄中的特征酸,未接种时,酒石酸含量为2.56 g/L,Xu 等[28]用益生菌发酵果蔬汁初始酒石酸浓度为3.09 g/L,这主要是由于原料的差异。随着发酵的进行,不同菌株的酒石酸含量略有降低,但是发酵结束时酒石酸含量与初始含量相比,没有显著的降低,含量为1.89~3.82 g/L。只有两种乳酸杆菌(植物乳杆菌和短乳杆菌)可将酒石酸代谢为乳酸、乙酸、琥珀酸和二氧化碳[34]。然而在本研究中,发酵结束后,酒石酸没有被代谢。乙酸在所有样品中都未检测到,表明这几株乳酸菌均进行同型乳酸发酵,减少乙酸的产生对最终酵素产品的风味也有重要的作用。
2.6 不同菌株发酵葡萄酵素前后活菌数的变化
酵素发酵到后期pH 较低,而乳酸菌达到一定的数量级才可发挥益生功能,因此需要考察接种发酵后乳酸菌的活菌数。经过5 d 的发酵后,不同乳酸菌的活菌数如图7 所示。

图7 不同菌株发酵前后活菌数的变化Fig.7 Changes of viable count of different strains before and after fermentation
由图7 可知,接种发酵后不同菌株的生长情况存在显著差异(P<0.05)。ACCC 11095 和GDMCC 1.380 在发酵结束后活菌数增加,且二者没有显著差异(P<0.05),分别为(8.42±0.11)、(8.51±0.01)lg cfu/mL,表明这两株菌能很好地适应发酵基质。表明这两株菌对外界的应激影响小于其它菌株。ATCC 14917、CICC 20109 和ATCC 334 在接种发酵后,活菌数分别降低了1、1 lg cfu/mL 和0.66 lg cfu/mL,这可能归因于低pH 和酚类物质的影响[35]。而GDMCC 1.288 在发酵前后总菌数基本一致。
3 结论
通过比较6 株乳酸菌发酵葡萄果浆的发酵特性、代谢产物及生长情况后得出,植物乳杆菌ACCC 11095 能很好地适应发酵基质,耐酸能力强,接种发酵启动速度快,发酵1 d 后,还原糖和可溶性固形物迅速降低,并于第5 d 葡萄糖消耗完毕;发酵结束后细胞总数上升,能够产生丰富的SOD 和β-葡萄糖苷酶;产酸能力强,能够累积大量的乳酸和柠檬酸,完全消耗苹果酸,不产生乙酸,表明该菌株具有提升葡萄酵素的功能及改善其风味潜力;综上,确定植物乳杆菌ACCC 11095 为葡萄酵素发酵的优选菌株,这为葡萄酵素的制备提供了理论基础,对葡萄的深加工有重要意义。
