舒尼替尼治疗晚期肾癌的预后因素分析及国际转移性肾细胞癌数据库联盟预后模型验证
2021-09-14周饶饶戚聂聂赵方正李子祥王诗驿王军起朱海涛
周饶饶,戚聂聂,赵方正 ,李子祥,王诗驿,邱 冬,王军起 ,朱海涛
(1.徐州医科大学研究生院,江苏徐州 221000;2.徐州医科大学附属医院泌尿外科,江苏徐州 221002)
肾细胞癌(renal cell carcinoma,RCC)起源于肾实质泌尿小管上皮系统,泌尿生殖系统常见恶性肿瘤之一。我国2015年新增肾癌病例约6.68万,死亡约2.34万,且肾癌新增病例呈逐年递增趋势[1-2]。早期肾癌以手术治疗为主,转移性肾癌对传统放化疗及非特异性免疫治疗均不敏感,随着对肾癌发病机制的进一步研究发现,酪氨酸激酶抑制剂能够明显提高晚期肾癌患者的无进展生存期(progression free survival,PFS)和总生存期(overall survival,OS)[3]。无论采用何种治疗方式,人们都希望找到能够预测治疗效果的预后因素,从而实现精准医学的发展。影响肾癌预后的因素很多,且会随着治疗方式的变化而改变,需不断探索更新。将预测效能强的单因素联合起来建立预后模型,可提高预测效能,国际转移性肾细胞癌数据库联盟(International Metastatic Renal-Cell Carcinoma Database Consortium,IMDC)肾癌预后模型[4]即是通过联合6个预后因素形成的预测系统。本研究通过随访收集服用舒尼替尼治疗晚期肾癌患者的临床资料,探索影响预后的因素,并进一步对IMDC肾癌预后模型准确性进行验证。
1 资料与方法
1.1 临床资料回顾性收集2017年5月至2020年8月期间徐州医科大学附属医院泌尿外科115例服用舒尼替尼治疗的晚期肾癌患者的临床资料,其中男80例(69.6%),女35例(30.4%);中位年龄60(28~83)岁;病理类型为透明细胞癌108例,乳头状细胞癌3例,透明细胞癌伴乳头状细胞癌2例,透明细胞癌伴肉瘤样癌1例,嫌色细胞癌1例;转移部位为肺82例(71.3%),骨57例(49.6%),淋巴结27例(23.5%),肾上腺22例(19.1%),肝15例(13.0%),腹膜后12例(10.4%),脑6例(5.2%),对侧肾6例(5.2%)。
其他随访收集内容及评定标准包括:①是否切除原发灶;②首月相对剂量密度(relative dose intensity in the first month,1M-RDI)是否<50%,其定义为:(实际剂量密度/标准推荐剂量)×100%,实际剂量密度为:服用药物的累计剂量/实际使用的天数;③服药前体能状态美国东部肿瘤协作组织(Eastern Cooperative Oncology Group,ECOG)评分;④初始诊断有无症状;⑤IMDC分级;⑥胱抑素C;⑦中性粒细胞与淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR);⑧白蛋白;⑨服药过程不良反应包括高血压,手足综合征(表1)。
IMDC 6个危险因素分别为:①卡氏功能状态评分(Karnofsky performance status,KPS)<80分;②血红蛋白(hemoglobin,HGB)<正常值下限;③从诊断至全身系统治疗时间<1年;④中性粒细胞计数(neutrophil,NE)>正常值上限;⑤血清校正钙离子浓度(Ca2+)>10.0 mg/dL(2.4 mmol/L);⑥血小板(platelet,PLT)>正常值上限。划分风险等级标准为:0项为低危,1~2项为中危,3~6项为高危。
1.2 纳入排除标准
1.2.1纳入标准 ①病理及检查结果证实为晚期肾细胞癌;②不适合手术治疗或拒绝手术患者;③估计存活时间大于3个月;④至少有一个可测量病变;⑤可接受的心脏功能(由心脏超声左心室射血分数评估)、肝脏功能[天冬氨酸转氨酶和丙氨酸转氨酶≤1.5×正常值上限(upper limit of normal,ULN)、胆红素≤1.25×ULN、碱性磷酸酶≤2.5×ULN]、肾功能(血清肌酐≤1.5×ULN,24 h尿蛋白定量<1.0 g)和血液系统(血红蛋白≥90 g/L,中性粒细胞绝对数≥1.5×109/L,血小板计数≥100×109/L)。
1.2.2排除标准 ①不能口服药物患者(如无法吞咽、胃肠切除、肠梗阻等);②妊娠或哺乳期患者;③精神障碍不能按时服药患者;④有未愈合的伤口或骨折;⑤患者有出血倾向,或正在进行溶栓或抗凝治疗;⑥临床资料不完整患者;
1.3 治疗方法根据患者状态评估,采用舒尼替尼标准服药方案50 mg/d,口服,服用4周停2周,即4/2方案或50 mg/d,服用2周停1周方案。服药剂量和方案需根据不良反应随时调整。在治疗过程中,若出现1~2级不良反应可及时对症治疗,不改变治疗剂量;若出现≥3级不良反应,需立即中断服药,对症治疗,药物治疗直至疾病进展或发生患者难以耐受的不良反应。
1.4 疗效及不良反应评价患者服药前行影像学检查确定靶肿瘤数量及大小,初始服药的前2个周期内,每1个周期进行一次疗效及安全性评价;后每2个周期进行一次疗效评估,每1个周期进行安全性评估。根据实体肿瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST)进行疗效评价,无进展生存期(progression free survival,PFS)定义为从服药开始至肿瘤发生进展或死亡。不良反应按照通用不良反应术语标准(CTCAE 4.0)(Common Terminology Criteria for Adverse Events version 4.0)进行评估分级。
1.5 统计学方法采用SPSS 26.0统计软件进行数据处理分析,通过Kaplan-Meier法进行绘制生存曲线,并采用Log-rank法进行显著性检验,应用Cox比例风险模型进行单因素和多因素预后分析,采用R4.0软件行Harrell一致性指数对IMDC预后模型进行验证,以P<0.05为差异有统计学意义。
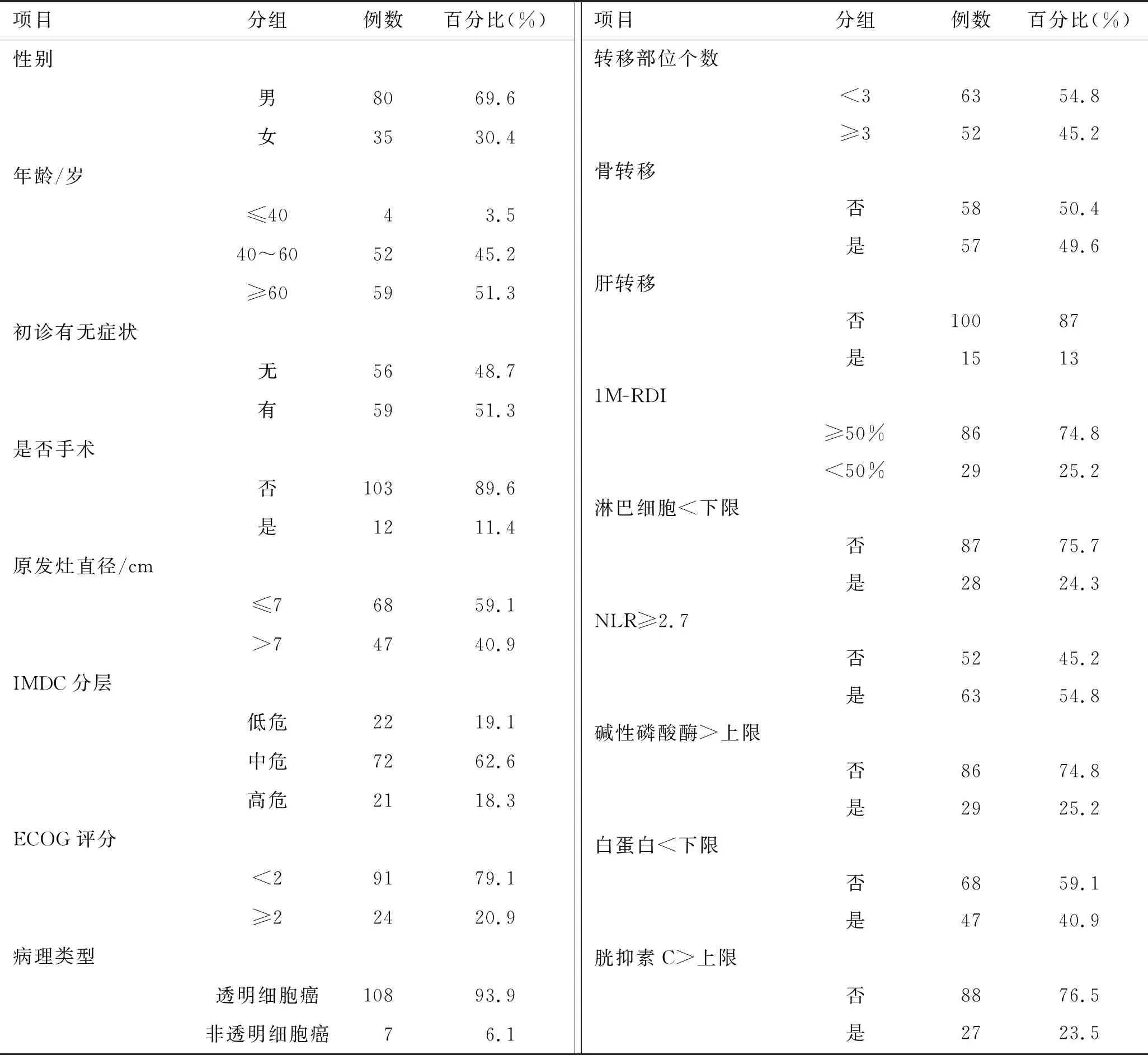
表1 舒尼替尼治疗晚期肾癌患者的基本资料
2 结 果
本研究115例患者的中位随访时间14.6(2~54)个月,部分缓解(partial remission,PR)21.7%,疾病稳定(stabilization of disease,SD)60.0%,疾病进展(progression of disease,PD)18.3%,客观缓解率(objective response rate,ORR)21.7%,疾病控制率(disease control rate,DCR)81.7%,中位无进展生存时间mPFS 11.3(9.4~13.2)个月,中位总生存时间mOS未达到。单因素分析结果显示:ECOG评分≥2分、IMDC分层、转移部位个数≥3个、骨转移、肝转移、1M-RDI<50%、服药期间发生≥3级HFS、NLR≥2.7,初诊时有症状为影响服用舒尼替尼转移性肾癌预后的危险因素(表2)。多因素分析显示:ECOG评分≥2分,IMDC高分级,转移器官个数≥3个,NLR≥2.7,初诊时有症状为影响肾癌预后的独立危险因素(表3)。根据IMDC分层,此研究中低危组22例(19.1%),中危组72例(72.6%),高危组21例(18.3%)。低、中、高危组患者中位PFS分别为14.0个月、11.3个月和5.6个月,3组生存曲线明显分离(P<0.01,图1),IMDC模型一致性指数C-index为0.663(95%CI:0.610~0.716),表明该肾癌预后模型有一定的预测功能。

表2 舒尼替尼治疗转移性肾癌影响无进展生存期(PFS)的单因素分析
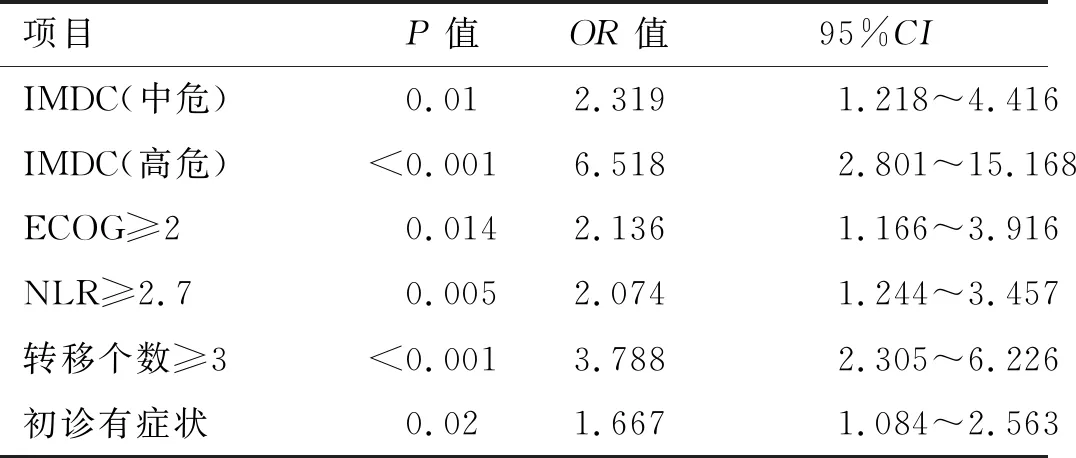
表3 舒尼替尼治疗转移性肾癌影响无进展生存期(PFS)的多因素分析
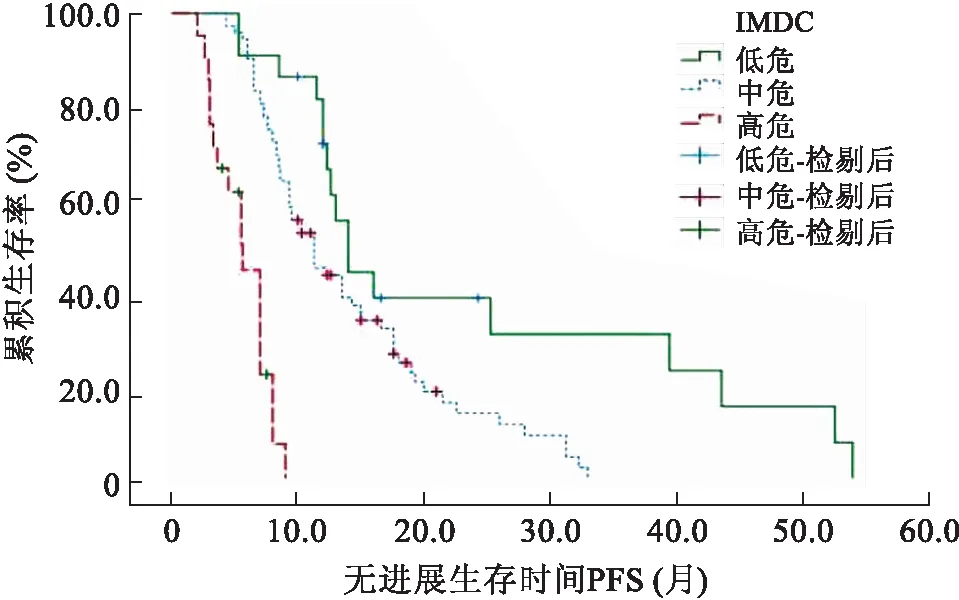
图1 IMDC分层肾癌患者无进展生存时间Kaplan-Meier曲线
3 讨 论
早期肾癌多以手术治疗为主,对于转移性肾癌的治疗,从细胞因子到分子靶向再到免疫检查点抑制剂,治疗方式的改变,必然也伴随着预后因素的改变。2020版欧洲泌尿外科学会(European Association of Urology,EAU)指南将之分为:解剖学因素、组织学因素、临床因素和分子生物学因素,单因素预测能力有限,将预测效能强的因素联合起来建立预后模型,可提高预测效能。随着治疗方式的改变及不同种族、不同地区治疗习惯的差异,预测模型的准确性需要进行不断的验证[5]。
MOTZER等[3]对比舒尼替尼与干扰素-α治疗转移性肾癌患者疗效的研究奠定了舒尼替尼治疗晚期肾癌的重要地位,并成为各种新型分子靶向药物疗效的标杆。中国晚期肾癌患者也可从舒尼替尼的治疗中显著获益[6-7],但不同患者间疗效存在差异,因此研究舒尼替尼治疗晚期肾癌患者的预后因素并验证IMDC模型很有临床意义。
药物代谢动力学表明舒尼替尼在体内剂量浓度需达到50~100 ng/mL方能起到较好抗肿瘤作用,且药物相关不良反应多出现在用药的首个服药周期[8-9],因此若1M-RDI≥50%,预示着患者对药物毒性耐受较好,能在后续治疗中取得较好效果。赵菊平等[10]研究同样发现1M-RDI≥50%的患者OS明显高于1M-RDI<50%的患者,是影响肾癌预后的独立因素。本研究中单因素分析1M-RDI≥50%较低浓度有更好效果,但多因素分析未显示明显差异,可能与该研究样本量少有关。
药物相关不良反应的严重程度与机体内药物浓度有关,而舒尼替尼的疗效同样取决于此,因此不良反应一定程度上可做为靶向药物治疗转移性肾癌患者的预后预测因素。研究表明出现≥3级高血压是预后较好因素[11],产生高血压原因可能是:①血管内皮生长因子(vascular endothelial growth factor,VEGF)抑制后,一氧化氮产生减少,由此引起血管收缩,阻力增加;②VEGF抑制后,内皮细胞凋亡增多,毛细血管数量下降,从而导致阻力增加。DI FIORE等[12]研究表明≥3级手足综合征也是预后较好因素,原因为药物抑制表皮生长因子受体(epidermal growth factor receptor,EGFR)后可影响角质化细胞的增生、分化、迁移以及粘附,导致药物相关手足综合征,表现为皮疹及皮肤角质层增厚、脱皮、水泡,出血水肿、疼痛。但同时也应注意到出现不良反应是患者减少用量或者停药的原因,因此需及时发现并处理不良反应。
KARAKIEWICZ等[13]研究发现ECOG评分是影响局部肾癌和转移性肾癌预后的独立危险因素,认为ECOG可量化肿瘤对机体的损害程度。国内外其他研究也发现服用舒尼替尼治疗晚期肾癌的患者,较高ECOG评分预示不良预后[14-15]。分析可能的原因为服用舒尼替尼的患者,较好的体能状态能够耐受不良反应,使患者尽可能按时按剂量服药。此外良好的体能状态表明肿瘤负荷较低,肿瘤对机体损害的程度小,因此预后较好。
马清昌等[16]研究认为肿瘤的产生、进展及最终转移均与炎症反应有关。肿瘤导致的全身炎症反应会使中性粒细胞相对增多、淋巴细胞的相对降低。中性粒细胞会释放多种炎症介质,损伤血管内皮细胞导致通透性增加从而引起肿瘤转移,且可与肿瘤细胞通过粘附分子结合形成癌栓有利于肿瘤转移。淋巴细胞的相对减少会导致体内特异性T淋巴细胞免疫功能受限,降低了对肿瘤细胞的抑制作用从而导致肿瘤进展[17]。NLR通过联合中性粒细胞和淋巴细胞,能够更加准确地反映肿瘤对机体的影响程度,且研究表明NLR值与肿瘤大小和分级显著相关,与包括泌尿系统肿瘤的多种肿瘤的预后相关,是非转移性肾癌和转移性肾癌免疫或靶向治疗后的独立危险因素[18-20]。本研究发现NLR≥2.7为舒尼替尼治疗晚期肾癌的预后独立危险因素。NLR<2.7和≥2.7患者中位生存时间分别为12.6个月和9.3个月,差异有统计学意义。
现阶段患者极少出现肾癌三联征,但出现其中之一便意味着肿瘤已属于晚期,肾癌出现临床症状提示预后不良[21],意味着更长时间的病程和发生侵犯转移的可能性。本研究出现临床症状患者59例(51.3%),未发现临床症状者56例(48.7%),体检发现肿瘤所占比例较以往升高。MOTZER等[22]研究表明未行原发病灶切除术患者预后不良,在靶向治疗时代,减瘤性肾切除术(cytoreductive nephrectomy,CN)在转移性肾细胞癌治疗中的作用存在争议。MEJEAN等[23]研究发现对于IMDC中、高危患者,减瘤性肾切除术后服用靶向药物和直接服用靶向药物两者疗效无明显差异。然而一项相关综述通过分析56项研究中的63项报告,结果显示对于对于那些转移负担有限、身体状态能够接受病灶切除术,采用靶向治疗后病情稳定、反应良好的患者,接受CN能够延长患者的OS[24]。王杰等[25]认为,肾癌骨转移患者切除原发肿瘤和转移病灶,能够延长患者OS,骨转移灶切除术后靶向药物治疗可使IMDC中危患者生存获益。
体检发现肿瘤患者所占比例逐年增高,但约有1/3的肾癌患者初诊即发现转移,早期局限性肾癌即使在接受根治性肾切术治疗后,仍有20%~30%患者出现转移[26]。发生转移是预后不良指标,多发转移病灶意味着更大的肿瘤负荷。本研究中转移个数≥3个的患者有52例(45.2%),可能与患者肿瘤切除术后未能及时复查、产生症状后已是多发转移有关,体现了术后定期复查随访的重要性。
建立预后模型是通过统计学方法把预测效能大的单因素整合成系统的预测体系。常见的预测模型形式包括公式法、评分法、诺摩图法,通过统计学方法将预后因素转换为公式或图形,从而使复杂多样的预测因素以更直观的方式被用来判断肾癌患者预后风险及生存率,有着较好的准确性和可操作性。预后模型分为非转移性和转移性肾癌预后模型,非转移性预后模型包括加利福尼亚大学洛杉矶分校肾癌预后多因素评分系统(University of California Los Angeles Integrated Staging System,UISS)预后模型[27],SSIGN预后模型[28]和Karakiewicz’s诺摩图[29],转移性预后模型包括(Memorial Sloan-Kettering Cancer Center,MSKCC)预后模型[30]和IMDC预后模型,各种模型有其优劣性且准确度有所差异。IMDC预后模型是HENG等[4]在MSKCC模型基础上,于2009年建立的转移性肾癌靶向治疗预后模型,具有良好的预测效能,且该模型需要观察的因素均是常规检查内容,涉及的预后信息容易收集完整,有很好的临床应用价值。但该模型从建立到验证多是在高加索人群中进行,因此需要更多亚洲人群对该模型进行验证。根据IMDC预后模型分层,本研究患者低危组22例(19.1%)、中危72例(72.6%)、高危21例(18.3%),3组患者中位PFS分别为14.0、11.3、5.6,3组生存曲线明显分离(P<0.01),有较好的区分度。IMDC模型Harrell一致性指数为0.663(95%CI:0.610~0.716),表明该肾癌预后模型有一定的预测功能。
本研究局限性表现在以下几个方面:首先本研究为回顾性研究,可能会出现各种信息偏倚;其次,随访时间较短,中位总生存时间未达到;再次,部分患者私自调整服药剂量,可能会影响服药疗效;最后,单中心研究且病例数较少。因此本研究结果需要多中心合作及更多的病例进一步验证。
总之,本文通过对服用舒尼替尼治疗晚期肾癌患者的临床资料的研究,筛选出了影响肾癌预后的危险因素,并进一步对IMDC预后模型的准确性进行了验证。该结果对于指导临床治疗决策、预测治疗效果、方便医患沟通等方面起到很好的辅助作用。
