APP/PS1小鼠肠道菌群特点及补肾法干预对其的影响
2021-09-13周英奕周梦玲田金洲魏明清倪敬年时晶
周英奕 周梦玲 田金洲 魏明清 倪敬年 时晶


摘要 目的:探究不同月龄APP/PS1双转基因模型小鼠的肠道菌群特点及补肾法对其肠道菌群失衡的影响。方法:将8只6个月龄雄性APP/PS1小鼠随机分为模型组和补肾组;4只6个月龄雄性C57BL/6小鼠作为正常对照组。补肾组小鼠给予补肾法中药灌胃3个月,模型组和正常对照组小鼠均予以等体积羧甲基纤维素(CMC)溶液灌胃。留取小鼠灌胃干预前后的粪便,运用16SrDNA技术检测各组肠道菌群的组成结构。从肠道微生态方面,探讨补肾中药对APP/PS1双转基因小鼠肠道菌群构成的影响。结果:6个月龄时模型组和正常对照组小鼠的肠道菌群差异无统计学意义;与9个月龄正常组比较,模型组小鼠肠道内芽孢杆菌纲丰度明显升高。与模型组比较,补肾组肠道内芽孢杆菌纲丰度明显下降,疣微菌门丰度呈上升趋势。结论:APP/PS1小鼠体内均存在肠道菌群失衡的情况,主要与芽孢菌纲、疣微菌门的丰度水平的变化相关。补肾法可以通过降低芽孢菌纲、升高疣微菌门的丰度来进一步改善AD小鼠肠道菌群失衡状态。
关键词 阿尔茨海默病;APP/PS1转基因小鼠;细菌;肠道菌群;菌群失调;16SrDNA技术;补肾法;中药
Abstract Objective:To explore the characteristics of gut microbiota in APP/PS1 transgenic mice at different ages and the effect of tonifying spleen method on its intestinal flora imbalance.Methods:Eight 6-month-old male APP/PS1 mice were randomly divided into a model group and a kidney-tonifying group,and four 6-month-old male C57BL/6 mice were served as normal control group.The mice in the kidney-tonifying group were treated with Chinese medicinal for kidney-tonifying spleen for 3 months,and the mice in the model group and normal control group were given CMC solution.The feces of mice before and after gavage intervention were collected,and the composition and structure of gut microbiota in each group were detected by 16S rDNA technology.From the aspect of intestinal microecology,the effects of kidney-tonifying Chinese medicinal on gut microbiota of APP/PS1 transgenic mice were investigated.Results:At the age of 6 months,there was no significant difference in gut microbiota between the model group and the normal control group.Compared with the normal group at the age of 9 months,the abundance of Bacilli in the intestinal tract of the model group was significantly higher than normal group.Compared with the model group,the abundance of Bacilli was significantly decreased,and the abundance of Verrucomicrobia in the kidney-tonifying group was increased.Conclusion:The imbalance of gut microbiota was found in APP/PS1 mice,which was mainly related to the changes of the abundance of Bacilli and Verrucomicrobia.Kidney-tonifying method can improve the imbalance of gut microbiota by reducing the abundance of Bacilli and increasing the abundance of Verrucomicrobia.
Keywords Alzheimer′s disease; APP/PS1 transgenic mice; Bacteria; Gut microbiota; Dysbacteriosis; 16srDNA detection; Kidney-tonifying method; Chinese medicinal
中圖分类号:R242;R741文献标识码:Adoi:10.3969/j.issn.1673-7202.2021.14.011
阿尔茨海默病(Alzheimer Disease,AD)是痴呆最常见的类型,占痴呆总人口的60%~80%[1]。流行病学研究发现,现今在中国65岁以上的人群中该病的患病率为3.21%[2],有700多万人罹患此病。而随着社会老龄化问题的逐渐加剧,预计2050年患病数将会增长至2 000万[3]。迄今为止,AD的发病机制尚未完全清楚,研究发现肠道微生物群的动态平衡对维持机体功能活动正常至关重要,且与中枢神经系统(Central Nervous System,CNS)具有相互调节作用[4-5]。近年来,针对AD患者肠道菌群情况及其机制的探讨越来越受到关注[6-7]。
中医自古就有对“痴呆”“健忘”症状的认识,认为其发病与肾虚关系密切。补肾法中药复方可通过多靶点、多途径对AD起到一定的延缓、治疗作用[8]。临床研究发现补肾中药可以改善AD患者的认知功能[9-10];实验研究进一步证实了补肾中药可以改善AD转基因小鼠的认知功能[11],并对其神经元[12]和肠道菌群[13]具有保护作用。本研究是观察不同月龄AD转基因小鼠的肠道菌群情况,并探究补肾法对其肠道菌群失衡的影响。
1 材料与方法
1.1 材料
1.1.1 动物 本研究采用6个月龄SPF级雄性APP/PS1双转基因小鼠8只,同月龄雄性C57小鼠8只(由北京华阜康生物科技股份有限公司提供[SCXK(京)2014-0004]),饲养于北京中医药大学东直门医院药理实验中心屏障环境实验动物室,实验期间动物自由饮水、摄食。实验已通过北京中医药大学东直门医院的伦理审查(伦理审批号:2018-34)。
1.1.2 药物 中药材由北京中医药大学东直门医院制剂中心制备,盐酸多奈哌齐片[卫材(中国)药业有限公司,生产批号:140635]购于北京中医药大学东直门医院。
1.1.3 试剂与仪器 TIANamp粪便提取试剂盒(天根生化科技有限公司,批号:DP328);MiSeq测序平台(Illuminam,美国,型号:PE250)。
1.2 方法
1.2.1 分组与模型制备 将8只6个月龄雄性APP/PS1小鼠随机平均分为模型组和补肾组;4只6个月龄雄性C57BL/6小鼠作为正常对照组。
1.2.2 干预方法 补肾组按照1.2 g/kg(临床等效量)剂量予以补肾法中药溶液灌服,每只小鼠10 mL/(kg·d),连续灌服3个月;模型组、正常对照组均给予等体积0.5%羧甲基纤维素(Sodium Carboxymethyl Cellulose,CMC)钠灌胃,每只小鼠10 mL/(kg·d),连续灌服3个月。
1.2.3 粪便采集及DNA提取 补肾组、模型组及正常对照组于干预第1天及第90天时,留取新鲜的粪便。留取粪便量均大于200 g,将其迅速装入无菌冻存管中放入液氮中速冻,于-80 ℃低温冰箱中保存。使用TIANamp粪便提取试剂盒提取粪便中菌群的DNA用于高通量测序。
1.2.4 肠道菌群检测 对所获得的DNA进行文库质检合格后,用16S特定引物对V3-V4可变区进行扩增;使用Illuminam MiSeq测序平台进行细菌16S rDNA高通量测序及数据转化。得到有效序列數据后,使用Mothur v1.34.4在97%相似水平下对所有序列进行操作分类单元(Operational Taxonomic Units,OTU)归类。使用Mothur1.33.3软件对所得有效数据的序列质量进行过滤,将相似水平在97%以上的序列进行OUT归类。利用RDPclassifer v2.2软件,对照数据库对每个OUT代表序列进行物种注释和分类。
1.3 统计学方法 采用SPSS 22.0统计软件进行数据分析。对肠道菌群数据结果进行OTU聚类和物种分类分析,计量资料使用均数±标准差(±s)表示。对符合正态分布、方差齐的数据,采用独立样本t检验;对不符合正态分布的数据,采用非参数检验。以P<0.05为差异有统计学意义。
2 结果
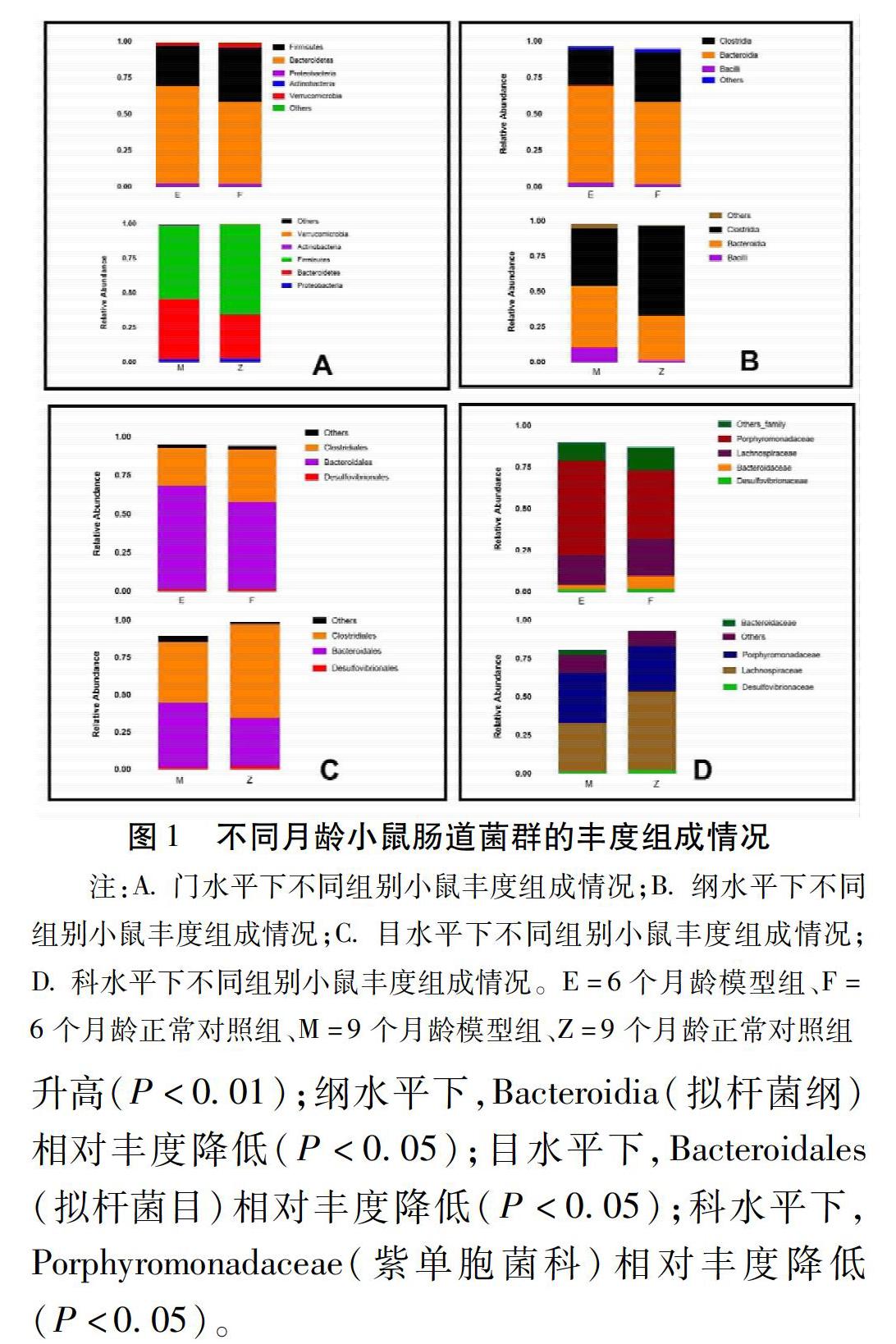
2.1 APP/PS1小鼠与C57BL/6小鼠肠道菌群的丰度组成比较 1)门水平:2组小鼠在6个月龄时肠道内平均丰度水平最高的菌群为Bacteroidetes(拟杆菌门)、其后为Firmicutes(厚壁菌门)。9个月龄时,2组小鼠的Firmicutes(厚壁菌门)相对丰度上升,超过Bacteroidetes(拟杆菌门),成为门水平丰度最高的肠道菌群。分别对2组不同月龄小鼠的肠道菌群丰度进行组间差异性检验分析,发现小鼠在门水平内差异均无统计学意义。见表1,表2,图1。2)纲水平:2组小鼠在6个月龄和9个月龄的肠道菌群丰度水平由高到低均为Bacteroidia(拟杆菌纲)、Clostridia(梭菌纲)、Bacilli(芽孢杆菌纲)。分别对2组不同月龄小鼠的肠道菌群丰度进行组间差异性检验分析,发现纲水平下,6个月龄2组小鼠肠道菌群差异均无统计学意义;当2组小鼠成长至9个月龄时,Bacilli(芽孢杆菌纲)的丰度在模型组中高于正常对照组(P<0.05)。见表1,表2,图2A。3)目水平:2组小鼠在6个月龄时肠道内平均丰度水平最高为Bacteroidales(拟杆菌目)、其后为Clostridiales(梭菌目)。当正常对照组C57BL/6小鼠成长至9个月龄时,肠道菌群中Clostridiales(梭菌目)相对丰度上升,超过Bacteroidales(拟杆菌目),成为目水平丰度最高的肠道菌群;而模型组APP/PS1小鼠的优势菌群排序未发生改变,Bacteroidales(拟杆菌目)仍为目水平丰度最高的肠道菌群。分别对2组不同月龄小鼠的肠道菌群丰度进行组间差异性检验分析,发现小鼠在目水平内差异均无统计学意义。见表1,表2,图1。4)科水平:6个月龄时,2组小鼠在科水平下平均丰度水平最高的菌群为Porphyromonadaceae(紫单孢菌科),其次为Lachnospiraceae(毛螺菌科)。当小鼠成长至9个月龄时,正常对照组小鼠肠道菌群中Lachnospiraceae(毛螺菌科)的丰度升高,超过Porphyromonadaceae(紫单孢菌科)成为丰度水平最高的菌群。分别对2组不同月龄小鼠的肠道菌群相对丰度进行组间差异性检验分析,发现小鼠在目水平内差异均无统计学意义。见表1,表2,图1。
2.2 不同月龄APP/PS1小鼠肠道菌群情况
6个月龄和9个月龄APP/PS1小鼠比较,肠道菌群情况存在差异。见表3。与6个月龄比较,9个月龄时小鼠肠道内门水平下Bacteroidetes(拟杆菌门)相对丰度降低(P<0.05),Firmicutes(厚壁菌门)相对丰度升高(P<0.01);纲水平下,Bacteroidia(拟杆菌纲)相对丰度降低(P<0.05);目水平下,Bacteroidales(拟杆菌目)相对丰度降低(P<0.05);科水平下,Porphyromonadaceae(紫单胞菌科)相对丰度降低(P<0.05)。
2.3 补肾法干预对肠道菌群的影响 对补肾组及模型组小鼠的肠道内细菌组成进行差异性分析,提示部分肠道菌群之间存在差异。见表4。在门水平,2组菌群丰度未见明显差异,但Verrucomicrobia(疣微菌门)的丰度补肾组较模型组有上升趋势。在纲水平,补肾组小鼠Bacilli(芽孢杆菌纲)的水平较模型组下降(P<0.05)。在目水平和科水平下,2组小鼠2组菌群丰度未见明显差异。
3 讨论
“脑-肠轴”假说近年来受到了广泛关注,该假说认为在脑、肠以及肠道菌群微生物间存在一个相互作用的网络,可通过调节内分泌、影响免疫系统及控制迷走神经等多种方式对彼此产生影响[14-16]。人体内寄居的肠道菌群种类繁多,门水平主要包括拟杆菌门、厚壁菌门、变形菌门、放线菌门、梭杆菌门及疣微菌门等[17]。流行病学研究发现人体婴幼儿阶段与老年阶段的肠道菌群组成不同,老年人较婴幼儿阶段肠道内拟杆菌门及变形菌门的相对丰度增加[18]。随着研究的进一步深入,发现肠道内菌群微生物的改变与AD的发生发展密切相关[19]。临床研究证实了AD患者肠道菌群组成与正常对照组比较存在差异,发现AD患者肠道内拟杆菌门的相对含量增加[20]。动物研究也证实了AD模型鼠APP/PS1小鼠的肠道菌群丰度在8个月龄开始与对照组小鼠存在差异[21-22],并随着月龄的增长逐渐加重。为了分析AD小鼠肠道菌群的情况,本研究通过16SrDNA测序技术对小鼠粪便中的肠道菌群进行测定,从微生物群落多样性、组成结构及物种差异等多个角度研究模型组及正常对照组小鼠肠道菌群的组成。
比较分析模型组以及正常对照组2组小鼠肠道菌群随月龄增长的变化特征发现,模型组肠道菌群伴随增龄的特异性变化以芽孢菌纲丰度的上升为主,疣微菌门的丰度有下降的趋势,但是因为样本量较少,差异无统计学意义,需在今后的研究中加大样本量进一步观察其变化情况。经研究证实,芽孢菌纲可以通过影响体内营养代谢,从而影响疾病的进展[23]。Plaza-Díaz等[24]研究还发现肠道内的芽孢杆菌会分泌神经毒素,造成腹泻或对神经的侵害。而疣微菌门可以通过参与调节机体的免疫应答,维持体内的代谢平衡等方式,影响宿主健康[25]。其中的AKK菌为一种已知的益生菌,其通过与肠道黏膜层中的黏蛋白相互作用,修复受损的上皮屏障完整性并改善内毒素血症[26-27]。动物实验也证实了其可以延缓AD模型小鼠的脑部病理变化,缓解空间学习和记忆障碍[28]。
對AD肠道菌群失衡进行调节符合中医理论中整体观念,补肾法干预又满足了对AD疾病辨证论治多为肾虚证型的归纳[29]。本研究发现经补肾法干预后,补肾组小鼠较模型组小鼠肠道内芽孢杆菌纲相对丰度明显下降,疣微菌门的相对丰度呈上升趋势。推测补肾法主要是通过降低肠道内芽孢杆菌纲及升高疣微菌门的丰度,从而改善AD模型小鼠的肠道菌群失衡。目前,针对AD肠道菌群微生物对于认知功能的影响研究尚不充分,本实验的结果提示9个月龄时AD模型鼠的肠道菌群发生了紊乱,但样本量较少,并未探讨其变化的机制。在今后的研究中,将增加样本量及对其他月龄小鼠肠道内菌群情况的观察,并探讨其菌群变化的内在机制。
参考文献
[1]Alzheimer′s Association.2020 Alzheimer′s Disease Facts and Figures[J].Alzheimers Dement,2020,16(3):391.
[2]Jia J,Wang F,Wei C,et al.The prevalence of dementia in urban and rural areas of China[J].Alzheimers Dement,2014,10(1):1-9.
[3]贾建平,侯婷婷.阿尔茨海默病发病机制及治疗进展[J].中华医学杂志,2018,98(29):2351-2356.
[4]Lukiw WJ,Bazan NG.Survival signalling in Alzheimer′s disease[J].Biochem Soc Trans,2006,34(Pt 6):1277-1282.
[5]Bagyinszky E,Giau VV,Shim K,et al.Role of inflammatory molecules in the Alzheimer′s disease progression and diagnosis[J].J Neurol Sci,2017,376:242-254.
[6]Cammarota G,Ianiro G,Bibbò S,et al.Gut microbiota modulation:probiotics,antibiotics or fecal microbiota transplantation?[J].Intern Emerg Med,2014,9(4):365-373.
[7]Giau VV,Wu SY,Jamerlan A,et al.Gut Microbiota and Their Neuroinflammatory Implications in Alzheimer′s Disease[J].Nutrients,2018,10(11):1765.
[8]娄艳芳,张秀君,都文渊,等.补肾健脾方治疗轻、中度阿尔茨海默病的疗效及对血清IL-1β、IL-6、TNF-α水平的影响[J].现代中西医结合杂志,2017,26(15):1646-1649.
[9]邱海鹏,张晓璇,申兴斌,等.补肾益智方联合丁苯酞对阿尔茨海默病患者Aβ,GSH-Px,SOD及MDA水平的影响[J].中国实验方剂学杂志,2016,22(14):187-191.
[10]李晨萌,田金洲,魏明清,等.补肾平肝方联合盐酸多奈哌齐治疗阿尔茨海默病精神行为症状的有效性观察[J].天津中医药,2019,36(10):951-954.
[11]Shi J,Zhang X,Yin L,et al.Retraction Note:Herbal formula GAPT prevents beta amyloid deposition induced Ca2+/Calmodulin-dependent protein kinase Ⅱ and Ca2+/Calmodulin-dependent protein phosphatase 2B imbalance in APPV717I mice[J].BMC Complement Med Ther,2021,21(1):157.
[12]刘盼兴,高媛媛,任璐,等.补肾活血方对SAMP8小鼠学习记忆及海马神经干细胞影响实验研究[J].中华中医药学刊,2020,38(2):7.
[13]Wang J,Ye F,Cheng X,et al.The Effects of LW-AFC on Intestinal Microbiome in Senescence-Accelerated Mouse Prone 8 Strain,a Mouse Model of Alzheimer′s Disease[J].J Alzheimers Dis,2016,53(3):907-919.
[14]Montiel-Castro AJ,González-Cervantes RM,Bravo-Ruiseco G,et al.The microbiota-gut-brain axis:neurobehavioral correlates,health and sociality[J].Front Integr Neurosci,2013,7:70.
[15]Shen L,Liu L,Li XY,et al.Regulation of gut microbiota in Alzheimer′s disease mice by silibinin and silymarin and their pharmacological implications[J].Appl Microbiol Biotechnol,2019,103(17):7141-7149.
[16]Wang Y,Kasper LH.The role of microbiome in central nervous system disorders[J].Brain Behav Immun,2014,38:1-12.
[17]Alam MZ,Alam Q,Kamal MA,et al.A possible link of gut microbiota alteration in type 2 diabetes and Alzheimer′s disease pathogenicity:an update[J].CNS Neurol Disord Drug Targets,2014,13(3):383-390.
[18]Odamaki T,Kato K,Sugahara H,et al.Age-related changes in gut microbiota composition from newborn to centenarian:a cross-sectional study[J].BMC Microbiol,2016,16:90.
[19]Mayer EA,Tillisch K,Gupta A.Gut/brain axis and the microbiota[J].J Clin Invest,2015,125(3):926-938.
[20]Vogt NM,Kerby RL,Dill-McFarland KA,et al.Gut microbiome alterations in Alzheimer′s disease[J].Sci Rep,2017,7(1):13537.
[21]Harach T,Marungruang N,Duthilleul N,et al.Reduction of Abeta amyloid pathology in APPPS1 transgenic mice in the absence of gut microbiota[J].Sci Rep,2017,7:41802.
[22]Zhang L,Wang Y,Xiayu X,et al.Altered Gut Microbiota in a Mouse Model of Alzheimer′s Disease[J].J Alzheimers Dis,2017,60(4):1241-1257.
[23]李玉波,郝改梅,贾海骅,等.从肠道菌群多样性探讨越鞠丸对ApoE~(-/-)小鼠血脂的影响[J].中国中医基础医学杂志,2017,23(11):1559-1563.
[24]Plaza-Díaz J,Gómez-Fernández A,Chueca N,et al.Autism Spectrum Disorder(ASD) with and without Mental Regression is Associated with Changes in the Fecal Microbiota[J].Nutrients,2019,11(2):337.
[25]Everard A,Belzer C,Geurts L,et al.Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet-induced obesity[J].Proc Natl Acad Sci U S A,2013,110(22):9066-9071.
[26]Shin NR,Lee JC,Lee HY,et al.An increase in the Akkermansia spp.population induced by metformin treatment improves glucose homeostasis in diet-induced obese mice[J].Gut,2014,63(5):727-735.
[27]孫英新,黄洋,曾妙,等.基于“肠道菌群-炎症”通路探讨丹蒌片防治ApoE-/-小鼠动脉粥样硬化的作用及机制[J].中草药,2020,51(9):2492-2500.
[28]Ou Z,Deng L,Lu Z,et al.Protective effects of Akkermansia muciniphila on cognitive deficits and amyloid pathology in a mouse model of Alzheimer′s disease[J].Nutr Diabetes,2020,10(1):12.
[29]陈欣欣,金鑫瑶,庞稳泰,等.复方丹参注射液联合西药治疗血管性痴呆有效性及安全性的系统评价[J].中国中药杂志,2021,46(1):247-252.
(2020-09-01收稿 责任编辑:张雄杰)
