沙利度胺减轻肾病综合征小鼠肾脏纤维化
2021-09-13高宏宇张国英刘秋菊
高宏宇,张国英,刘秋菊,王 晔,张 莉,陈 超
(1.保定市第二医院 肾病科,河北 保定 071051; 2.河北大学附属医院 肾内科,河北 保定 071000)
肾病综合征(nephrotic syndrome)是一种常见的慢性肾脏疾病,是引起肾功能衰竭的主要原因,膜性肾病是肾病综合征的主要病理类型[1]。研究显示,脂质代谢异常、炎性反应、免疫功能紊乱等是引起肾病综合征发病的主要原因,但其具体发病机制尚不完全明了[2]。目前,临床上多使用糖皮质激素及免疫抑制剂进行治疗,但其副作用大,部分患者易产生激素依赖和抵抗,治疗效果较差,因此寻找新的高效治疗药物对疾病治疗具有重要意义。肾脏纤维化是慢性肾脏疾病转变为肾衰竭中重要的病理损伤过程[3],研究显示,表皮生长因子受体(epidermal growth factor receptor,EGFR)属于受体酪氨酸激酶蛋白家族,与其配体结合后可以诱导激活细胞外信号调节激酶(extracellular regulated protein kinase,ERK),参与调节肾纤维化过程[4]。沙利度胺(thalidomide)是谷氨酸衍生物,具有抗炎、抗纤维化等作用,对肺间质纤维化具有显著的临床治疗效果,可以有效改善患者的肺功能[5],然而关于沙利度胺在肾病综合征中研究报道较少,本研究通过观察沙利度胺对膜性肾病小鼠的影响,初步探讨其可能作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物:SPF级雄性昆明小鼠,8周龄,体质量20 g左右,北京生命科学研究所动物实验中心,合格证号为SYXK(京)2015-0002,适应性饲养十周后,进行后续实验。本研究经本院动物伦理委员会批准同意。批准文号(BDEYDS00029)
1.1.2 试剂:沙利度胺(thalidomide)(南通飞宇生物科技有限公司);来氟米特(leflunomide)(百灵威科技有限公司);白介素8(IL-8)、白介素6(IL-6)和肿瘤坏死因子-α(TNF-α) ELISA试剂盒(上海酶联生物科技公司);PrimeScript RT试剂盒(TaKaRa公司);Masson染色试剂盒(飞净生物科技有限公司);兔源多克隆EGFR抗体、p-EGFR抗体、ERK抗体、p-ERK抗体、GAPDH抗体和山羊抗兔IgG高度交叉吸附二级抗体(赛默飞世尔科技有限公司);苏木精染液、伊红染液和PAS染色试剂盒(北京索莱宝科技有限公司);BCA蛋白浓度检测试剂盒(上海碧云天生物技术研究所)。
1.2 实验方法
1.2.1 小鼠的分组及处理:将小鼠随机分为对照组、模型组参考文献[6]制备膜性肾病小鼠模型、沙利度胺组(灌胃给予沙利度胺溶液100 mg/kg)、来氟米特组(灌胃给予来氟米特溶液5 mg/kg),每组15只。
1.2.2 24 h-Upro(24-hour urine protein)的检测:分别于造模前、造模后、及末次给药24 h后,将各组小鼠置于代谢笼中,禁食、不禁水,收集24 h尿液,记录尿量后采用生化自动检测仪检测24 h-Upro。
1.2.3 各组小鼠血清中生化指标及血清中炎性因子的检测:末次给药24 h后,腹腔注射10%水合氯醛进行麻醉,采腹主动脉血10 mL,离心取血清,一部分用全自动生化分析仪检测各组小鼠总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、血尿素氮(blood urea nitrogen,BUN)、血肌酐(serum creatinine,Scr)含量。一部分用酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)试剂盒分别检测IL-6、IL-8、TNF-α表达水平,具体操作步骤参考其说明书。
1.2.4 各组小鼠肾脏组织病理学的观察:取血后,分离肾脏组织,取1.0 g组织存储于-80 ℃冰箱中备用,剩余组织用4%多聚甲醛固定,制备常规石蜡切片,分别进行苏木素-伊红(HE)染色、马松(Masson)染色、高碘酸-无色品红(PAS)染色。HE和PAS染色观察评估肾结构损伤、Masson染色观察肾脏纤维化程度。
1.2.5 实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)检测肾脏组织中EGFR、ERK mRNA表达水平:取0.5 g肾脏组织提取总RNA,用PrimeScript RT试剂盒合成cDNA,以其为模板,进行RT-qPCR。反应条件:预变性95 ℃ 3 min,变性95 ℃ 5 s,退火60 ℃ 30 s,48个循环,引物序列(表1)。以GAPDH为内参基因,采用2-△△Ct法计算EGFR、ERK相对表达量。

表1 RT-qPCR引物序列Table 1 RT-qPCR primer sequences
1.2.6 Western blot检测各组小鼠肾脏组织中EGFR、ERK蛋白表达:取0.5 g各组小鼠肾脏组织提取蛋白,用BCA蛋白浓度检测试剂盒检测蛋白浓度,取50 μg蛋白变性,进行SDS-PAGE、转膜、封闭、孵育一抗(抗EGFR、ERK、p-EGFR、p-ERK、GAPDH抗体,1∶1 000)4 ℃过夜,次日加二抗(1∶5 000),室温孵育2 h,ECL化学发光法进行显色,用GAPDH作内参,扫描胶片,Tanon 600图像分析系统分析条带吸光度值。
1.3 统计学分析

2 结果
2.1 沙利度胺对小鼠24 h-Upro的影响
与对照组相比,模型组小鼠24 h-Upro显著升高(P<0.05)。治疗4周后,与模型组相比,来氟米特组、沙利度胺组小鼠24 h-Upro显著降低(P<0.05)。(表2)。
表2 沙利度胺对小鼠24 h-Upro的影响
2.2 沙利度胺对小鼠生化指标的影响
与对照组相比,模型组小鼠血清中TC、TG、BUN、Scr含量显著升高(P<0.05);与模型组相比,来氟米特组、沙利度胺组小鼠血清中TC、TG、BUN、Scr含量显著降低(P<0.05)(表3)。
表3 沙利度胺对小鼠生化指标的影响Table 3 Effects of thalidomide on biochemical indexes of
2.3 沙利度胺对小鼠血清中炎性因子IL-6、IL-8、TNF-α的影响
与对照组相比,模型组小鼠血清中炎性因子IL-6、IL-8、TNF-α表达显著升高(P<0.05);与模型组相比,来氟米特组、沙利度胺组小鼠血清中炎性因子IL-6、IL-8、TNF-α表达显著降低(P<0.05)(表4)。
表4 沙利度胺对小鼠血清中炎性因子IL-6、IL-8、TNF-α的影响
2.3 沙利度胺对小鼠肾脏组织病理变化的影响
HE染色观察肾小管上皮细胞的损伤和肾间质水肿情况,HE染色后细胞核、细胞内核糖体呈蓝紫色,细胞质呈红色。结果显示对照组小鼠肾小球结构完整、肾小管上皮细胞排列整齐无明显病理变化;与正常对照组相比,模型组小鼠肾小球细胞排列紊乱,肾间质有炎性细胞浸润;与模型组相比,来氟米特组、沙利度胺组小鼠上述病理症状明显减轻(图1)。
图1 各组小鼠肾脏组织HE染色Fig 1 HE staining of kidney tissue in each group (scale bar=100 μm)
PAS染色可观察肾小球内的细胞增生、浸润和系膜基质等情况,PAS糖原颗粒呈紫红色,细胞核呈蓝色,其他呈淡粉红色。结果显示对照组小鼠肾小球细胞结构正常,无增生、浸润等病理变化;与正常对照组相比模型组小鼠肾小球细胞增大、系膜增生;与模型组相比,来氟米特组、沙利度胺组小鼠上述病理症状明显减轻(图2)。

图2 各组小鼠肾脏组织PAS染色Fig 2 PAS staining of kidney tissue of mice in each group (scale bar=100 μm)
Masson染色观察肾小球基底膜、免疫复合物及胶原纤维等情况,Masson染色后纤维化肾间质和未纤维化的肾间质、胶原纤维蓝色,胞质和肌纤维呈红色。结果显示对照组小鼠肾小球基底膜结构完整、间质蓝色胶原沉积较少,纤维化程度低;与对照组相比模型组小鼠肾小球基底膜和间质蓝色胶原沉积明显增多,组织纤维化程度高;与模型组相比,来氟米特组、沙利度胺组小鼠肾小球基底膜和间质蓝色胶原沉积明显减少(图3)。
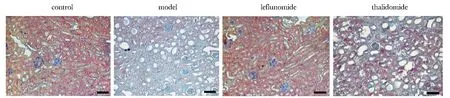
图3 各组小鼠肾脏组织Masson染色Fig 3 Masson staining of kidney tissue in each group (scale bar=100 μm)
2.4 沙利度胺对小鼠肾脏组织中EGFR、ERK mRNA及蛋白表达的影响
与对照组相比,模型组小鼠肾脏组织中EGFR、ERK mRNA水平及p-EGFR/EGFR、p-ERK/ERK蛋白表达显著升高(P<0.05);与模型组相比,来氟米特组、沙利度胺组小鼠肾脏组织中EGFR、ERK mRNA水平及p-EGFR/EGFR、p-ERK/ERK蛋白表达显著降低(P<0.05)(图4,表5)。
表5 沙利度胺对小鼠肾脏组织中EGFR、ERK mRNA及蛋白表达的影响

A.control group;B.model group;C.leflunomide group;D.thalidomide group图4 各组小鼠肾脏组织EGFR、ERK蛋白表达Fig 4 Expression of EGFR and ERK protein in kidney tissue of mice in each group
3 讨论
膜性肾病其主要临床病理特征为全身肿胀、高血脂、有大量蛋白尿[7]。造模后小鼠肾小球体积增大,病变肾小管上皮细胞有嗜复红蛋白沉积,肾小管中有空泡性病伴有炎性细胞浸润,24 h-Upro、血清中TC、TG、BUN、Scr含量升高,与报道[6]一致,提示膜性肾病小鼠模型构建成功,小鼠体内出现血脂异常、炎性反应和肾脏纤维化。膜性肾病在环境、遗传等多种因素作用下,其患病率逐年增加[8]。因此,寻找对膜性肾病有积极治疗作用的方法和药物,对其临床应用具有一定科研价值。研究显示,沙利度胺联合糖皮质激素可以有效治疗膜性肾病且副作用轻微[9]。沙利度胺可抑制糖尿病肾病的炎性反应和纤维化过程。本研究发现,沙利度胺可以有效缓解膜性肾病小鼠体内血脂异常和炎性反应,抑制肾脏纤维化。
肾脏纤维化是膜性肾病重要的病理过程,肾纤维化是由慢性炎性导致的,炎性是炎性因子和细胞因子通过上皮向间质转化刺激细胞外基质成分的过度积累,导致肾纤维化[10]。膜性肾病小鼠血清中IL-2、TNF-α含量升高[11]。本研究发现, 与对照组,相比模型组小鼠血清中炎性因子IL-6、IL-8、TNF-α表达升高,提示膜性肾病引起机体炎性反应。沙利度胺可减少血液中TNF-α含量,对肾脏有保护作用[12]。本研究发现,沙利度胺可以抑制炎性因子分泌,减轻小鼠机体炎性反应。
EGFR的增强激活与肾纤维化的发生和发展有关,EGFR的激活导致ERK1/2的磷酸化,从而导致纤维化途径的激活,EGFR是调节肾纤维化的潜在治疗靶点[13]。膜性肾病小鼠体内ERK1/2磷酸化水平升高[14]。本研究发现,EGFR、ERK磷酸化蛋白表达与肾组织纤维化有关。通过阻断EGFR抑制Akt和ERK 1/2信号通路,可以防止肾切除的小鼠肾纤维化,对其肾脏有保护作用。另外,沙利度胺可以抑制EGFR、ERK mRNA及磷酸化蛋白水平表达,推测沙利度胺可能通过抑制EGFR/ERK信号通路激活,减轻机体炎性反应,缓解肾脏损伤。
综上所述,沙利度胺可能通过抑制EGFR/ERK信号通路,缓解机体炎性反应,抑制肾脏纤维化,对肾脏损伤有保护作用,但其具体作用机制仍需进一步研究。
