水稻叶片衰老基因LPS1的克隆与功能研究
2021-09-13褚晓洁芦涛叶涵斐王盛林晗吴先美何瑞严钢王跃星李三峰路梅胡海涛杨窑龙饶玉春
褚晓洁 芦涛 叶涵斐 王盛 林晗 吴先美 何瑞 严钢 王跃星 李三峰 路梅 胡海涛,* 杨窑龙,* 饶玉春,*
水稻叶片衰老基因的克隆与功能研究
褚晓洁1芦涛1叶涵斐1王盛1林晗1吴先美2何瑞2严钢1王跃星2李三峰2路梅1胡海涛1,*杨窑龙2,*饶玉春1,*
(1浙江师范大学化学与生命科学学院, 浙江金华 321004;2中国水稻研究所国家水稻改良中心/水稻生物学国家重点实验室, 杭州 310006;*通信联系人, E-mail:ryc@zjnu.cn, yangxiao182@126.com, haitao-hu@zjnu.cn)
【目的】早衰突变体是研究早衰机制的良好载体,对于探究早衰的遗传机理与作用机制及提高水稻的产量和品质具有重要作用。【方法】本研究利用EMS诱变获得了一个早衰突变体,并对该突变体及其野生型进行表型观察、细胞学及组织化学分析、生理生化分析、遗传分析、基因定位和激素处理。【结果】的叶片从3叶期开始发黄,成熟期株高、有效分蘖数、结实率、千粒重等极显著降低。电镜观察发现叶表面光滑,硅质化突起和叶绿体数目减少、片层结构紊乱。生理生化分析表明中有大量的活性氧积累,同时伴有蛋白质的降解、细胞膜的损伤以及大规模的细胞死亡。遗传分析表明该早衰表型受单隐性核基因控制,并且其在第5染色体上编码了一个泛素结合酶。亚细胞定位结果证明LPS1蛋白在细胞质与核中均有表达。外源激素处理发现,对外源激素的处理更为敏感,且突变促进了ABA合成相关基因的表达。【结论】突变使水稻ABA合成信号途径异常,进而引发H2O2等一系列与衰老相关生理指标的异常变动,导致过早衰老,最终造成水稻产量严重降低。
水稻;早衰;遗传分析;亚细胞定位;激素
植物的衰老是植株在生长发育的最后阶段自发启动的一种程序性细胞死亡(programmed cell death,PCD)的过程[1]。这一过程可以使衰老部位中的营养物质和代谢产物等转移至其他部位继续参与植物体的生长发育,对植物的生长发育起着不可替代的作用[2]。衰老的有序进行在很大程度上保障了作物的产量及品质安全。植物衰老的主要表现形式是叶片衰老[3-4],叶片是水稻进行光合作用和呼吸作用最为重要的源器官,直接关系着水稻的产量和质量安全。叶片发生早衰是影响水稻高产优质的重要决定因素之一[5],水稻叶片发生早衰会严重影响叶片进行光合作用的效率,进而制约水稻产量的提高。因此,深入研究水稻叶片早衰的调控模型和分子机制具有重要意义。
目前对水稻叶片衰老的研究主要是利用衰老突变体鉴定叶片衰老相关基因(senescence- associated genes, SAGs)来解析水稻衰老的分子机制,在植物叶片衰老数据库LSD 3.0(https:// bigd.big.ac.cn/lsd/index.php)中共收集了5853个与衰老相关的基因[6],其中有188个是在水稻中鉴定的,这表明调控植物叶片衰老的基因涉及复杂的调控网络。根据SAGs所属功能的不同,水稻叶片衰老相关基因主要分为转录因子基因([7]、[8]、[9]、[10]、[11]等)、叶绿体发育及叶绿素降解相关基因([12]、[13]、[14]、[15]等)、激素代谢相关基因([16]、[16]、[17]、[18]、[19]、[20]等)和蛋白酶或物质转运代谢相关基因([21]、[22]、[23]、[24]、[25]、与[26]等)五类。
水稻生长发育的过程是一个不断对抗和适应生物胁迫与非生物胁迫等不利环境的过程,这一过程由基因控制,并受内外部环境因素的影响和诱导。植物激素在调节生长发育、参与植物抗逆性方面有着不可缺少的作用[27]。一般来说,脱落酸(abscisic acid,ABA)[28]、乙烯(ethylene,ETH)[29]和茉莉酸类物质(jasmonates,JAs)[30]等激素可加快叶片衰老,细胞分裂素(cytokinin,CTK)[31]、生长素(auxins,IAA)[32]和赤霉素(gibberellins,GAs)[33]等激素可以延缓叶片衰老[34]。ABA是植物生长发育、抵抗逆境的重要激素,具有调节植物生长、抑制种子萌发以及加快衰老等效应[35-36]。研究发现,ABA可以有效抑制水稻幼苗地上部的生长[37]。低浓度的ABA可以促进初生根的生长,而高浓度的ABA则抑制初生根的生长[38-39]。Hung等[40]研究发现,ABA可以通过诱导H2O2的产生,引起植物叶片的衰老。水稻离体叶片进行ABA处理后,引起离体叶片中H2O2和MDA含量显著升高,叶绿素含量下降,进而加速叶片衰老[41]。然而现有研究中,水稻ABA信号途径中仅有少数基因的功能被清晰阐释,关于控制ABA合成和代谢相关基因尚缺乏充分研究。
为进一步研究水稻叶片衰老的分子机制,同时探究激素参与水稻衰老的调控机理,本研究利用EMS诱变获取一个叶片早衰突变体,通过对其进行表型考查、生理生化分析、组织学及细胞学分析、基因精细定位以及表达分析等,以期进一步解析的功能,为今后建立水稻叶片衰老的调控网络提供参考。
1 材料与方法
1.1 实验材料
利用甲基磺酸乙酯(EMS)诱变龙粳31,从其突变体库中筛选出一个叶片早衰突变体,通过多代自交发现其早衰表型可稳定遗传,将其命名为()。将与籼稻品种浙辐802杂交,利用F1与F2群体进行遗传分析与基因定位。2016–2020年,将材料种植于浙江省金华市浙江师范大学试验田、中国水稻研究所杭州试验基地以及海南陵水试验基地,常规水肥管理。
1.2 农艺性状的观察统计
在水稻成熟期选取野生型和各10株,对株高、分蘖、结实率、粒长、粒宽、粒厚、千粒重等农艺性状进行调查,并利用GraphPad Prism 6软件及Excel进行统计分析。
1.3 叶绿素含量测定
取分蘖期长势一致的野生型和叶片,去除叶脉,分别称取野生型和倒一、倒二、倒三叶0.3 g,每组3份样品。置于10 mL离心管中,并加入5 mL 95%乙醇,4℃下避光处理24 h,期间轻微上下颠倒数次,使光合色素充分浸提在溶液中。取上清,分别测定其在波长为665 nm、649 nm和470 nm处的吸光值,然后参照Lichtenthaler[42]的方法计算叶绿素a、叶绿素b以及类胡萝卜素的含量。
1.4 水稻叶片电镜观察
1.4.1 水稻叶片扫描电镜观察
取分蘖期野生型和倒2叶叶片,去除叶脉,剪成0.5 cm的小段,立即置于装有2.5%戊二醛固定液的2 mL离心管中,抽真空1~2 h使样品沉于管底,4℃下保存过夜。二次固定、脱水、临界点干燥、镀膜及电镜观察交由浙江大学电镜中心完成。
1.4.2 水稻叶片透射电镜观察
取样及固定方法同1.4.1,4℃下过夜固定后,委托浙江大学电镜中心完成漂洗、脱水、包埋、切片、染色及电镜观察等工作。
1.5 组织化学分析
1.5.1 H2O2积累检测
使用二氨基联苯(Diamino benzidine, DAB)可以直接观察水稻叶片组织中H2O2积累。参考游均等[43]进行DAB染色,取分蘖期野生型和倒2叶叶片完全浸泡在0.5 mg/mL DAB染液中,抽真空15~30 min,室温孵育过夜。倒掉染液,用清水冲洗干净,将叶片移入含有95%乙醇的管中,沸水浴煮至完全脱色后拍照。
1.5.2 氧自由基含量检测
使用氮蓝四唑(nitrotetrazolium blue chloride, NBT)染液可以直接反映水稻叶片中细胞内的氧自由基含量。参考游均等[43]进行NBT染色,取分蘖期野生型和倒2叶叶片完全浸泡在1 mg/mL NBT染液中,抽真空15~30 min,室温孵育过夜。倒掉染液,用清水冲洗干净,将叶片移入含有95%乙醇的管中,沸水浴煮至完全脱色后拍照。
1.5.3 细胞凋亡检测
取分蘖期的野生型和相同部位的叶片,放入装有2 mL FAA固定液的离心管中[44]。抽真空至样本沉淀,然后按照Promega公司的TUNEL(TdT-mediated dUTP Nick-End Labeling)细胞凋亡检测试剂盒对样品进行检测。
1.6 生理指标测定
取分蘖期野生型和倒2叶叶片,采用苏州格锐思生物科技有限公司试剂盒,测定过氧化氢酶(CAT)、过氧化物酶(POD)和超氧化物歧化酶(SOD)的活性,以及过氧化氢(H2O2)和丙二醛(MDA)的含量等与衰老相关的生理指标,每个样品3次重复。
1.7 遗传分析与基因定位
将与籼稻品种浙辐802进行正反交,获得F1代,F1代自交获得F2代,观察F1和F2表型,并统计F2代正常表型与早衰表型分离比,进行遗传分析。采用TPS法提取水稻叶片DNA。利用本实验室已有的平均分布于12条染色体上的268对SSR标记引物,对亲本以及F1进行多态性分析。选取多态性较好的分子标记,利用F2群体中与突变体表型一致的植株的DNA,对目的基因进行连锁分析。将目的基因初步定位到染色体的某一个区域内,并继续设计新的分子标记,用于精细定位。通过对已公布的日本晴序列与籼稻9311序列的差异比对,利用Primer 3网站(https://bioinfo.ut.ee/primer3-0.4.0/)在线设计引物,进一步对目的基因进行基因定位。相关引物序列见表1。
1.8 候选基因分析及测序
精细定位将目的基因缩小在一个小区间内,根据水稻基因注释网站RGAP(Rice Genome Annotation Project, http://rice.plantbiology.msu.edu/),分析该区段内所有的开放阅读(ORF, open reading frame),找到候选基因,设计测序引物对野生型和的候选基因序列进行测序,利用SeqMan软件进行序列比,找到突变位点,构建遗传图谱。
1.9 亚细胞定位
为了检测蛋白表达的位置,我们利用-F和-R引物对扩增的基因的CDS为模板,进一步运用带有相关接头的引物扩增目的片段,通过In-fusion酶连接Ⅰ和Ⅰ线性化的载体,获得载体。通过农杆菌(EHA105)介导烟草的瞬时转化,利用激光扫描共聚焦显微镜观察绿色荧光蛋白。引物序列参见表1。
1.10 外源激素处理
将野生型与突变体成熟的种子去壳后,用70%的酒精消毒2 min,再用30%的次氯酸钠溶液消毒30 min,然后用蒸馏水冲洗干净,分别接种于含有0、0.2 μmol/L和0.25 μmol/L ABA的1/2 MS培养基上,放在人工气候培养箱中培养10 d后统计根长和株高并拍照。培养箱光周期为光照14 h/黑暗10 h,温度为30℃,相对湿度为70%。
1.11 实时荧光定量PCR(qRT-PCR)
利用AXYGEN试剂盒提取水稻植株总RNA,使用TOYOBO试剂盒逆转录为cDNA。采用qRT-PCR检测野生型与突变体中叶绿体相关基因与ABA代谢相关基因的表达水平,以水稻为内参基因。反应体系包括1 μL cDNA模板,5 μL 2×SYBR混合液,上下游引物各1 μL,ddH2O补至10 μL。反应程序为:95℃下30 s,95℃下5 s,55℃下10 s,72℃下5 s,40个循环。每个反应3次重复,以2计算基因相对表达水平。运用GraphPad Prism 6软件和Excel 2010软件分析数据,通过测验进行差异显著性分析。qRT-PCR所用引物见表1。
2 结果与分析
2.1 早衰突变体lps1的表型鉴定及农艺性状统计
无论是在浙江金华、杭州还是在海南种植,早衰表型都非常稳定。自然生长条件下,3叶期时,野生型与的株高无显著差异(图1-A),但开始出现叶片发黄表型(图1-B)。随着植株的生长发育,叶片发黄的面积逐渐变大,叶尖开始枯死,但基部持绿。分蘖期,的株高变矮,这种表型一直持续到成熟期(图1-C、D)。
此外,在成熟期的株高、有效分蘖、结实率、千粒重等均极显著降低(图1-F~I);在粒型方面,的粒长和粒厚也显著低于野生型(图1-E、J~L),这也是导致其千粒重显著下降的重要原因。
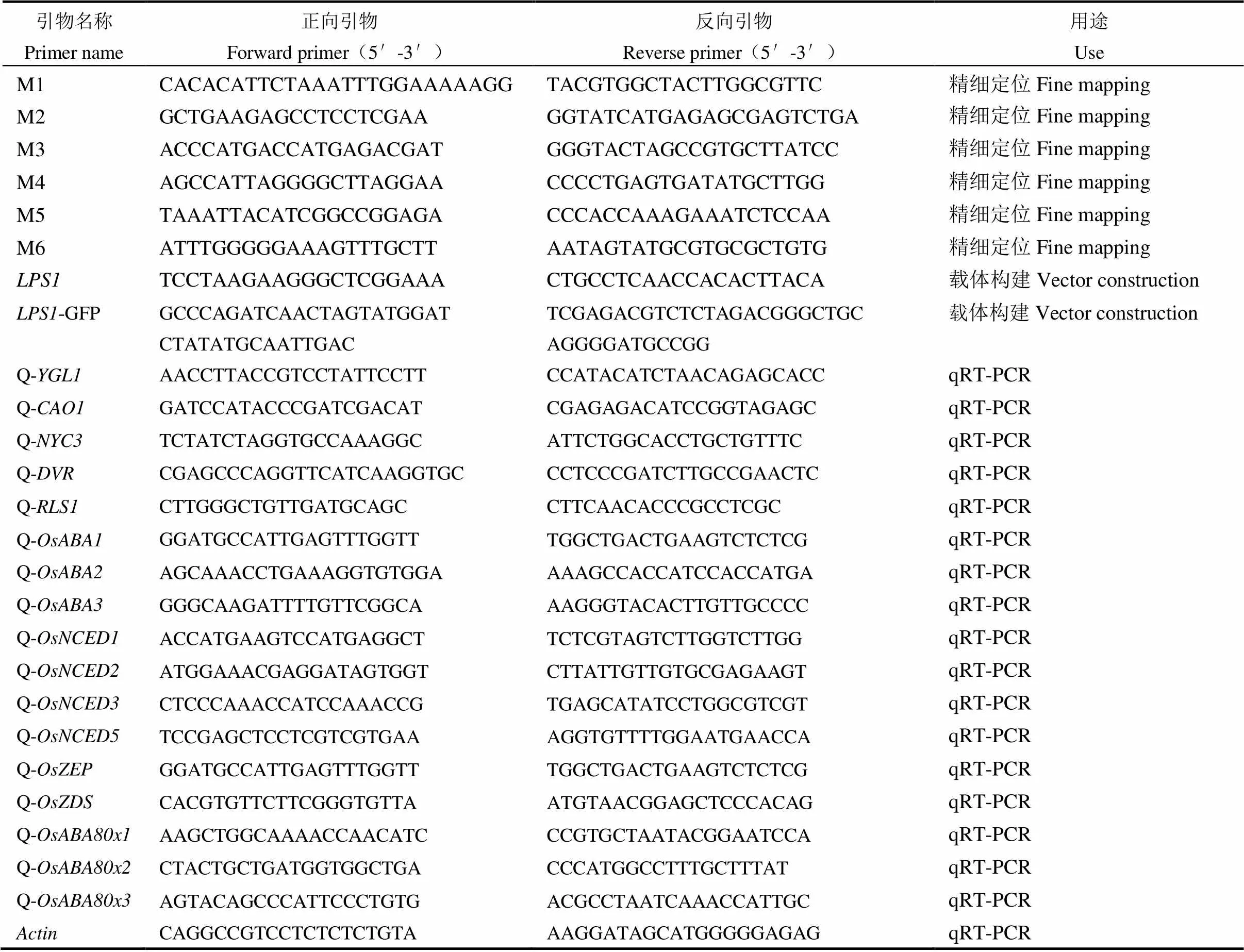
表1 本研究所用引物及序列
2.2 lps1的叶绿素含量及相关基因表达分析
叶绿素在光合作用中起着核心作用。为了探究的叶黄表型是否与叶绿素水平相关,我们测定了分蘖期在未出现黄叶表型的倒1叶(L1),刚出现黄叶表型的倒2叶(L2)和明显出现黄叶表型的倒3叶(L3)叶绿素含量(图2-A)。结果发现,除类胡萝卜素的含量明显增加外,的叶绿素a和叶绿素b含量均极显著降低,并随着叶片的衰老下降。而野生型中叶绿素含量无明显变化(图2-B~D)。总的来讲,的叶绿素含量显著降低。
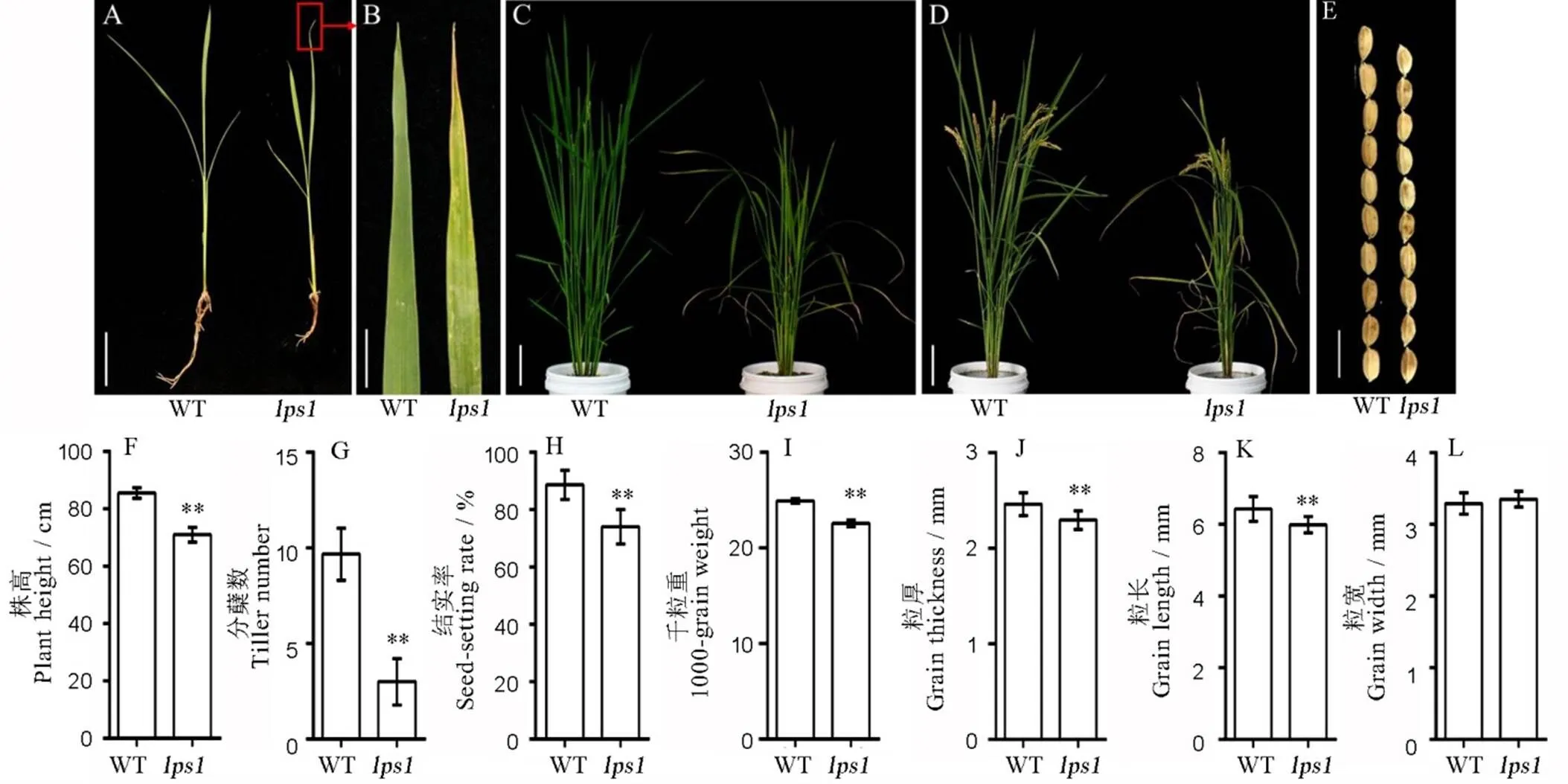
A−3叶期植株表型(标尺=3 cm);B−3叶期叶片表型(标尺=1 cm);C−分蘖期表型(标尺=6 cm);D−成熟期表型(标尺=8 cm);E−籽粒表型(标尺=10 cm); F~I−野生型与lps1的农艺性状(株高、分蘖、结实率、千粒重);J~L, 粒厚、粒长和粒宽。*和**分别表示野生型与lps1在0.05和0.01水平上差异显著。
Fig.1.Phenotype and agronomic traits of the wild type and.
为了进一步探索中叶绿素水平降低的原因,我们对分蘖期野生型和倒2叶叶绿素代谢相关基因的表达进行了检测。发现中与叶绿素合成相关的基因的表达水平均极显著下调,而与叶绿素降解相关的基因仅的表达水平显著下调,的表达没有显著差异(图2-E)。说明基因突变可以影响水稻叶片中叶绿素的合成与降解,进而诱导叶片发生衰老。
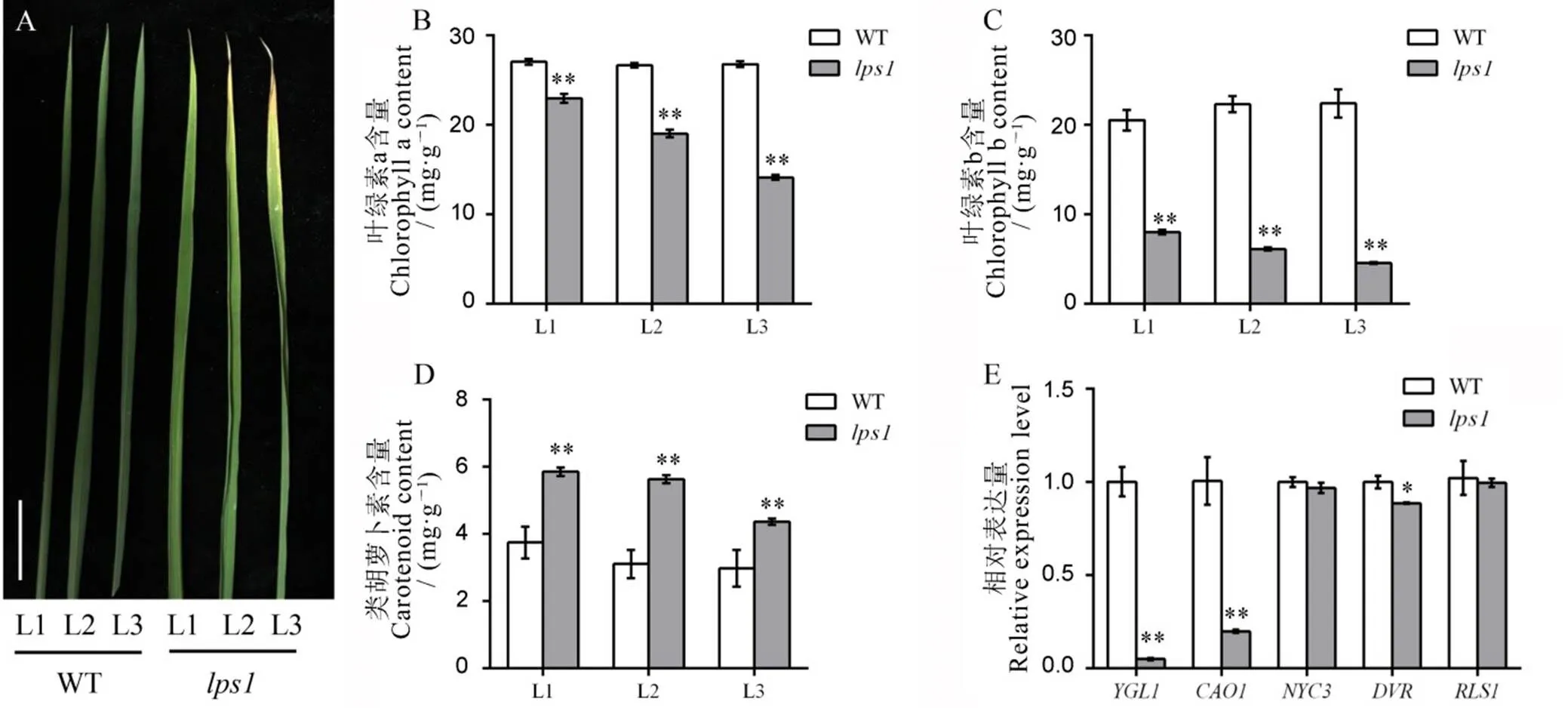
A−分蘖期野生型与lps1不同部位叶表型,标尺为2 cm;B~D−野生型与lps1叶绿素a、叶绿素b和类胡萝卜素含量测定;E−叶绿素合成与代谢相关基因表达水平。L1―倒1叶;L2―倒2叶;L3―倒3叶。*和**分别表示野生型与lps1在0.05和0.01水平上差异显著
Fig.2.Chlorophyll contents and related gene expression analysis at the tillering stage.
2.3 水稻早衰突变体lps1的电镜分析
为了观察叶片表面的微观特征,我们对野生型和分蘖期的叶片进行了扫描电镜观察。结果发现,由于缺少针状突起,叶表面较野生型光滑;的硅质化突起排列杂乱,且气孔周围的硅质化突起显著减少,气孔孔径也明显大于野生型(图3)。
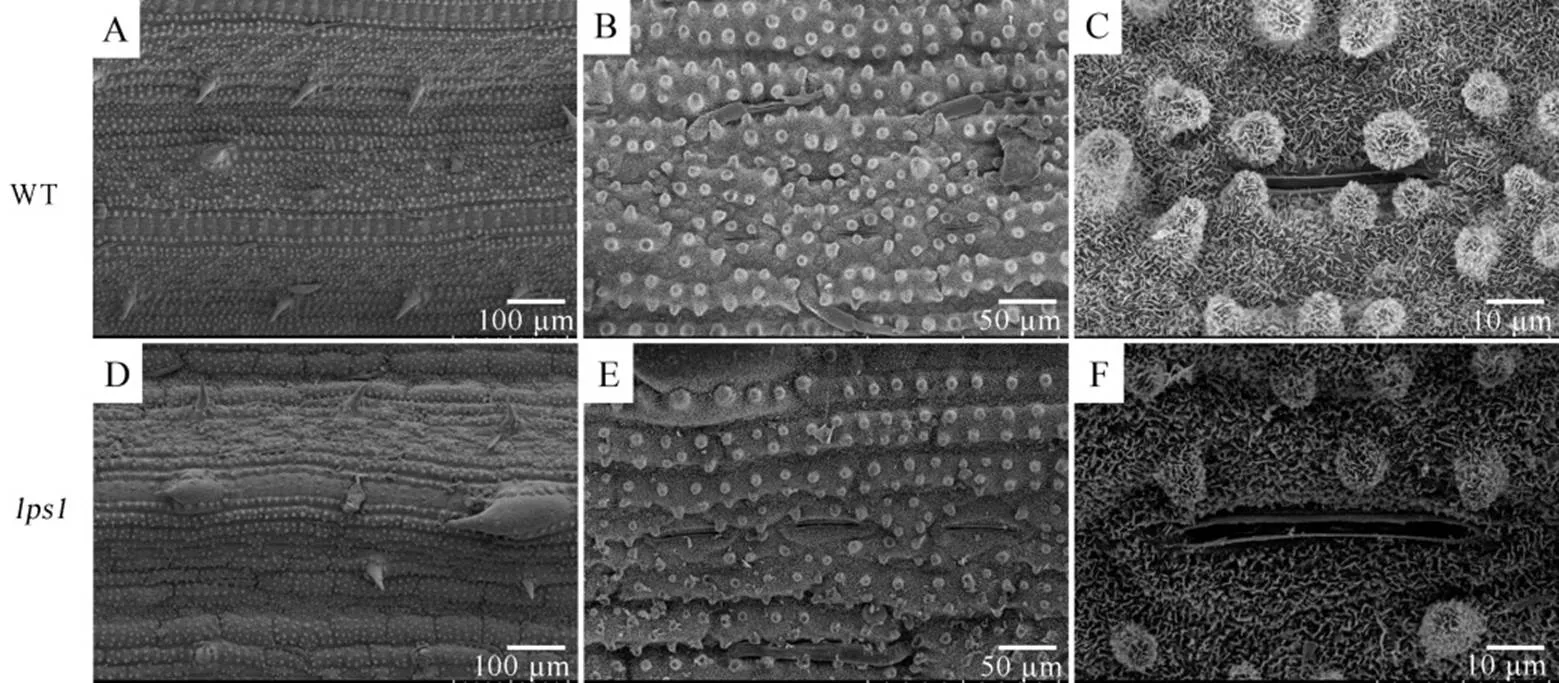
图3 水稻野生型(A~C)和早衰突变体lps1(D~F)叶片下表皮的扫描电镜(SEM)观察
Fig.3.Scanning electron microscope (SEM) observations of the epidermis of the wild type (A−C) and(D−F).
为了进一步探讨衰老期间中叶绿素水平降低的原因,我们通过透射电镜(TEM),比较了分蘖期和野生型中相同部位叶片的叶绿体超微结构,发现的叶绿体数目明显减少,同时叶绿体中的嗜锇颗粒数明显增多变大,且淀粉颗粒明显增多,叶绿体内部的片层结构紊乱。这些特征表明,突变可能导致叶绿体发育不良(图4)。
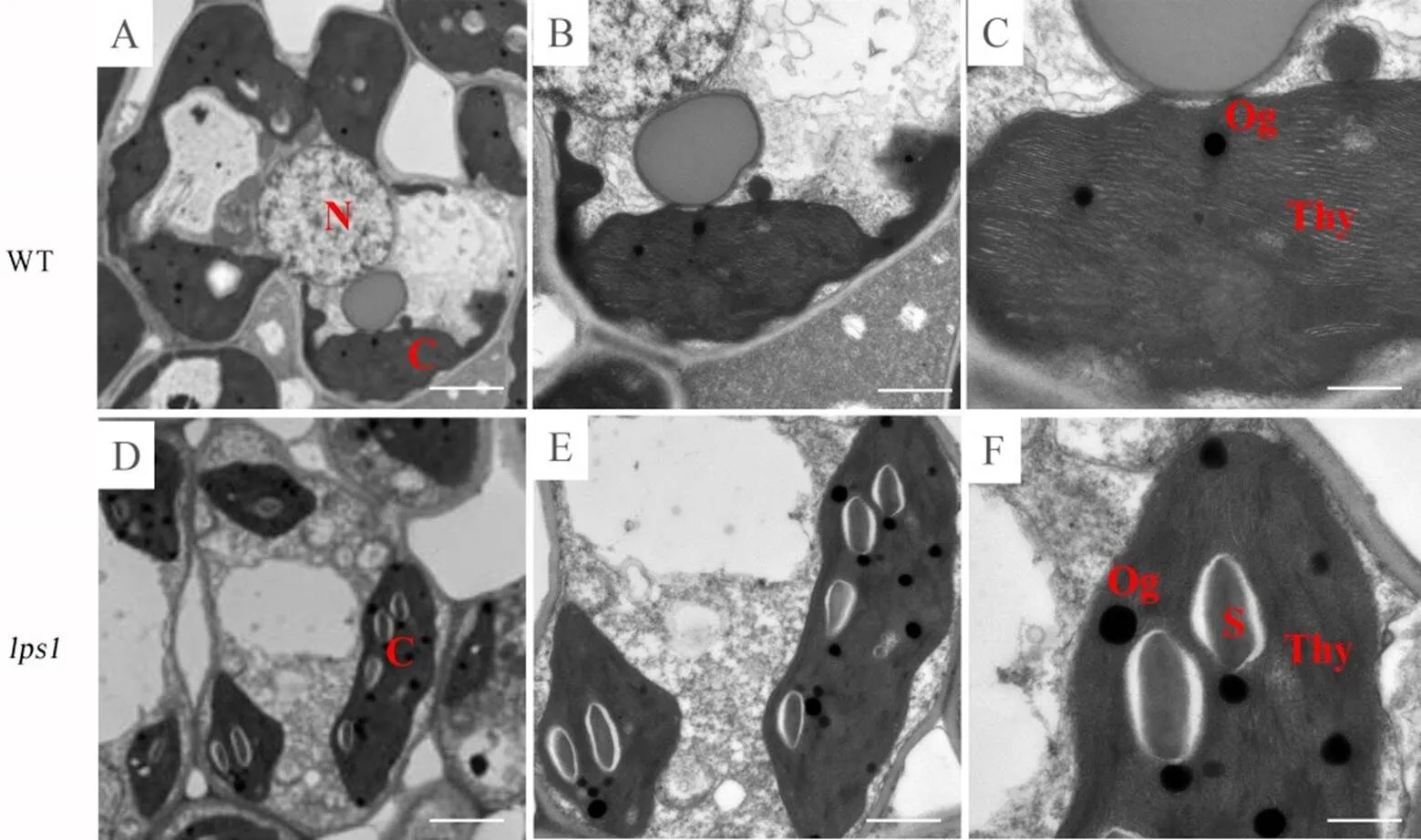
N−细胞核; C−叶绿体; Thy−类囊体; S−淀粉颗粒; Og−嗜锇颗粒。
Fig.4.Transmission electron microscopy (TEM) observation of the wild type (A-C) and(D-F) leaves.
2.4 lps1的衰老生理指标分析
活性氧与植物的衰老密切相关,其过多积累会直接杀死细胞。为了进一步探索过早衰老的原因,我对分蘖期相同部位的叶片进行了DAB和NBT染色,结果发现在叶片中确实有大量的棕色和蓝色沉积物(图5-A、B)。
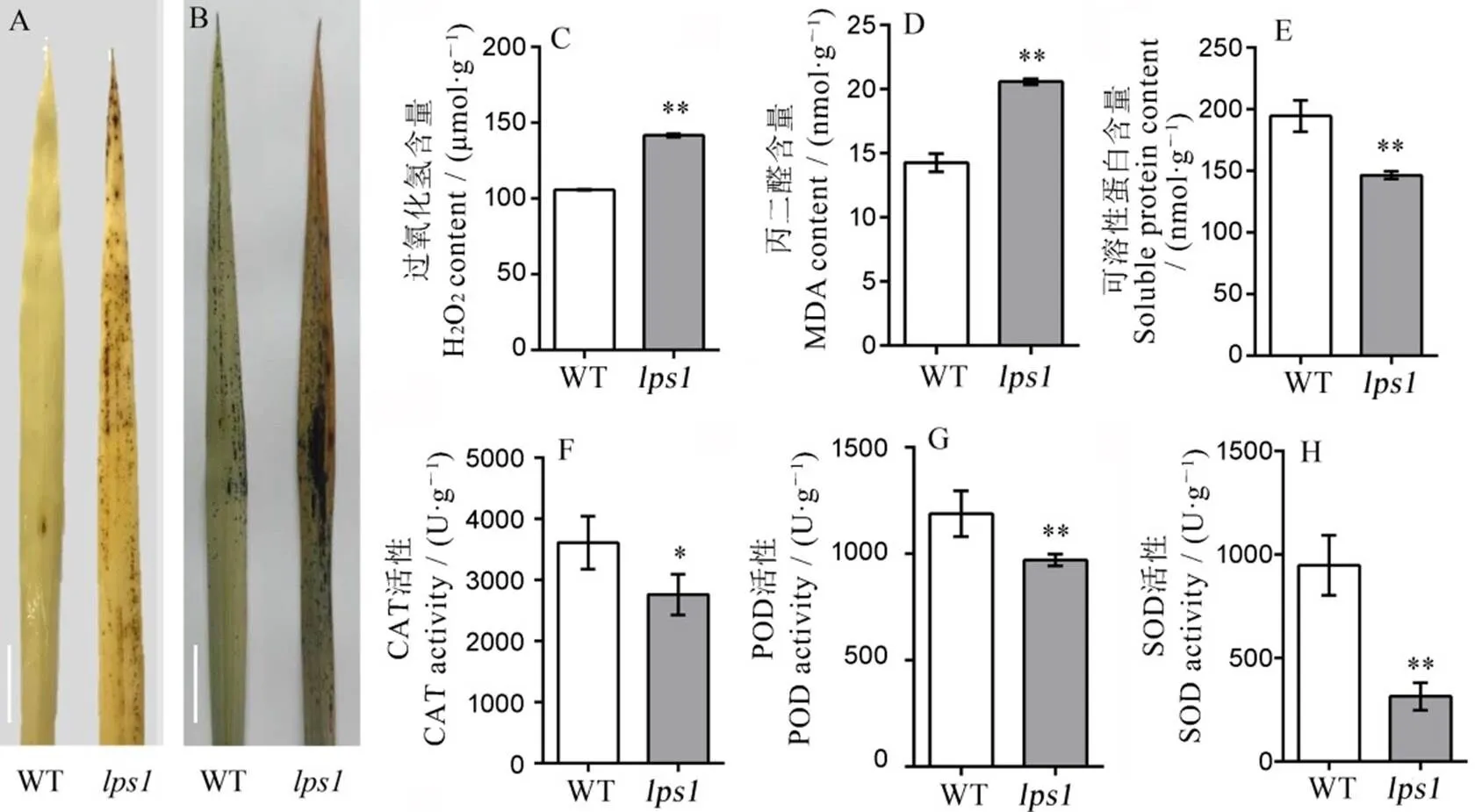
A−DAB染色; 标尺为2 cm;B−NBT染色, 标尺为2 cm;C−衰老相关生理指标(过氧化氢、丙二醛、可溶性蛋白含量、过氧化氢酶、过氧化物酶、超氧化物歧化酶活性)的测定。*和**分别表示野生型与lps1在0.05和0.01水平上差异显著。
Fig.5.Physiological and biochemical detection of the wild type and.
同时,我们也检测了野生型与中与衰老相关的生理指标,结果表明,中H2O2和MDA含量显著升高,可溶性蛋白质含量下降,活性氧清除酶CAT、POD、SOD的活性均显著下降(图5-C~H)。这些说明中确实有大量的活性氧积累,同时可能伴有蛋白质的降解和细胞膜的损伤。
2.5 lps1中的细胞死亡信号分析
为了检测和野生型叶片中的细胞凋亡情况,我们利用TUNEL检测了分蘖期倒2叶中的细胞死亡水平。若植物体细胞出现衰老,基因组DNA会出现断裂,通过染色可以将这些片段染成绿色。检测结果显示在野生型的叶片细胞中,极少数呈现阳性,少数呈现阳性的细胞较小信号较弱(图6-A、B),而在中,TUNEL信号增强且随机分布(图6-C、D),这表明水稻突变诱发大规模的细胞死亡。
2.6 lps1的早衰表型受单隐性核基因控制
通过观察和浙辐802正反交后得到的F1代植株,发现F1代植株的表型均与野生型一致。F1代植株自交后产生的F2代植株出现早衰表型,进一步的观察统计发现,正常表型与早衰表型的比例接近3∶1(表2)。经卡方检验,证明确实受一对隐性单基因控制。
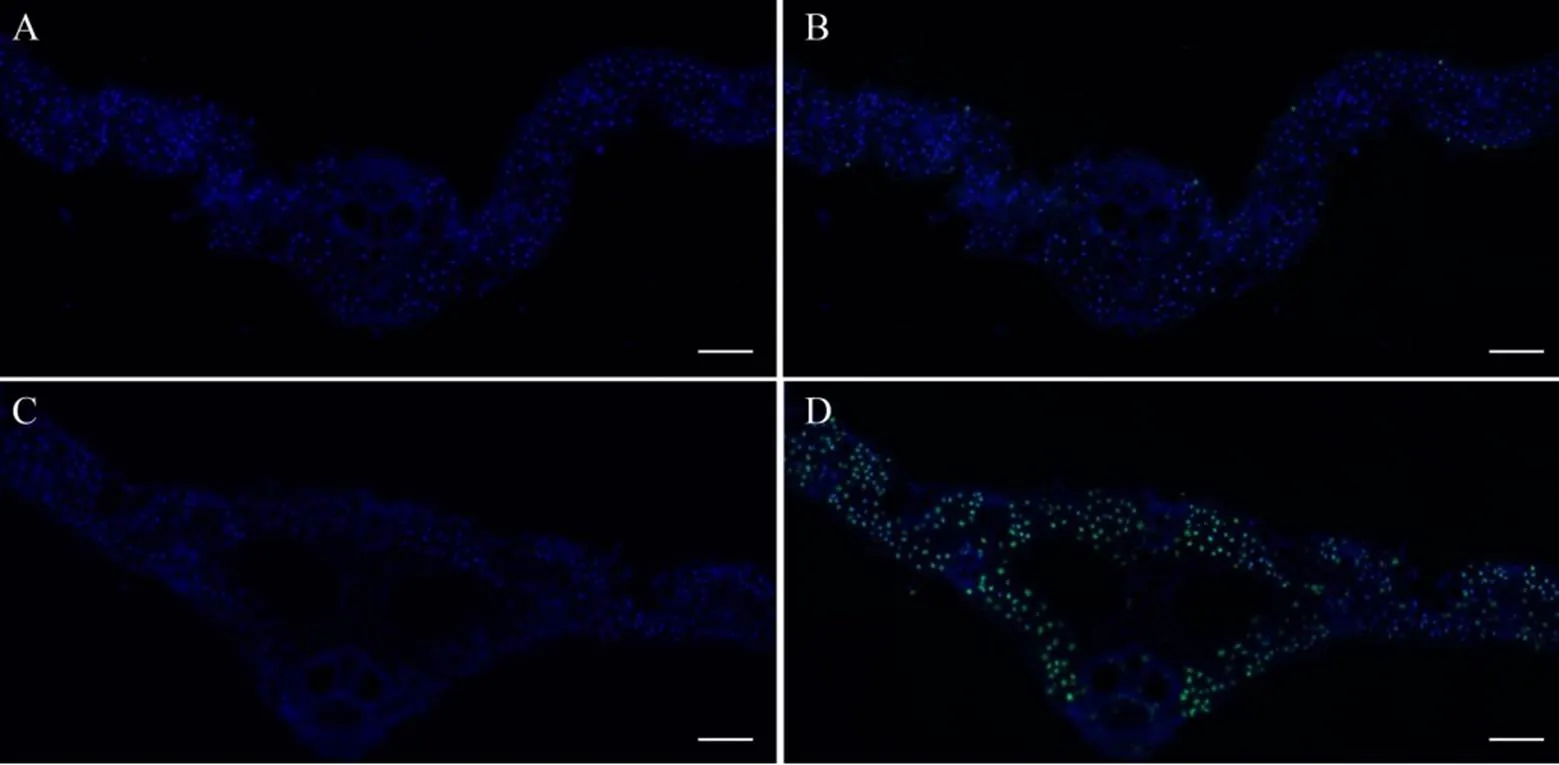
A-D,标尺为100 μm。蓝色荧光代表正常细胞,绿色荧光代表凋亡细胞。
Fig.6.TUNEL treatment results of the wild type (A and B) and(C and D) leaves.

表2 F2代分离群体统计结果
2.7 LPS1编码一个泛素结合酶
我们运用F2分离群体对基因进行初步定位,并将其定位到第5染色体长臂上的2个分子标记(B5-18与B5-19)之间(图7-A)。通过开发新的多态性标记,我们最终将其限定在M4与M5之间的77.5 kb的区间内(图7-B),该区域包含15个ORF(图7-C)。通过测序比对,发现基因的第1外显子的566 bp处G突变成A,导致其编码的氨基酸序列提前终止(图7-D~F)。研究发现编码一个泛素结合酶基因(),说明是已克隆的一个新的等位基因。
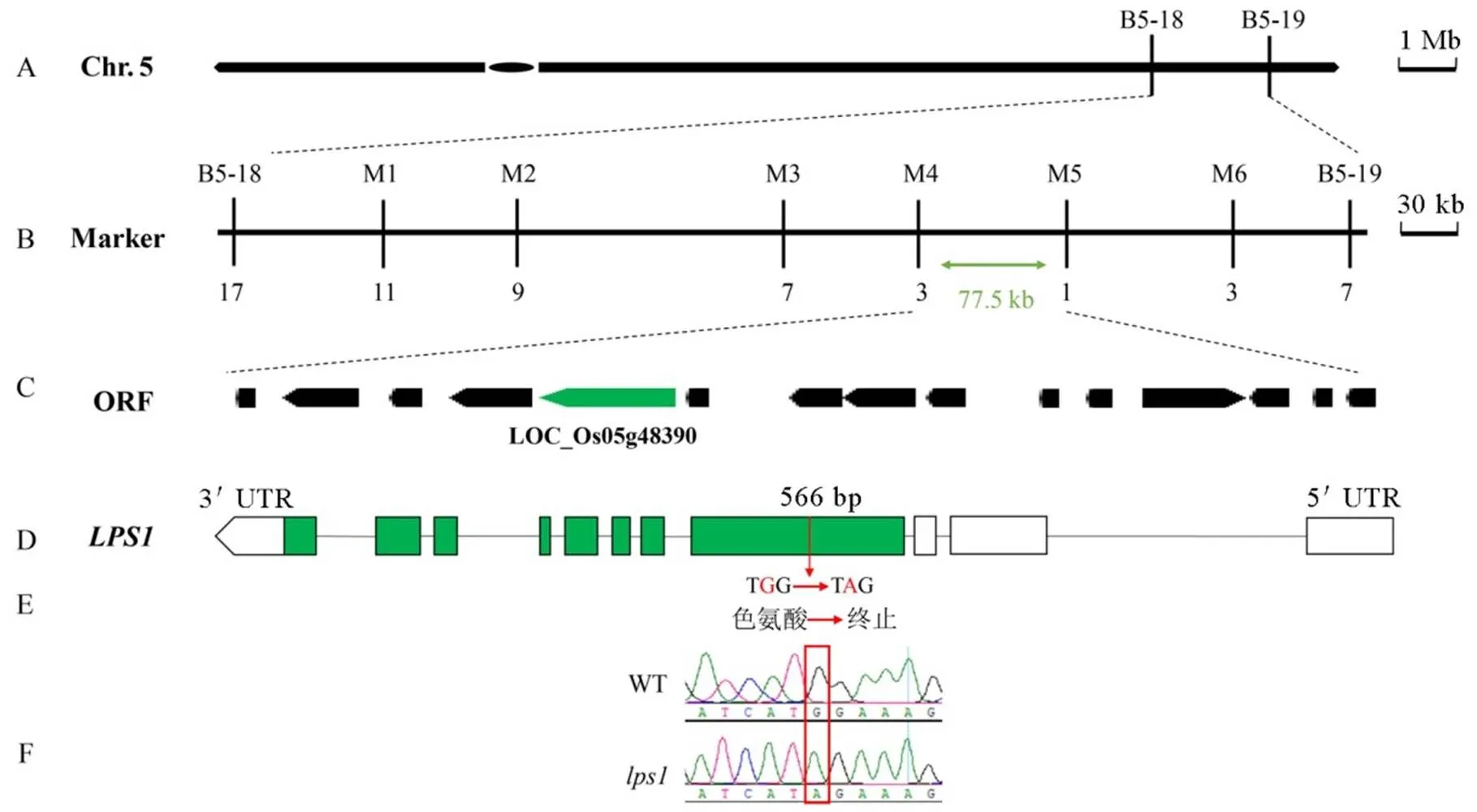
图7 LPS1基因的图位克隆
Fig.7.Map-based cloning ofgene.
2.8 LPS1蛋白的亚细胞定位
将构建好的-GFP载体与空载转入农杆菌中,侵染烟草。通过激光共聚焦扫描显微镜观察,发现LPS1在细胞质和核中表现出较强的荧光信号。由此推测LPS1蛋白在细胞质与细胞核中均有表达(图8)。
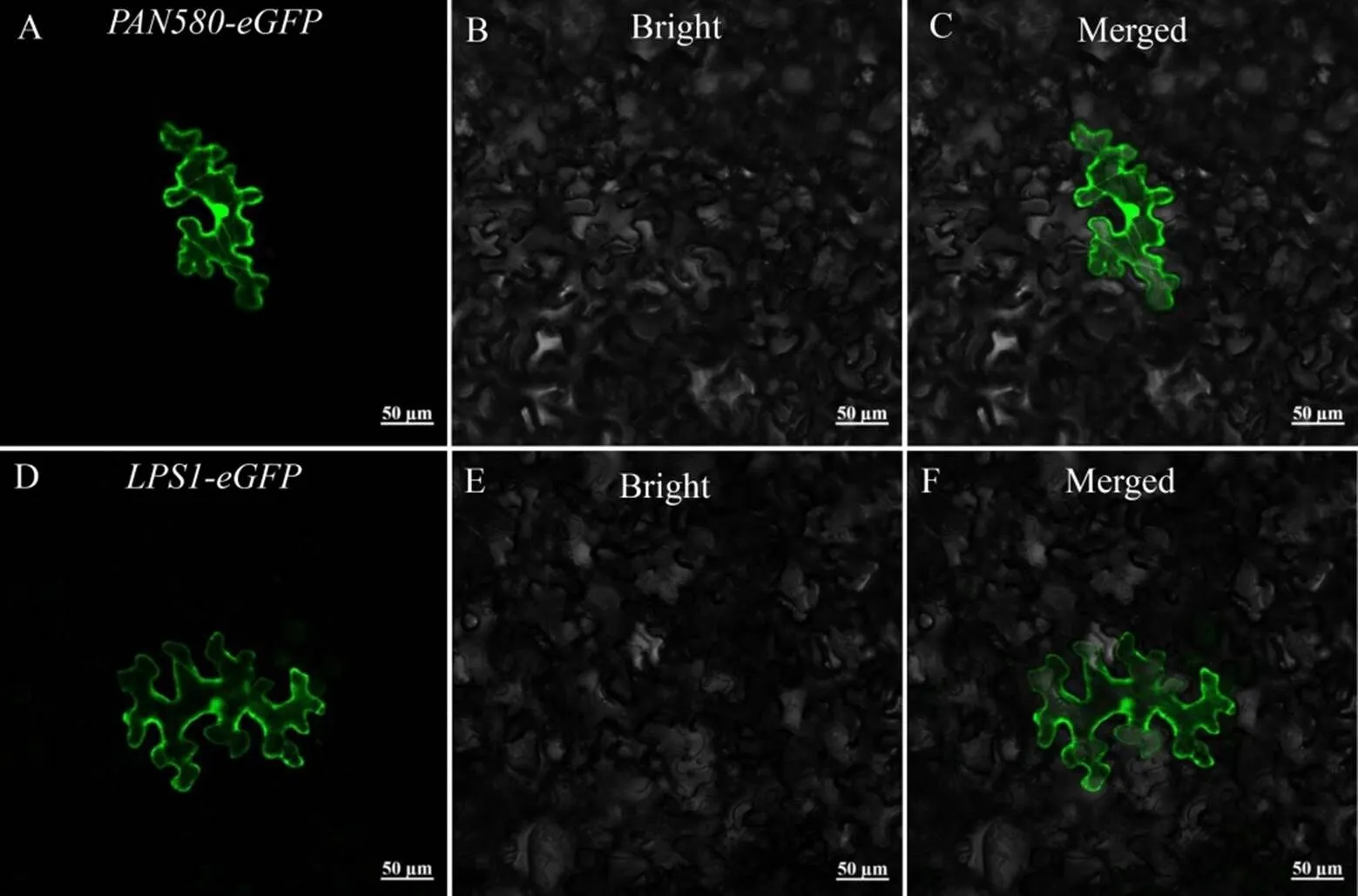
图8 LPS1蛋白的亚细胞定位
Fig.8.Subcellular localization ofprotein.
2.9 LPS1对外源激素的响应情况
叶衰老是一种基因控制的发育过程,可由各种激素和环境因子调节。为了探究突变后对外源激素的响应情况,我们将野生型和接种在含有不同浓度外源激素的1/2 MS 培养基上,培养10 d 后分别统计株高和根长。结果发现,在0.2 μmol/L ABA处理下野生型的株高和根长为无ABA处理的52%和90%,而的株高和根长分别为无ABA处理的41%和160%;在0.25 μmol/L ABA处理下野生型的株高和根长为无ABA处理的47%和76%,而的株高和根长分别为无ABA处理的34%和93%;不同浓度的ABA处理极大地抑制了的株高,但是在0.2 μmol/L ABA处理下,的根长明显伸长;随着ABA处理浓度的升高,其根长又被显著抑制(图9)。
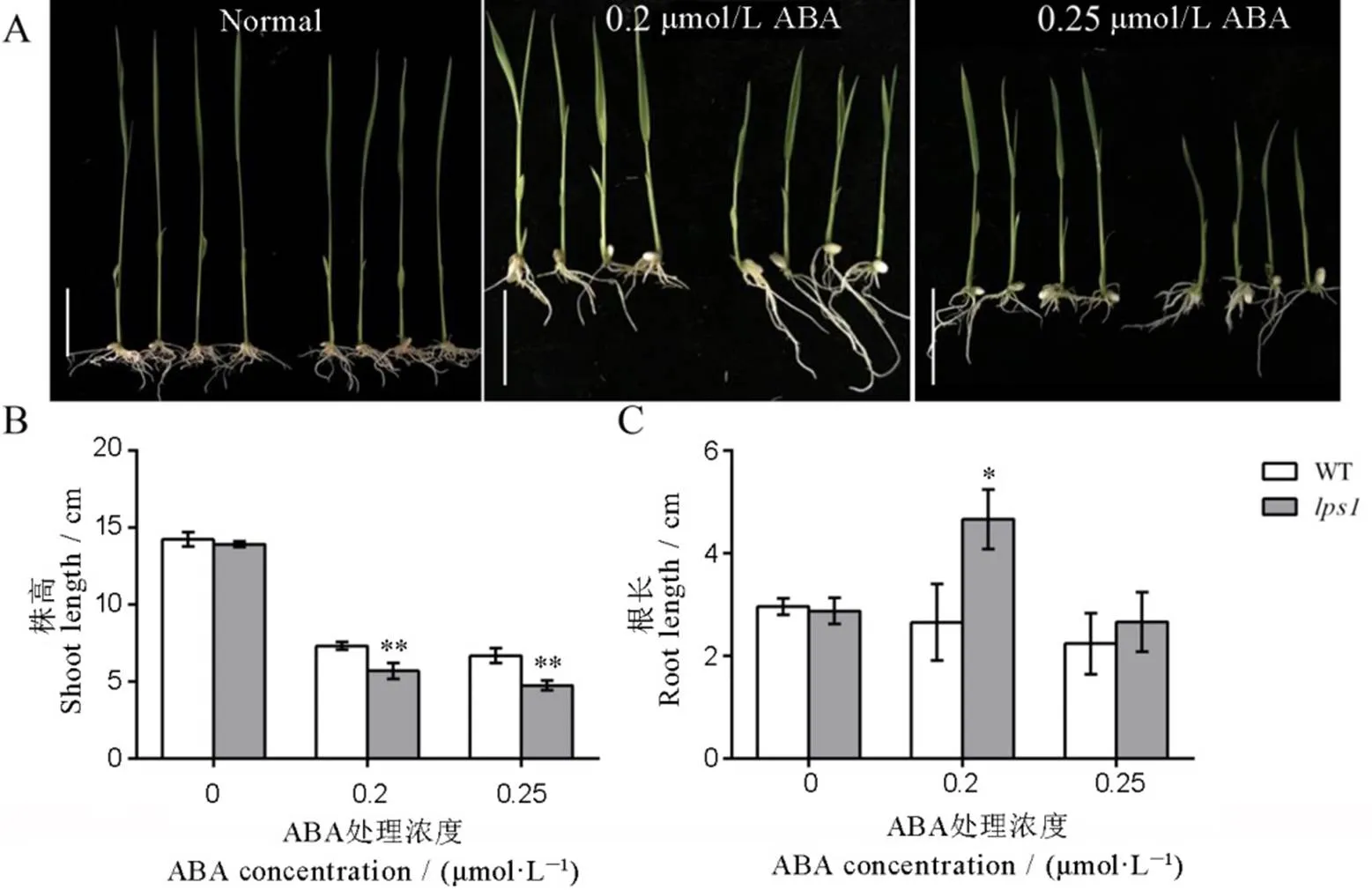
A−外源激素处理对野生型WT(左)和lps1(右)表型的影响,标尺为3 cm;B−激素处理后地上部分长度;C−激素处理后地下部分长度。*和**分别表示野生型与lps1在0.05和0.01水平上差异显著。
Fig.9.Effect of exogenous hormone treatment on the wild type andseedlings.
2.10 LPS1影响ABA的代谢
在ABA处理前,与野生型相比,中与ABA合成相关基因和的表达量显著下调,与ABA降解相关基因和的表达水平显著下调(图10-A);在ABA处理后,中与ABA合成相关基因的表达水平显著上调,而的表达水平下调,同时与ABA降解相关基因显著下调(图10-B)。结果证实,在ABA处理前,中与ABA合成和代谢相关基因的表达受到抑制,而在ABA处理后,与ABA合成相关基因()的表达水平被显著上调,说明可以通过影响ABA的合成途径响应外源ABA的处理。
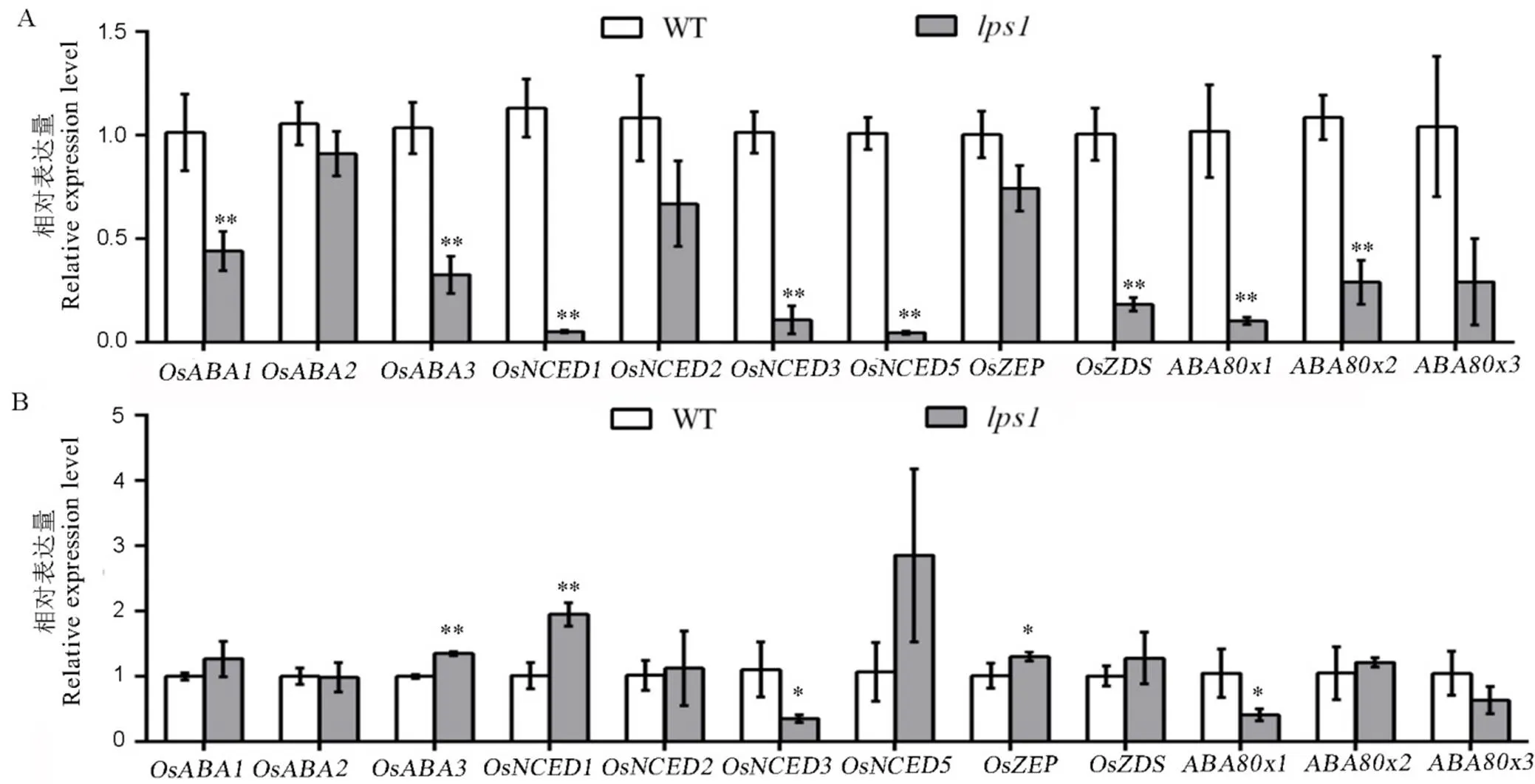
A−处理前野生型(WT)和lps1中ABA相关基因表达水平;B−处理后野生型(WT)和lps1中ABA相关基因表达水平;*和**分别表示野生型与lps1在0.05和0.01水平上差异显著。
Fig.10.ABA synthesis and degradation related gene expression levels.
3 讨论
植物衰老是一个受基因调控的高度复杂和有序的过程,具有多层次、多途径的特点,叶片衰老是水稻衰老的主要表现形式。在3叶期就出现黄叶表型,并且随着植株的生长,其黄化的面积逐渐增大,叶尖出现枯死现象(图1)。伴随着叶色的改变,结构与生理生化方面亦发生诸多变化。电镜结果显示,的硅质化突起与叶绿体的数量明显减少,一般认为水稻表皮硅质化特性具有屏障保护作用,并与叶片机动细胞的开闭有关,从而影响水稻的蒸腾作用[45]。早有研究表明,叶片表面硅质化突起数目的减少不仅使植株变矮,而且还影响根系生长,导致结实率下降[46-48]。叶绿体是光合作用的主要器官,也是ROS产生的重要部位。叶绿体结构破坏,导致H2O2、O2−和MDA大量积累[49]。细胞内大量的MDA可以破坏蛋白质、脂类和叶绿素等的活性,使细胞丧失多种生理功能引起细胞过氧化,导致细胞死亡信号增强,加剧水稻叶片的衰老进程[50]。
本研究利用图位克隆的手段将该基因定位到第5染色体上,并通过测序比对发现是的一个等位基因。但是由于其突变方式以及突变位点的差异,导致其编码产物产生较大差异。同时,它们的衰老表型亦有所不同。在成熟期表现出叶尖枯死表型[51],而从3叶期就表现出黄叶与叶尖枯死,并且一直持续到成熟期。Hu等[48]研究发现是miR399下游的一个关键的Pi饥饿信号成分,参与水稻多种Pi饥饿反应的调节。突变导致Pi的吸收和转运异常,Pi在嫩叶中的过度积累,最终导致叶尖枯死。
ABA一直被认为是促进植物衰老的正向调节物质[52]。本研究发现的早衰表型可能是由于突变,体内ABA代谢信号异常所致。早有研究表明,ABA可以通过诱导H2O2的产生,引起植物叶片的衰老。对玉米、水稻的离体叶片进行ABA处理后,显著引起离体叶片中H2O2和MDA含量升高,叶绿素含量下降,进而加速叶片衰老[40-41]。本研究通过不同浓度的ABA处理水稻幼苗,发现对ABA异常敏感,并且ABA处理后,中的表达水平显著上调,说明突变可以促进ABA的合成。与此同时,研究表明中类胡萝卜素含量极显著升高,而类胡萝卜素为ABA合成的前体物质。因此我们推测,突变导致体内类胡萝卜素含量异常升高,促使内源ABA合成增多,进而引发H2O2、MDA等一系列与衰老相关生理指标的升高和降低,最终导致过早衰老。
4 结论
本研究通过EMS诱变得到一份早衰突变体,发现从3叶期开始衰老,叶表面硅质化突起及叶绿体数目减少、片层结构紊乱,最终导致植株结实率降低、产量减少。生理实验表明,中叶绿素水平下降,ROS过量积累,细胞死亡加重。遗传分析与图位克隆发现,位于第5染色体,是泛素结合酶基因的新等位基因,其编码的蛋白在细胞质与细胞核中均有表达。进一步研究发现,可能参与ABA的代谢途径,最终导致产生早衰表型。本研究为激素介导水稻叶片衰老提供了新思路,并进一步丰富了调控水稻叶片早衰的网络机制。
[1] Cao J, Jiang F, Sodmergen, Cui K M.Time-course of programmed cell death during leaf senescence in[J]., 2003, 116(1): 7-12.
[2] Vicky B W.The molecular biology of leaf senescence[J]., 1997, 48(2): 181-199.
[3] Lim P O, Kim H J, Nam H G.Leaf senescence[J]., 2007, 58(1): 115-136.
[4] Zhang H S, Zhou C J.Signal transduction in leaf senescence[J]., 2013, 82(6): 539-545.
[5] Panda D, Sarkar R K.Natural leaf senescence: Probed by chlorophyll fluorescence, CO2photosynthetic rate and antioxidant enzyme activities during grain filling in different rice cultivars[J]., 2013, 19(3): 43-51.
[6] Li Z H, Zhang Y, Zou D, Zhao Y, Wang H L, Zhang Y, Xia X L, Luo J C, Zhang Z.LSD 3.0: A comprehensive resource for the leaf senescence research community[J]., 2020, 48(D1): D1069-D1075.
[7] Mao C J, Lu S C, Lü B, Zhang B, Shen J B, He J M, Luo L Q, Xi D D, Chen X, Ming F.A rice NAC transcription factor promotes leaf senescence via ABA biosynthesis[J]., 2017, 174(3): 1747-1763.
[8] Liang C Z, Wang Y Q, Zhu Y N, Tang J Y, Hu B, Liu L C, Ou S J, Sun X H, Chu J F, Chu C C.connects abscisic acid and leaf senescence by fine-tuning abscisic acid biosynthesis and directly targeting senescence- associated genes in rice[J]., 2014, 111(27): 10013-10018.
[9] Han M, Kim C Y, Lee J, Lee S K, Jeon J S.represses OsMT1d and induces reactive oxygen species and leaf senescence in rice[J]., 2014, 37(7): 532-539.
[10] Uji Y, Akimitsu K, Gomi K.Identification of-regulated senescence-associated genes in rice[J]., 2017, 245(6): 1241-1246.
[11] Lu G W, Casaretto J A, Ying S, Mahmood K, Liu F, Bi Y M, Rothstein S J.Overexpression ofregulates chlorophyll content, delays plant senescence and improves rice yield under high density planting[J]., 2017, 94(1): 215-227.
[12] Liu W Z, Fu Y P, Hu G C, Si H M, Wu C, Sun Z X.Identification and fine mapping of a thermo-sensitive chlorophyll deficient mutant in rice (L.)[J]., 2007, 226(3): 785-795.
[13] Liu C H, Zhu H T, Xing Y, Tan J J, Chen X H, Zhang J J, Peng H F, Xie Q J, Zhang Z M.is involved in the splicing of chloroplast group I and II introns in rice[J]., 2016, 67(18): 5339-5347.
[14] Kusaba M, Ito H, Morita R, Iida S, Sato Y, Fujimoto M, Kawasaki S, Tanaka,R, Hirochika H, Nishimura M, Tanaka A.Riceis involved in light-harvesting complex II and grana degradation during leaf senescence[J]., 2007, 19(4): 1362-1375.
[15] Rong H, Tang Y Y, Zhang H, Wu P Z, Chen Y P, Li M R, Wu G J, Jiang H W.The() gene regulates chlorophyll degradation in rice[J]., 2013, 170(15): 1367-1373.
[16] Fang C Y, Zhang H, Wan J, Wu Y Y, Chen W, Wang S C, Wang W S, Zhang H W, Zhang F, Qu L H, Liu X Q, Zhou D X, Luo J.Control of leaf senescence by an MeOH-jasmonates cascade that is epigenetically regulated byin rice[J]., 2016, 9(10): 1366-1378.
[17] Xu W Y, Kong Z S, Li M N, Yang W Q, Xue Y B.A novel nuclear-localized CCCH-type ainc finger protein,, is involved in delaying leaf senescence in rice[J]., 2006, 141(4): 1376-1388.
[18] Chen Y, Xu Y Y, Luo W, Li W X, Chen N, Zhang D J, Chong K.The F-Box protein OsFBK12 targets OsSAMS1 for degradation and affects pleiotropic phenotypes, including leaf senescence, in rice[J]., 2013, 163(4): 1673-1685.
[19] Zhao Y, Chan Z L, Gao J H, Xing L, Cao M J, Yu C M, Hu Y L, You J, Shi H T, Zhu Y F, Gong Y H, Mu Z X, Wang H Q, Deng X, Wang P C, Bressan R A, Zhu J K.ABA receptor PYL9 promotes drought resistance and leaf senescence[J]., 2016, 113(7): 1949-1954.
[20] Yang X, Gong P, Li K Y, Huang F D, Cheng F M, Pan G.A single cytosine deletion in thegene encoding vacuolar-type H+-ATPase subunit A1 leads to premature leaf senescence and seed dormancy in rice[J]., 2016, 67(9): 2761-2776.
[21] Zhou Y, Liu L, Huang W F, Yuan M, Zhou F, Li X H, Lin Y J.Overexpression ofin rice causes growth retardation and precocious senescence[J]., 2014, 9(4): e94210.
[22] Singh S, Singh A, Nandi A K.The ricegene codes for a functional protease that negatively regulates stress-induced cell death[J]., 2016, 41(3): 445-453.
[23] Wu L W, Ren D Y, Hu S K, Li G M, Dong G J, Jiang L, Hu X M, Ye W J, Cui Y T, Zhu J, Zhang G H, Gao, Z Y, Zeng, D L, Qian Q, Guo L B.Down-regulation of a nicotinate phosphoribosyltransferase geneleads to withered leaf tips[J]., 2016, 171(2): 1085-1098.
[24] Lee R H, Hsu J H, Huang H J, Lo S F, Grace S C.Alkaline α-galactosidase degrades thylakoid membranes in the chloroplast during leaf senescence in rice[J]., 2009, 184(3): 596-606.
[25] Kang K, Kim Y S, Park S, Back K.Senescence-induced serotonin biosynthesis and its role in delaying senescence in rice leaves[J]., 2009, 150(3): 1380-1393.
[26] Kudo T, Makita N, Kojima M, Tokunaga H, Sakakibara H.Cytokinin activity of-zeatin and phenotypic alterations induced by overexpression of putative-zeatin glucosyltransferase in rice[J]., 2012, 160(1): 319-331.
[27] Wiseman B R.Plant-resistance to insects in integrated pest-management[J]., 1994, 78(9): 927-932.
[28] Liang C Z, Chu C C.Towards understanding abscisic acid-mediated leaf senescence[J]., 2015, 58(5): 506-508.
[29] Pan H R, Liu S M, Tang D Z., a component of the THO/TREX complex, plays an important role in disease resistance and senescence in[J]., 2012, 69(5): 831-843.
[30] Hu Y N, Jiang Y J, Han X, Wang H P, Pan J J, Yu D Q.Jasmonate regulates leaf senescence and tolerance to cold stress: Crosstalk with other phytohormones[J]., 2017, 68(6): 1361-1369.
[31] Dani K G S, Fineschi S, Michelozzi M, Loreto F.Do cytokinins, volatile isoprenoids and carotenoids synergically delay leaf senescence[J]., 2016, 39(5): 1103-1111.
[32] Kim J I, Murphy A S, Baek D, Lee S W, Yun D J, Bressan R A, Narasimhan M L.over-expression demonstrates auxin function in delaying leaf senescence in[J]., 2011, 62(11): 3981-3992.
[33] Chen L G, Xiang S Y, Chen Y L, Li D B, Yu D Q.interacts with the DELLA protein RGL1 to positively regulate age-triggered leaf senescence[J]., 2017, 10, 1174-1189.
[34] Riefler M, Novak O, Strnad M, Schmülling T.cytokinin receptor mutants reveal functions in shoot growth, leaf senescence, seed size, germination, root development, and cytokinin metabolism[J]., 2006, 18(1): 40-54.
[35] Wang T, Li C X, Wu Z H, Jia Y C, Wang H, Sun S Y, Mao C Z, Wang X L.Abscisic acid regulates auxin homeostasis in rice root tips to promote root hair elongation[J]., 2017, 8: 1121-1138.
[36] Xu N, Chu Y L, Chen H L, Li X X, Wu Q, Jin L, Wang G X, Huang J L.Rice transcription factormodulates root growth and confers salinity tolerance via the ABA-mediated regulatory pathway and ROS scavenging[J]., 2018, 14(10): e1007662.
[37] Chang Y, Nguyen B H, Xie Y J, Xiao B Z, Tang N, Zhu W L, Mou T M, Xiong L Z.Co-overexpression of the constitutively active form ofand ABA-activated protein kinaseimproves drought and temperature stress resistance in rice[J]., 2017, 8: 1102-1117.
[38] Promchuea S, Zhu Y J, Chen Z Z, Zhang J, Gong Z Z.coordinates with PLETHORAs and PINs to orchestrate ABA-mediated root meristem activity in[J]., 2017, 59(1): 30-43.
[39] Sun L R, Wang Y B, He S B, Hao F S.Mechanisms for abscisic acid inhibition of primary root growth[J]., 2018, 13(9): e1500069.
[40] Hung K T, Yi T H, Kao C H.Hydrogen peroxide is involved in methyl jasmonate-induced senescence of rice leaves[J]., 2006, 127(2): 293-303.
[41] 李兆伟.水稻叶片早衰突变体的糖代谢基因表达与抗氧化生理调控[D].杭州: 浙江大学, 2014.
Li Z W.The expression alteration of various genes related to sugar metabolism in senescing leaves and its antioxidation modulation formutant[D].Hangzhou: Zhejiang University, 2014.
[42] Lichtenthaler H K.Chlorophylls and carotenoids: Pigments of photosynthetic biomembranes[J]., 1987, 148: 350-382.
[43] 游均, 方玉洁, 熊立仲.活性氧检测[J/OL]., 2018: e1010170.
You J, Fang Y J, Xiong L Z.Reactive oxygen detection [J/OL]., 2018: e1010170.(in Chinese)
[44] Rao Y C, Jiao R, Wang S, Wu X M, Ye H F, Pan C Y, Li S F, Xin D D, Zhou W Y, Dai G X, Hu J, Ren D Y, Wang Y X.encodes a receptor-like protein kinase that regulates programmed cell death and defense responses in rice[J]., 2021, 14(1): 34-47.
[45] 沈恒胜, 陈君琛, 黄进华, 汤葆莎.水稻叶表皮硅体显微结构及其分布[J].福建农业大学学报, 2005, 34(2): 137-140.
Shen H S, Chen J C, Huang J H, Tang B S.Microtructure and distribution of silica bodies rice epidermis[J]., 2005, 34(2): 137-140.(in Chinese with English abstract)
[46] 杨秉耀, 陈新芳, 刘向东, 郭海滨.水稻不同品种叶表面硅质细胞的扫描电镜观察[J].电子显微学报, 2006, 25(2): 68-72.
Yang B Y, Chen X F, Liu X D, Guo H B.Scanning electron microscopic observation of silicon cells on the leaf surface of different rice varieties [J]., 2005, 25(2): 68-72.
[47] Christopher E.A possible mechanism of biological silicification in plants[J]., 2015, 6: 853-859.
[48] Yang L, Han Y Q, Li P, Li F, Ali S, Hou M L.Silicon amendment is involved in the induction of plant defense responses to a phloem feeder[J]., 2017, 7(1): 4232-4240.
[49] Hideg E, Kálai T, Kós P B, Asada K, Hideg K.Singletoxygen in plants: Its significance and possible detection with double (fluorescent and spin) indicator reagents[J]., 2006, 82(5): 1211-1218.
[50] 华春, 王仁雷.杂交稻及其三系叶片衰老过程中SOD、CAT活性和MDA含量的变化[J].西北植物学报, 2003, 23(3): 406-409.
Hua C, Wang R L.Changes of SOD and CAT activities and MDA content during senescence of hybrid rice and three lines leaves[J]., 2003, 23(3): 406-409.
[51] Hu B, Zhu C G, Li F, Tang J Y, Wang Y Q, Liu L C, Che R H, Chu C C.plays a pivotal role in the regulation of multiple phosphate starvation responses in rice[J]., 2011, 156(3): 1101-1115.
[52] Lee I C, Hong S W, Whang S S, Lim P O, Nam H G, Koo J C.Age-dependent action of an ABA-inducible receptor kinase, RPK1, as a positive regulator of senescence inleaves[J]., 2011, 52(4): 651-662.
Cloning and Functional Analysis of Leaf Senescence Genein
CHU Xiaojie1, LU Tao1, YE Hanfei1, WANG Sheng1, LIN Han1, WU Xianmei2, HE Rui2, YAN Gang1,WANG Yuexing2, LI Sanfeng2, LU Mei1, HU Haitao1, *, YANG Yaolong2, *, RAO Yuchun1, *
(1College of Chemistry and Life Sciences, Zhejiang Normal University, Jinhua 321004, China;2China National Center for Rice Improvement / State Key Laboratory of Rice Biology, China National Rice Research Institute, Hangzhou 310006, China;*Corresponding author, E-mail: ryc@zjnu.cn, yangxiao182@126.com, haitao-hu@zjnu.cn)
【Objective】As a good carrier, the premature aging mutant plays an important role in exploring the genetic mechanism and mechanism of action on premature aging, as well as improving grain yield and quality of rice.【Method】In this study, a prematuresenescence mutantwas obtained by EMS mutagenesis, and phenotypic observation, cytological and histochemical analysis, physiological and biochemical analysis, genetic analysis, gene localization and hormone treatment were performed on wild-type and mutants.【Result】The leaves ofbegan to turn yellow during the three-leaf stage, and the plant height, effective tiller number, seed-setting rate, and thousand-grain weight were extremely significantly reduced in the maturing stage.Electron microscopy observation found that the surface ofleaves was smooth, the numbers of silicified protrusions and chloroplasts decreased, and the lamella structure was disordered.Physiological and biochemical analysis showed that a large amount of reactive oxygen species accumulated in mutant, accompanied by protein degradation, cell membrane damage and large-scale cell death.Genetic analysis showed that the progeria phenotype was controlled by a single recessive nuclear gene, which encodes an ubiquitin conjugating enzyme on chromosome 5.The subcellular localization results prove that LPS1 protein is expressed in both the cytoplasm and the nucleus.Exogenous hormone treatment demonstrated that thewas more sensitive to exogenous hormone treatment, and themutation promoted the expression of genes related to ABA synthesis.【Conclusion】mutation makes the rice ABA synthesis signal pathway abnormal, which in turn triggers abnormal changes in a series of aging-related physiological indicators such as H2O2, leading to premature senescence of, and ultimately resulting in a serious decrease in rice yield.
rice; premature senescence; genetic analysis; subcellular localization; hormone
10.16819/j.1001-7216.2021.210303
2021-03-04;
2021-04-12。
国家科技重大专项(2016ZX08009003-003-008);国家自然科学基金资助项目(31971921);广西水稻遗传育种重点实验室开放基金资助项目;中国水稻生物学国家重点实验室开放项目(20200102)。
