光照度对异养鞭毛虫抑制铜绿微囊藻生长的影响
2021-09-12何雪怡罗晓霞陶德琴杜振雄
何雪怡 罗晓霞 陶德琴 杜振雄

摘要:研究不同光照度对异养鞭毛虫Paraphysomonas sp.摄食及抑制铜绿微囊藻(Microcystis aeruginosa)的影响,探讨鞭毛虫在不同光照条件下的生长状况。共设6个光照度,分别是0、500、1 200、2 500、5 000、10 000 lx。结果表明,不同光照度对异养鞭毛虫种群生长率、微囊藻抑制率均有显著影响(P<0.05)。在光照度为0~10 000 lx时,鞭毛虫均能显著抑制微囊藻种群生长,抑制率达88%~94%,每个鞭毛虫摄食率高达32~49个/d。伴随着铜绿微囊藻数量的减少,不同光照度下的鞭毛虫种群数量均呈先增加后减少的趋势,鞭毛虫种群数量高达(18~35)×104个/mL,比初始浓度增加了3.6~7倍。光照度最高组(10 000 lx)的异养鞭毛虫数量增长缓慢且快速下降,在试验的第3、4 天,生长率出现负增长。因此,过高的光照度会抑制异养鞭毛虫数量的增长。异养鞭毛虫可生长的光照度范围为0~10 000 lx,最佳生长光照度为0~5 000 lx。
关键词:异养鞭毛虫;微囊藻;光照度;生长率;抑制率;摄食率
中图分类号: X174;X52 文献标志码: A
文章编号:1002-1302(2021)15-0215-06
收稿日期:2020-12-18
基金项目:广东省自然科学基金(编号:2018A030313212);广东省湛江市科技计划(编号:2020B01055);广东海洋大学博士启动项目(编号:R17039);大学生创新创业训练计划(编号:S201910566045);广东海洋大学第六届优秀本科生进实验室项目。
作者简介:何雪怡(1999—),女,广东英德人,主要从事生物科学研究。E-mail:1923243136@qq.com。
通信作者:罗晓霞,博士,试验师,主要从事水体生态修复研究。E-mail:xialemon@126.com。
目前,我国许多大型湖泊和水库频繁暴发蓝藻水华,水体生态平衡遭受严重破坏,生态环境恶化。微囊藻水华是常见的蓝藻水华种类,在全世界广泛分布,已被分离出的微囊藻毒素达60多种[1]。蓝藻水华释放的藻毒素是导致我国南方肝癌发病率高的主要原因[2-4]。因此,水体环境的生态修复已是迫在眉睫。
许多研究表明原生动物是微囊藻水华中的主要消费者。Nishibe在富營养化池塘中分离出一种变形虫Penardochlamys sp.,发现其食物泡中含有大量微囊藻颗粒,表明其可以吞噬自然环境下的群体微囊藻[5]。Kim等在室内研究发现鞭毛虫Diphylleia sp.对微囊藻的摄食率高达30个/d[6-7]。Zhang等发现鞭毛虫Poterioochromonas malhamensis既能通过光合作用进行群体增殖,也能通过吞噬铜绿微囊藻进行种群增长[8-9]。草履虫可有效清除微囊藻种群数量[10]。因此,富营养化水体中,原生动物被认为是蓝藻水华碳流途径中的关键环节[11-14]。异养鞭毛虫是原生动物中的重要组成部分[15-16],它不含色素体,具有鞭毛进行运动,以有机物作为食物来源[17]。已有研究报道异养鞭毛虫可以吞噬有机碎屑、细菌、绿藻、硅藻及蓝藻等[9,18-21]。因此,培养利用鞭毛虫清除蓝藻水华是一种新的探索。
笔者前期在腐烂的铜绿微囊藻中分离出一种具有吞噬微囊藻能力的异养鞭毛虫,当铜绿微囊藻浓度为(0~2 000)×104 个/mL时,它对微囊藻的抑制率达98%~99.69%[22]。目前,光照度对铜绿微囊藻及异养鞭毛虫两者相互作用的动态变化影响缺乏研究数据,而了解理化因子对异养鞭毛虫吞噬微囊藻能力的影响,将有助于揭示鞭毛虫参与自然界微囊藻水华调控的作用机制。因此,本试验研究不同光照度对异养鞭毛虫Paraphysomonas sp.生长及其抑制铜绿微囊藻的影响,旨在找到鞭毛虫吞噬微囊藻的适宜光照度范围,为应用鞭毛虫生物控藻提供基础理论依据。
1 材料与方法
1.1 试验材料
从腐烂的铜绿微囊藻培养液中发现一种异养鞭毛虫Paraphysomonas sp.,经单个分离,扩大培养于3 000 mL锥形瓶,以铜绿微囊藻(M. aeruginosa)为饵料,每隔4~5 d投喂1次。培养温度25~30 ℃、光照度1 500~1 700 lx。
铜绿微囊藻由广东海洋大学藻种室提供,为产毒种(FACHB-905)。微囊藻用BG11配方培养,选取指数增长期的藻类进行试验。
1.2 试验方法
试验于2018年7月14—17日在广东海洋大学实验室进行。光照度设置为0、500、1 200、2 500、5 000、10 000 lx共6个梯度,每个光照梯度设3个平行试验组、2个对照组。往30个锥形瓶(规格为 250 mL)中分别加入浓度为500×104 个/mL的铜绿微囊藻180 mL。其中,试验组加入离心浓缩后的异养鞭毛虫培养液20 mL[23-24];对照组则不添加异养鞭毛虫,加入20 mL BG11培养液。锥形瓶放置在光照培养箱(FPG3,宁波莱福)进行培养,设置温度25 ℃,光—暗周期为12 h—12 h。试验共进行4 d,每天用移液枪采集10 mL样品,添加鲁哥试剂固定,用血球计数板分别计算铜绿微囊藻及异养鞭毛虫密度。
1.3 计算方法
异养鞭毛虫的生长率(μ)的计算公式[8]:
μ=lnNt-lnN0t。(1)
式中:N0表示异养鞭毛虫的初始密度(个/mL),t表示试验时间(d),Nt表示异养鞭毛虫在试验结束时的密度(个/mL)。
异养鞭毛虫对铜绿微囊藻的抑制率IR:
IR=1-MtMc×100%。(2)
式中:Mt表示试验结束时试验组铜绿微囊藻的密度(个/mL),Mc表示试验结束时对照组铜绿微囊藻的密度(个/mL)。
异养鞭毛虫对铜绿微囊藻的摄食率[8]:
Ic=Mt0-MtNt-N0lnNt-lnN0×t。(3)
式中:Mt0表示处理组铜绿微囊藻的初始密度(个/mL),Mt表示处理组铜绿微囊藻在试验结束时的密度(个/mL),N0表示异养鞭毛虫的初始密度(个/mL),Nt表示异养鞭毛虫在试验结束时的密度(个/mL),t表示试验时间(d)。
1.4 数据处理方法
数据运用SPSS17.0 软件进行单因素多重均值(Duncans)比较,显著性水平α=0.05。
2 结果与分析
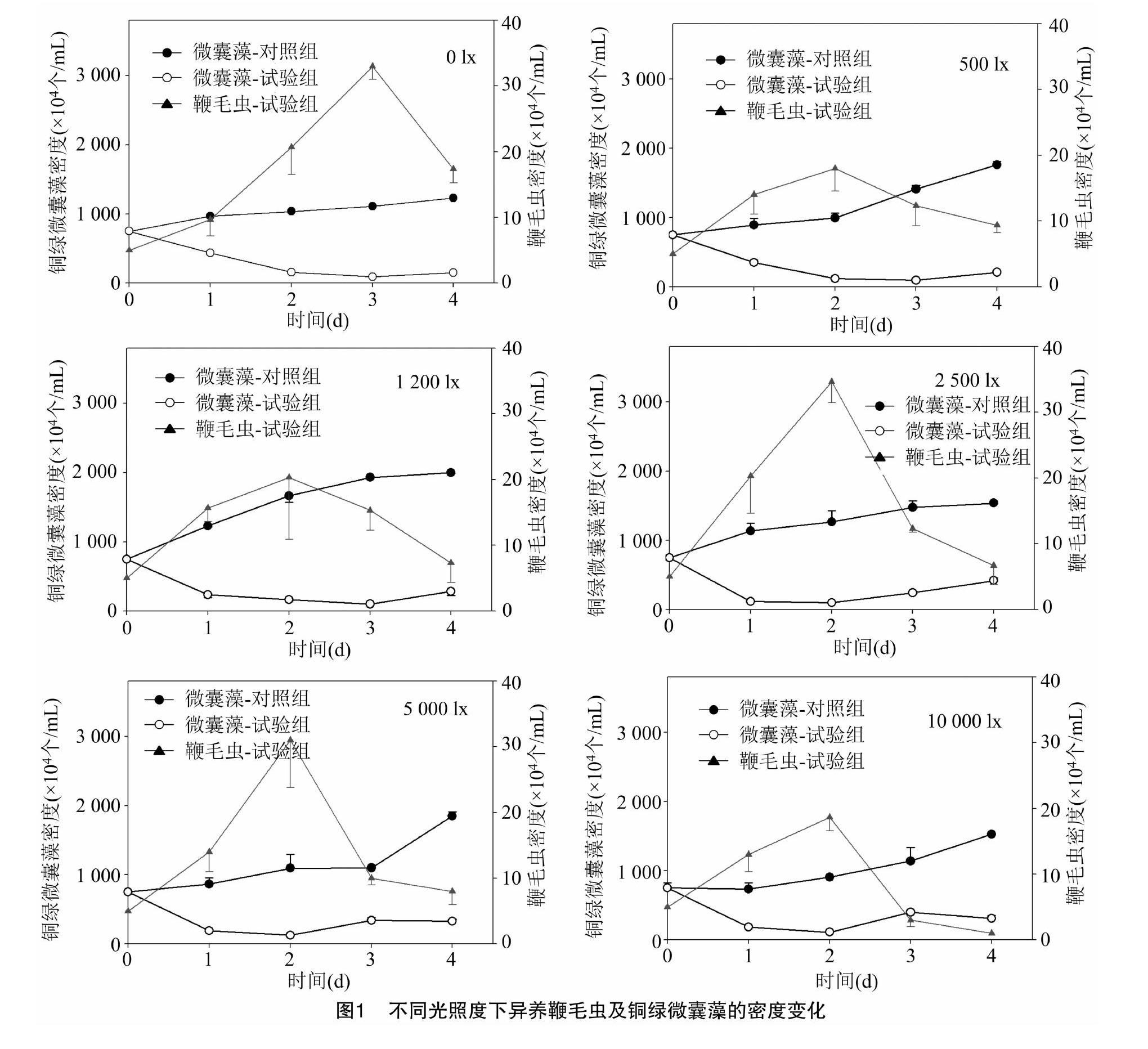
2.1 不同光照度下异养鞭毛虫及铜绿微囊藻数量变化趋势
在对照组中,不同光照度下的微囊藻密度在试验期间内持续上升(图1),最终密度增长至初始密度的1.6~2.6倍。反之,试验组中,随着异养鞭毛虫密度的增长,铜绿微囊藻的数量持续下降。因此,当光照度为0~10 000 lx时,异养鞭毛虫均能抑制微囊藻密度的增长。随着试验组中铜绿微囊藻密度减少,异养鞭毛虫密度呈先上升后下降趋势。
2.2 不同光照度下异养鞭毛虫的生长
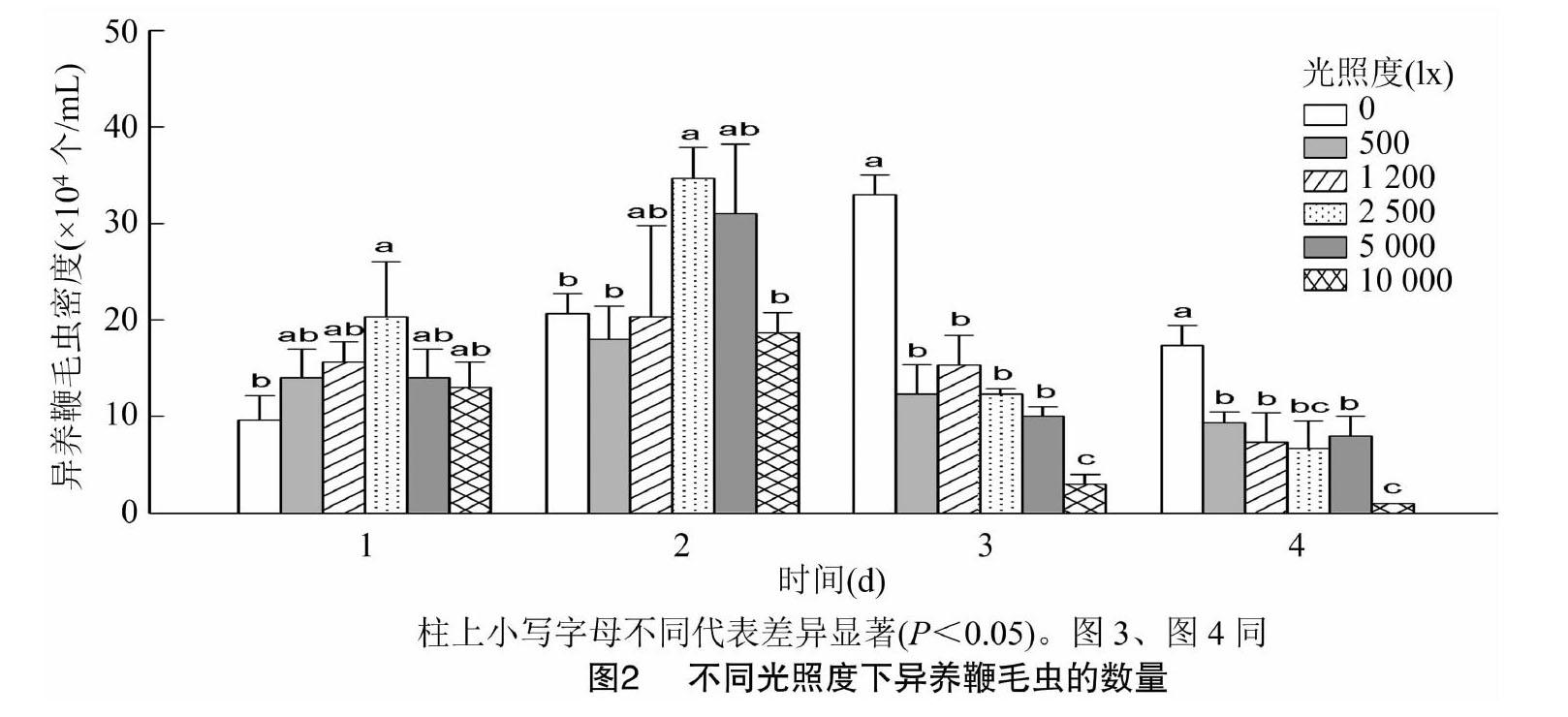
各光照度下的鞭毛虫种群数量分别在试验的第2、3天达到高峰值,随后逐渐下降(图2)。2 500、5 000 lx组的异养鞭毛虫生长速度较快,种群数量在第2天显著高于低光照组(0、500 lx)及最高光照组(10 000 lx),鞭毛虫数量由初始的5×104 个/mL
增长至(31~35)×104个/mL,其数量是低光照组及最高光照组的2倍。全黑暗组(0 lx)的鞭毛虫增长速度较其他光照组慢,在第3天才开始快速增长,并显著高于其他试验组。光照度过高不利于鞭毛虫数量的增长,光照度最高组(10 000 lx)的异养鞭毛虫数量增长缓慢且快速下降,在第3、4天,鞭毛虫数量显著低于其他光照组。因此,光照度对异养鞭毛虫密度增长有显著影响(P<0.05),鞭毛虫在光照度0~10 000 lx范围内均能生长,但最适生长光照度为0~5 000 lx。
光照度对鞭毛虫的生长率有显著影响(P<0.05)(图3)。当光照度为500~10 000 lx时,鞭毛虫的生长率在第1 天即达到最高峰,生长率高达0.94~1.37 d-1,表明鞭毛虫在试验初期即进入旺盛生长期;在第2天时,2 500、5 000 lx光照组的鞭毛虫生长率明显高于其他光照组;黑暗组的鞭毛虫生长率在试验过程中保持相对稳定,在第3、4天时显著高于其他光照组。最高光照组(10 000 lx)中的鞭毛虫生长率在第3、4天出现负值,显著低于其他光照组。因此,光照度过大时,不利于鞭毛虫种群的持续生长。
2.3 不同光照度下异养鞭毛虫对铜绿微囊藻的抑制作用
在0~10 000 lx 光照度范围内,异养鞭毛虫对铜绿微囊藻均具有明显抑制作用(图4),其抑制率高达88%~94%。光照度较低的0、500 lx组的异养鞭毛虫对微囊藻数量抑制能力较低,在试验的第3天才达到最高峰。光照度最高的10 000 lx组的抑制率在试验的第3、4 天出现明显下降,表明光照度过高不利于抑制铜绿微囊藻。
2.4 不同光照度下异养鞭毛虫对铜绿微囊藻的摄食作用
不同光照度對异养鞭毛虫的摄食率无显著影响(P>0.05)(图5)。光照度为0~10 000 lx时,异养鞭毛虫对铜绿微囊藻的摄食率达32~49个/d。
3 讨论
3.1 不同光照度对异养鞭毛虫生长的影响
有学者发现,光照是吞噬型鞭毛虫生长过程中不可缺少的生长要素[8-9,25-26]。Caron等发现鞭毛虫Dinobryon cylindricum在具有光照、并且持续提供食物的情况下保持旺盛生长,然而在黑暗中却停止对食物的吞噬作用,且生物量不断减少,在黑暗中存活时间不超过1 d[26]。Zhang等发现鞭毛虫在全黑暗的情况下,第2天生物量急剧下降,超过5 d时鞭毛虫即无法生存[8-9]。然而,本试验筛选的异养鞭毛虫Paraphysomonas sp.在全黑暗条件下,种群数量逐渐增长,比初始浓度增长了5.6倍,且最高种群密度与正常光照组密度相似。该鞭毛虫在持续7 d的全黑暗条件中均能生存,证明本试验所筛选的异养鞭毛虫适应能力强,不仅在光照中生长,也可以在黑暗中生存,并以吞噬微囊藻进行种群增长。
Caron等发现鞭毛虫Poterioochromonas malhamensis在不同光照度(500~25 000 lx)下生长率无显著差异,生长率达1.5~1.7 d-1[27]。Zhang等也发现类似的现象,鞭毛虫P. malhamensis在光照度1 000~2 500 lx内生长无明显差异[8-9]。然而,郭胜娟等发现在光照度 0~10 000 lx 范围内,鞭毛虫Poterioochromonas sp.的生长与光照表现出强的正相关关系[28]。本试验结果也表明不同光照度对异养鞭毛虫种群数量有显著影响(P<0.05)(图2)。光照度为 2 500、5 000 lx的异养鞭毛虫数量在第2天显著高于低光照组(0、500 lx)及最高光照组(10 000 lx)。全黑暗组(0 lx)的鞭毛虫增长速度较其他光照组慢,在第3天才开始快速增长,增长速度显著高于其他试验组。但是,光照度过高不利于鞭毛虫种群的增长,最高光照组(10 000 lx)的异养鞭毛虫数量增长较少且下降快,在第3、4天,鞭毛虫数量显著低于其他光照组,且出现负生长率。因此,本试验中鞭毛虫生长的较适光照度为0~5 000 lx。
3.2 不同光照度对异养鞭毛虫对铜绿微囊藻抑制作用的影响
已有研究报道鞭毛虫在光照条件下能有效抑制微囊藻的生长,但是在黑暗中鞭毛虫对微囊藻的抑制作用下降,微囊藻的数量保持不变甚至有轻微上升[9]。但是也有结论相反的研究,Yan等发现在 24 h 内,鞭毛虫Paraphysomonas sp.在黑暗环境下对微囊藻的抑制率高于光照条件下[29]。本试验表明,在0~10 000 lx 光照度范围内,异养鞭毛虫对铜绿微囊藻均具有抑制作用,其抑制率高达88%~94%,但是黑暗组的异养鞭毛虫对微囊藻数量抑制率上升较慢,在第3天达到高峰值。Skovgaard发现甲藻Fragilidium subglobosum在低光照条件下会起吞噬微囊藻作用,但强光照会抑制这种行为的发生[30]。本试验也发现类似的现象,最高光照组(10 000 lx)的抑制率在试验的第3、4 天显著低于其他光照组,表明过高或过低光照都会影响异养鞭毛虫抑制微囊藻的能力。
3.3 不同光照度对异养鞭毛虫摄食铜绿微囊藻作用的影响
Holen发现鞭毛虫Poterioochromonas malhamensis的摄食率受光照的影响,光照度与摄食率呈负相关,光照度越高(0~6 250 lx),摄食率越低,黑暗中鞭毛虫对食物的吞噬率是高光照组的3倍、低光照组的2倍[31]。然而,也有学者提出了相反的结论。郭胜娟等发现在光照度 0~10 000 lx 范围内,光照度对鞭毛虫Peterioochromonas sp.对铜绿微囊藻的摄食率无显著影响[28]。Zhang等也发现在持续光照或黑暗中,鞭毛虫对食物的摄食率相接近[9]。本试验结果表明,光照度(0~10 000 lx)对异养鞭毛虫的摄食率无显著影响,异养鞭毛虫对铜绿微囊藻的摄食率高达32~49个/d。
4 结论
综上所述,由于不同种类的异养鞭毛虫对光照的适应能力不同,因此光照对不同种类的异养鞭毛虫生长及其抑制铜绿微囊藻效率的影响也不同。本试验筛选的鞭毛虫具有较强的光照耐受能力,既能在黑暗环境中生存,也能在高光照度中生长及吞噬铜绿微囊藻,在0~10 000 lx光照度范围内,其生长率达0.94~1.37 d-1,对铜绿微囊藻的摄食率高达 32~49个/d,抑制率达88%~94%。为蓝藻水华的控制提供了一种新的原生动物品种。
参考文献:
[1]Park H D,Sasaki Y,Maruyama T,et al. Degradation of the cyanobacterial hepatotoxin microcystin by a new bacterium isolated from a hypertrophic lake[J]. Environmental Toxicology,2001,16(4):337-343.
[2]俞顺章,赵宁,资晓林,等. 饮水中微囊藻毒素与我国原发性肝癌关系的研究[J]. 中华肿瘤杂志,2001,23(2):8-11.
[3]王朝晖,林秋奇,胡韧,等. 广东省水库的蓝藻污染状况与水质评价[J]. 热带亚热带植物学报,2004,12(2):117-123.
[4]刘正文.湖泊生态系统恢复与水质改善[J]. 中国水利,2006(17):30-33.
[5]Nishibe Y,Manage P M,Kawabata Z,et al. Trophic coupling of a testate amoeba and Microcystis species in a hypertrophic pond[J]. Limnology,2004,5(2):71-76.
[6]Kim B R,Nakano S I,Kim B H,et al. Grazing and growth of the heterotrophic flagellate Diphylleia rotans on the cyanobacterium Microcystis aeruginosa[J]. Aquatic Microbial Ecology,2006,45(2):163-170.
[7]Mohamed Z A,Al-Shehri A M. Grazing on Microcystis aeruginosa and degradation of microcystins by the heterotrophic flagellate Diphylleia rotans[J]. Ecotoxicology and Environmental Safety,2013,96:48-52.
[8]Zhang X,Hu H Y,Men Y J,et al. Feeding characteristics of a golden alga (Poterioochromonas sp.) grazing on toxic cyanobacterium Microcystis aeruginosa[J]. Water Research,2009,43(12):2953-2960.
[9]Zhang X,Watanabe M M. Grazing and growth of the mixotrophic chrysomonad Poterioochromonas malhamensis(Chrysophyceae) feeding on algae[J]. Journal of Phycology,2001,37(5):738-743.
[10]閔 智,吴睿若,张 琨,等. 草履虫对铜绿微囊藻的吞噬能力研究[J]. 中国给水排水,2011,27(13):63-66.
[11]De K A,Yu J,Houtekamer M,et al. Cyanobacteria as a Carbon source for zooplankton in eutrophic Lake Taihu,China,measured by 13C labeling and fatty acid biomarkers[J]. Limnology and Oceanography,2012,57(4):1245-1254.
[12]Luo X L Z,Gulati R D. Cyanobacterial Carbon supports the growth and reproduction of Daphnia:an experimental study[J]. Hydrobiologia,2015,743(1):211-220.
[13]Yu J L,Li Y M,Liu X L,et al. The fate of cyanobacterial detritus in the food web of Lake Taihu:a mesocosm study using 13C and 15N labeling[J]. Hydrobiologia,2013,710(1):39-46.
[14]Ger K A,Urrutia-Cordero P,Frost P C,et al. The interaction between cyanobacteria and zooplankton in a more eutrophic world[J]. Harmful Algae,2016,54:128-144.
[15]Azam F,Fenchel T,Field J,et al. The ecological role of water-column microbes in the sea[J]. Marine Ecology Progress Series.Oldendorf,1983,10(3):257-263.
[16]Li J,Li R,and Li J. Current research scenario for microcystins biodegradation-a review on fundamental knowledge,application prospects and challenges [J]. Science of the Total Environment,2017,595:615-632.
[17]李鳳超,曹卫荣,康现江. 自由生活的异养鞭毛虫多样性及生态功能[J]. 生态学报,2009,29(9):5023-5029.
[18]Daley R J M G,Brown S. Phagotrophic ingestion of a blue-green alga by Ochromonas[J]. The Journal of Protozoology,1973,20(1):58-61.
[19]Cole G T,Wynne M J. Endocytosis of Microcystis aeruginosa by Ochromonas danica[J]. Journal of Phycology,1974,10(4):397-410.
[20]Ma M,Gong Y,and Hu Q. Identification and feeding characteristics of the mixotrophic flagellate Poterioochromonas malhamensis,a microalgal predator isolated from outdoor massive Chlorella culture [J]. Algal Research,2018,29:142-153.
[21]Wei C,Wang H,Ma M,et al. Factors affecting the mixotrophic flagellate Poterioochromonas malhamensis grazing on Chlorella cells[J]. The Journal of Eukaryotic Microbiology,2020,67(2):190-202.
[22]罗晓霞,李长玲,何雪怡,等. 异养鞭毛虫对铜绿微囊藻的生长影响[J]. 广东海洋大学学报,2019,39(3):38-45.
[23]黄凌风,潘 科,郭 丰,等. 我国海洋微型异养鞭毛虫研究:现状与展望[J]. 厦门大学学报(自然科学版),2006(S2):62-67.
[24]Basu B,Pick F. Factors related to heterotrophic bacterial and flagellate abundance in temperate rivers[J]. Aquatic Microbial Ecology,1997,12(2):123-129.
[25]Rottberger J,Gruber A,Boenigk J,et al. Influence of nutrients and light on autotrophic,mixotrophic and heterotrophic freshwater chrysophytes[J]. Aquatic Microbial Ecology,2013,71(2):179-191.
[26]Caron D,Sanders R W,Lim E L,et al. Light-dependent phagotrophy in the freshwater mixotrophic chrysophyte Dinobryon cylindricum[J]. Microbial Ecology,1993,25(1):93-111.
[27]Caron D A P K,Sanders R W. Carbon,Nitrogen,and Phosphorus budgets for the mixotrophic phytoflagellate Poterioochromonas malhamensis (Chrysophyceae) during bacterial ingestion[J]. Limnology and Oceanography,1990,35(2):433-443.
[28]郭胜娟,甘南琴,郑凌凌,等. 环境因子对金藻生长和噬藻速率的影响[J]. 水生生物学报,2010,34(1):1-8.
[29]Yan C,Li J H,Li J J,et al. A heterotrophic nanoflagellate grazing on the toxic Cyanobacterium Microcystis aeruginosa[J]. Ann. Limnol.-Int. J. Lim.2009,45(1):23-28.
[30]Skovgaard A. Mixotrophy in Fragilidium subglobosum (Dinophyceae):growth and grazing responses as functions of light intensity [J]. Marine Ecology Progress Series,1996,143:247-253.
[31]Holen D A. Effects of prey abundance and light intensity on the mixotrophic chrysophyte Poterioochromonas malhamensis from a mesotrophic lake[J]. Freshwater Biology,1999,42(3):445-455.
