泡菜直投菌对小鼠肠道菌群失调的修复效果
2021-09-12肖冠坤郭佳汶程如越彭天宇李毓萍陈书巧陈功张其圣李鸣
肖冠坤,郭佳汶,程如越,彭天宇,李毓萍,陈书巧,陈功,张其圣,李鸣*
(1.四川大学华西公共卫生学院,华西第四医院,四川 成都 610041;2.四川省食品发酵工业研究设计院,四川 成都 611130;3.四川东坡中国泡菜产业技术研究院,四川 眉山 620010)
在肠道内定植的数量庞大、组成复杂的肠道菌群是肠道微环境和机体的重要组成部分[1-2]。肠道菌群与机体互利共生,肠道提供了恒温且富含营养的生存环境,肠道菌群则具有调节肠道运动和分泌、参与营养物质消化吸收、构成肠道上皮生物屏障、调节免疫系统等生理功能[2-4]。正常情况下,肠道菌群与机体保持动态平衡,其丰度和多样性受到种族、年龄、饮食、生活方式、益生菌、运动、药物、疾病等多种因素的影响,其中最常见的影响肠道菌群的药物是抗菌药物,尤其是广谱抗菌药物[2-3]。
抗生素是人类抵御细菌感染的重要手段[5]。近年来,抗生素滥用导致细菌耐药性和人体不良反应的发生率大大增加,破坏肠道微生态平衡,引起肠道菌群紊乱,增加慢性病的发病风险,严重威胁人类健康[5-6]。益生菌因其具有调节肠道菌群和拮抗有害微生物定植的生理作用,常被作为抗生素的替代或辅助治疗物[6-7]。
泡菜是我国食用广泛、历史悠久的发酵食品,富含以乳酸菌为主的有益菌群[8-9]。泡菜直投菌(direct vat set Lactobacillus,DVSL)是从四川泡菜中提取的植物乳杆菌,安全性较高,耐酸耐胆盐性能优良,能在人体肠道中定植,具有促进营养物质消化吸收、维持肠道菌群平衡、改善肠道功能、降低胆固醇等作用[8-11]。
本研究通过建立抗生素诱导的肠道菌群失调小鼠模型,观察抗生素对肠道菌群和生长发育的影响,探究泡菜直投菌对抗生素诱导的小鼠肠道菌群失调的修复效果及其对机体的影响,为泡菜直投菌的肠道功能改善和肠道菌群调节作用提供试验依据。
1 材料与方法
1.1 材料
1.1.1 实验动物及饲养
36只四周龄SPF级BALB/c雄性小鼠:四川省人民医院(四川省医学科学院)实验动物研究所,动物合格证号SCXK(川)2013-15。饲养于四川大学华西公共卫生学院动物实验中心IVC系统,室温(23±1)℃,湿度50%~70%,自由饮食,12 h昼夜节律。
1.1.2 试剂与材料
头孢曲松:上海阿拉丁生化科技股份有限公司;泡菜直投菌菌粉(植物乳杆菌pc170株,活性量108CFU/g):四川省食品发酵工业研究设计院;无水乙醇:成都金山化学试剂有限公司;RT-PCR反应系列试剂:伯乐生命医学产品上海有限公司(BIO-RAD);粪便细菌DNA提取试剂盒:天根生化科技(北京)有限公司;粪便16S rRNA V6-V8区引物(U968F:5'-AACGCGAAGAACCTTAC-3'和L1401R:5'-CGGTGTGTACAAGACCC-3')、16S rRNA V3-V4 区引物(338F:5'-ACTCCTACGGGAGGCAGCAG-3'和806R:5'-GGACTACHVGGGTWTCTAAT-3'):上海生工生物工程股份有限公司。
1.2 实验方法
1.2.1 分组
36只四周龄BALB/c雄性小鼠随机分为对照组(control group,Ctrl)、抗生素组(antibiotics exposure group,Abx)、泡菜直投菌组(PC),每组 12 只,单只分笼喂养。
1.2.2 灌胃
第1周Ctrl组小鼠0.2 mL生理盐水灌胃,Abx组和PC组0.2 mL头孢曲松(40 mg/d)灌胃,间隔2 h后,PC组0.2 mL泡菜直投菌(109CFU/d)灌胃,Abx组和Ctrl组0.2 mL生理盐水灌胃。第2至4周PC组小鼠0.2 mL泡菜直投菌(109CFU/d)灌胃,其余两组0.2 mL生理盐水灌胃。
1.2.3 称重及计算脏器指数
灌胃期间每3 d称重,记录结果。灌胃第28天处死小鼠并采集样品,称量脏器质量,计算脏器指数。
1.2.4 粪便DNA提取及细菌定量
每周采集粪便,-80℃冻存。严格遵照粪便基因组DNA提取试剂盒操作步骤提取粪便DNA。采用实时荧光定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qPCR)测定小鼠粪便细菌总量,反应条件:95℃预热 1 min,94℃解链 20 s,55℃退火20 s,72℃延伸50 s,共40个循环。根据大肠杆菌标准曲线计算粪便样品细菌浓度。
1.2.5 二代测序
1.2.5.1 基因组DNA的提取和PCR扩增
采用溴化十六烷基三甲基铵(cetyltrimethyl ammonium bromide,CTAB)方法提取样本基因组DNA,琼脂糖凝胶电泳检测DNA的纯度和浓度。取适量样本DNA于离心管中,用无菌水稀释样本至1 ng/μL。以稀释后的基因组DNA为模板,根据测序区域的选择,使用带Barcode的特异引物、含GC缓冲液的高保真PCR混合物和高效高保真酶进行PCR,确保扩增效率和准确性。
16S V4区引物(515F和806R)用于鉴定细菌多样性;18S V4区引物(528F和706R)用于鉴定真核微生物多样性;ITS1区引物(ITS5-1737F和ITS2-2043R)用于鉴定真菌多样性;此外,扩增区域还包括:16S V3-V4区、V4-V5区,古菌16S V4区、V4-V8区,18S V9区以及ITS2区。
1.2.5.2 PCR产物的混样和纯化
根据PCR产物浓度进行等量混样,充分混匀后使用2%琼脂糖凝胶电泳检测PCR产物,对目的条带使用qiagen公司提供的胶回收试剂盒回收产物。
1.2.5.3 文库构建和上机测序
使用TruSeq®DNA PCR-Free Sample Preparation Kit建库试剂盒进行文库构建,构建好的文库经Qubit和qPCR定量,文库合格后,使用HiSeq2500 PE250进行上机测序。
1.2.6 组织病理学检测
灌胃第28天处死小鼠,以盲肠为界收集小鼠结肠及回肠各约1 cm,10%甲醛固定后做组织切片,苏木精-伊红染色观察回肠及结肠结构。应用Image-Pro Plus 6.0以右下角100倍标尺为标准,每张切片选取5根完整绒毛,测量绒毛高度(mm)、肠腺深度(mm),作统计学分析。
1.3 统计方法
实验数据采用Microsoft Office Excel 2010建立数据库,SPSS 22.0进行数据分析,数据结果以±S表示,符合参数检验条件的数据,多组间比较采用方差分析和Dunnett-t检验,体重采用重复测量资料的方差分析;不符合参数检验条件的数据,多组间比较采用Kruskal-Wallis H秩和检验,P<0.05表示差异具有统计学意义。
2 结果与讨论
2.1 小鼠机体一般情况
2.1.1 体重
实验期间小鼠体重变化情况见图1。
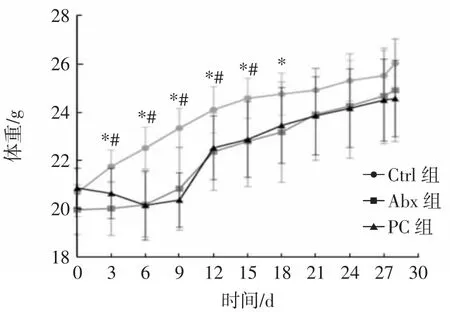
图1 实验期间小鼠体重变化情况Fig.1 Body weight of mice during the experiment
如图1所示,整个试验期间3组小鼠体重不同(F=5.32,P<0.01),且3组小鼠体重随时间变化的趋势不同(F=4.19,P<0.01)。从第 3天开始,Abx组、PC 组小鼠体重显著低于Ctrl组(P<0.05),PC组和Abx组小鼠体重分别自灌胃第18天和第21天与Ctrl组无显著差异(P>0.05)。
2.1.2 肝脏质量和肝脏指数
小鼠肝脏质量和肝脏指数见表1。
表1 小鼠肝脏质量和肝脏指数(±S)Table 1 Liver weight and liver index of mice

表1 小鼠肝脏质量和肝脏指数(±S)Table 1 Liver weight and liver index of mice
注:与Ctrl组比较,*P<0.05差异显著,**P<0.01差异极显著。
组别 肝脏质量/g 肝脏指数Ctrl组 1.173±0.090 45.02±2.21 Abx组 1.045±0.137* 41.83±2.66**PC 组 1.037±0.061** 41.59±1.43**
由表1可知,第4周小鼠的肝脏质量和肝脏指数,Abx组和PC组均显著低于Ctrl组(P<0.05),PC组则与Abx组无显著差异(P>0.05)。
2.2 小鼠粪便菌群及肠道病理
2.2.1 粪便细菌数量
小鼠粪便细菌数量见图2。

图2 小鼠粪便细菌数量Fig.2 Fecal bacteria concentration of mice
如图2所示,第1周和第2周,Abx组、PC组小鼠粪便细菌数量均极显著低于Ctrl组(P<0.01),第3周Abx组小鼠粪便细菌数量显著高于Ctrl组和PC组(P<0.05),PC 组则极显著低于 Ctrl组(P<0.01),第 4周Abx组和PC组小鼠粪便细菌数量极显著高于Ctrl组(P<0.01)。
2.2.2 粪便菌群组成
第1周和第4周各组小鼠门水平粪便菌群组成见图3。
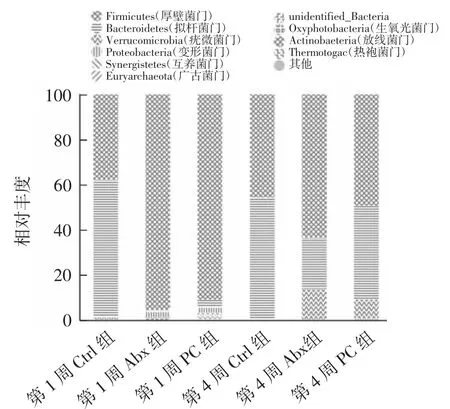
图3 第一周和第四周各组小鼠门水平粪便菌群组成Fig.3 Fecal bacteria composition of mice in the first and fourth week
如图3所示,在门水平上,第1周Ctrl组小鼠粪便菌群组成为拟杆菌门最多,厚壁菌门次之,其余两组均为厚壁菌门占显著优势;第4周Abx组和PC组粪便菌群组成为厚壁菌门最多,拟杆菌门次之,还有部分疣微菌门,拟杆菌门所占比例较第1周明显增加,PC组粪便菌群组成更接近Ctrl组。
2.2.3 粪便菌群α多样性
小鼠粪便菌群的丰富度指数(Ace,Chao1)和多样性指数(Shannon,Simpson)如图4和图5所示。

图4 第1周粪便菌群α多样性Fig.4 α diversity of fecal bacteria in the first week
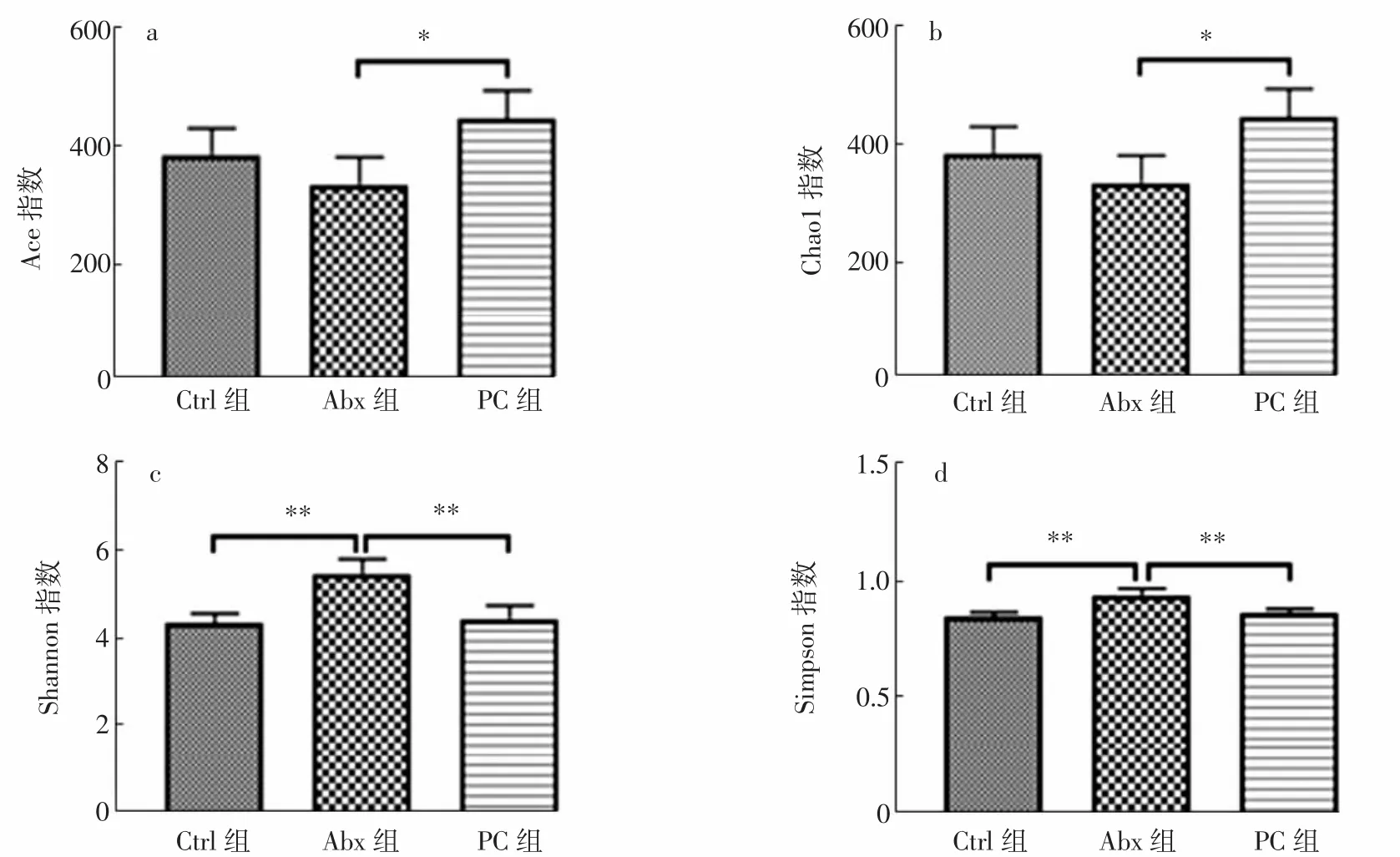
图5 第4周粪便菌群α多样性Fig.5 α diversity of fecal bacteria in the fourth week
第1周Abx组和PC组丰富度指数与Ctrl组无显著差异(P>0.05),多样性指数显著低于 Ctrl组(P<0.05);而PC组多样性指数极显著优于Abx组(P<0.01)。第4周Abx组多样性指数极显著高于Ctrl组(P<0.01);PC组丰富度指数显著高于Abx组(P<0.05),多样性数极显著低于Abx组(P<0.01)。
2.2.4 肠道病理
小鼠肠道病理指标见表2,肠道病理切片见图6。
表2 小鼠肠道病理指标(±S)Table 2 Intestinal pathological characteristics of mice

表2 小鼠肠道病理指标(±S)Table 2 Intestinal pathological characteristics of mice
结肠绒毛高度/mm 肠腺深度/mm 绒毛高度/肠腺深度 肠腺深度/mm Ctrl组 0.196±0.031 0.107±0.010 1.832±0.189 0.128±0.028 Abx组 0.181±0.036 0.094±0.013 1.968±0.458 0.118±0.021 PC 组 0.177±0.031 0.097±0.017 1.857±0.322 0.123±0.018组别 回肠images/BZ_170_1789_1658_1806_1722.png

图6 小鼠肠道病理切片Fig.6 Intestinal pathological sections of mice
由表2可知,第4周3组小鼠回肠绒毛高度、回肠肠腺深度、回肠绒毛高度/肠腺深度、结肠肠腺深度均无显著差异(P>0.05)。
3 讨论
肠道菌群是肠道微生态系统的重要组成部分,其平衡与机体健康息息相关,肠道菌群失调会影响机体生长发育,增加糖尿病、心血管疾病等慢性病的发病风险,引起胃肠道功能障碍和有毒代谢产物增多,还可通过肠道菌群-肠-脑轴引发焦虑、抑郁、认知降低等症状及中枢神经系统疾病[3-4]。
抗生素滥用已成为肠道菌群失调的重要原因,长期使用抗生素不仅会损伤肠黏膜,减弱肠道上皮屏障的防御作用,影响机体代谢,还会破坏肠道菌群平衡,增加疾病发生风险[2,12-13]。抗生素的抗菌谱、给药途径、肠内浓度等因素均与抗生素对肠道菌群的影响及影响时间、停止用药后肠道菌群的恢复时间等有关[3,13]。
本研究发现,生命早期使用头孢曲松会显著影响小鼠体重、肝脏质量、肠道菌群数量及构成,且在停用后仍对机体有一定影响;泡菜直投菌有助于抗生素诱导的小鼠体重降低和肠道菌群失调的修复,在一定程度上修复抗生素对机体造成的损伤。
3.1 小鼠机体一般情况
第3天~第15天Abx组、PC组小鼠体重显著低于Ctrl组,说明在生命早期使用抗生素会影响小鼠自然生长,减缓生长速度;PC组体重恢复时间早于Abx组,说明泡菜直投菌可能有助于抗生素停用后小鼠体重的恢复。万群等[14]对新生小鼠灌胃21 d头孢曲松后发现,生命早期使用头孢曲松会导致小鼠体重显著降低,且在停止干预后,到成年阶段小鼠体重仍未恢复正常,这与本研究中抗生素干预的小鼠在后续喂养中体重恢复正常的结果不同,可能与头孢曲松使用的生命阶段、给药持续时间、施用剂量不同等原因相关。本研究未探究头孢曲松的剂量效应和时间梯度,头孢曲松对小鼠自然生长的更详细影响可进一步探索。
第4周Abx组小鼠肝脏质量和肝脏指数显著低于Ctrl组,说明头孢曲松会降低肝脏质量;PC组小鼠肝脏质量和肝脏指数显著低于Ctrl组,且与Abx组无显著差异,说明泡菜直投菌对抗生素造成的肝脏质量降低的修复不佳。抗生素造成肝脏损伤的机制可能与其诱导的肠道菌群失调有关,肠道菌群失调可使机体内毒素增高,而肝脏是机体代谢有毒物质的主要场所,内毒素不断增高导致肝脏超过其代偿能力从而造成肝脏损伤,肝脏损伤发展到一定程度时,则反过来影响肠道菌群平衡,形成恶性循环[15]。研究显示泡菜直投菌能够减轻大鼠肝脏脂肪变性程度,缓解小鼠急慢性酒精性肝损伤[10,16],这与本研究结果不同,可能是肝损伤诱因、益生菌使用持续时间不同等原因所致。本研究仅测量了肝脏质量和肝脏指数,未对相关生化指标进行检测,故头孢曲松对肝脏是否具有损伤作用及其机制,泡菜直投菌对肝脏的保护机制仍待探索。
3.2 小鼠粪便菌群及肠道病理
第1周Abx组和PC组小鼠粪便细菌数量和多样性指数显著低于Ctrl组,粪便菌落组成与Ctrl组差异较大,说明头孢曲松会破坏肠道菌群稳态,减少肠道细菌的数量。第4周Abx组和PC组小鼠粪便细菌数量显著高于Ctrl组,PC组小鼠的粪便菌群构成和丰富度指数优于Abx组,说明抗生素对肠道菌群的影响具有显著的后效应,而肠道菌群稳态在受到抗生素破坏后能够自我修复,但无法修复到未被抗生素干扰时的状态,Abx组粪便细菌数量增加可能是头孢曲松杀灭肠道中大多数正常菌群,改变肠道菌群结构而导致的过度修复;泡菜直投菌可耐受消化道环境并在肠道中定植,作为肠道菌群中的有益菌,其分泌的乳酸等可改善肠道微环境,利于双歧杆菌、乳酸杆菌等厌氧菌的增殖,促进肠道菌群结构修复。
第4周3组小鼠肠道病理指标无显著差异,可能原因如下:抗生素造成的肠道病理损伤较轻微;抗生素对肠道造成的病理损伤在后续饲养中逐渐恢复至基本正常。体内外研究显示,双歧杆菌、乳酸杆菌及其代谢产物可促进肠道上皮细胞增殖,增加肠道绒毛细胞数目,其数量与回肠黏膜厚度、绒毛高度和肠腺深度密切相关,表明益生菌在维持肠黏膜完整结构和肠黏膜屏障正常功能方面发挥重要作用,有助于减轻抗生素诱导的肠黏膜损伤并促进修复[17-18]。若要探究头孢曲松对肠道的损伤作用,可增加1个与Abx组处理措施相同的实验组,在第1周灌胃结束后处死采样,观察肠道病理。
本研究还在免疫方面做了一些探索,发现泡菜直投菌降低了脾脏IL-10的表达,但目前益生菌对于IL-10表达的作用存在争议[19-21],故泡菜直投菌是否具有免疫调节作用,以及其对机体产生的效应是否与免疫机制相关仍待探究。
4 结论
本研究初步探索了抗生素对小鼠肠道菌群及生长发育的影响,泡菜直投菌对抗生素诱导的小鼠肠道菌群失调的修复效果及其对机体的影响。研究发现,生命早期使用头孢曲松可显著影响小鼠自然生长,破坏肠道微生态平衡,且具有显著的后效应;泡菜直投菌有助于抗生素诱导的体重降低和肠道菌群紊乱的修复。目前我国对泡菜直投菌的研究主要集中于泡菜及其发酵过程中乳酸菌菌系的分析、优良发酵乳酸菌的筛选、重要乳酸菌的生物学特性、直投式乳酸菌剂的开发等方面[22],有关其生理作用的研究较为空缺,泡菜直投菌对肠道菌群的调节作用以及机体的改善效果仍待进一步探索。
