可溶性蛋壳膜蛋白的提取工艺研究
2021-09-12刘元郝惠阳暴悦梅王玥玮
刘元,郝惠阳,暴悦梅,王玥玮
(天津市食品研究所有限公司,天津 301609)
随着禽蛋产量的不断增加,大量的蛋壳被废弃,污染环境的同时资源也未得到有效利用。废弃鸡蛋壳中含有大量的钙类物质、蛋白质、活性肽等功能成分,具有一定的深加工价值。目前国内外专家、学者的研究主要集中在蛋壳粉的利用、蛋壳制备有机酸钙、蛋壳内膜及残留蛋清的利用等4个方面[1]。其中,蛋壳内膜的深加工利用成为当下研究热点。蛋壳膜俗称“凤凰衣”,存在于蛋清和蛋壳之间,由直径为2 μm的纤维组成,呈网状结构,是一种双层水不溶性膜,分为内膜和外膜,外膜的厚度为50 μm~70 μm,而内膜为15 μm~30 μm[2]。蛋壳膜主要是由角膜和黏多糖类相结合组成的复合蛋白质,其中含有乙酰氨基葡萄糖半乳糖硫酸软骨素、氨基酸等可溶性高分子化合物[3-6]。鸡蛋壳膜还含有多种氨基酸,且根据最新研究结果显示,蛋壳膜主要由高度交联的半胱氨酸组成[7]。
由于鸡蛋壳膜具有独特的结构与生物活性,因此被广泛应用于医药、环境工程、轻工业等多个领域[8]。本研究采用乙酸-酶解联用分段提取技术,对鸡蛋壳膜进行深加工,提高了鸡蛋壳膜蛋白的提取率,具有广阔的市场前景和社会经济效益,促进了废弃蛋壳综合利用产业的发展。
1 材料与方法
1.1 试验材料
1.1.1 试验原料
鸡蛋壳(碳酸钙93%,磷酸钙及磷酸3%,其它4%):天津市食品集团提供。
1.1.2 主要试剂
胃蛋白酶[1∶10 000(NFU/mg)]:庞博生物酶制剂有限公司;乙酸(分析纯)、考马斯亮蓝G250、磷酸(分析纯)、乙醇(分析纯)、氯化钠(分析纯)、硫酸(优级纯)、硼酸(分析纯)、盐酸(分析纯):国药集团化学试剂有限公司;牛血清白蛋白标准品(2 mg/mL):上海泽叶生物科技有限公司。
1.1.3 仪器
UV-3000紫外可见分光光度计:上海美谱达仪器有限公司;AG204型电子天平(0.000 1 g):瑞士Mettle Toledo公司;HZY-223-323型电子天平(0.001 g):福州华志科学仪器有限公司;101-3-S型电热恒温鼓风干燥箱:上海跃进医疗器械厂;FN-200型高速万能粉碎机:北京中兴伟业仪器有限公司;HH-6型恒温水浴锅:南京市新瑞仪器厂;L2-6K型离心机:湖南可成仪器设备有限公司;SHZ-C往复式水浴恒温振荡器:绍兴上虞艾科仪器设备有限公司。
1.2 方法
1.2.1 样品预处理
样品预处理工艺流程:鸡蛋壳(带壳膜)→清洗→加水搅拌破碎→取上浮的壳膜→漂洗→45℃烘干→粉碎→过50目筛→备用。
1.2.2 试验试剂的制备
考马斯亮蓝G250染色液:称取考马斯亮蓝G250 100 mg溶于50 mL 95%的乙醇中,加入100 mL 85%的磷酸,用蒸馏水稀释至1 000 mL[9]。
标准蛋白质溶液:根据其纯度用0.15 mol/LNaCl溶液配制成1.0 mg/mL牛血清蛋白溶液。
1.2.3 可溶性蛋白质的测定
1.2.3.1 标准曲线的绘制
取7支试管,按照0~6进行标号,按照顺序依次加入 0.00、0.05、0.10、0.15、0.20、0.25、0.30 mL 标准蛋白溶液,0.30、0.25、0.20、0.15、0.10、0.05、0.00 mL0.15 mol/L NaCl溶液,每支试管加入5 mL考马斯亮蓝试剂,摇匀,5 min后以0号管为空白对照,在595 nm处测定溶液的吸光值,并以吸光值为纵坐标,标准蛋白质质量为横坐标,绘制标准曲线[10],结果见图1。

图1 蛋白质标准曲线Fig.1 Protein standard curve
经数据分析,其回归方程为y=3.515x+0.017 9,相关系数R2=0.999 4。
1.2.3.2 样品蛋白质浓度测定
取0.3 mL的样品,同1.2.3.1试验方法,根据所测定的595 nm处吸光值,在标准曲线上查出其相当于标准蛋白的量,计算出样品的蛋白质浓度(mg/mL)。
1.2.3.3 鸡蛋壳膜蛋白提取率
采用微量凯式定氮法及考马斯亮蓝G250法[11]分别测定鸡蛋壳膜样品及鸡蛋壳膜蛋白提取液的蛋白质含量,按姜莉[12]的方法计算相应提取率,计算公式如下。
蛋白质提取率/%=提取液蛋白质含量×提取液体积/(蛋壳膜的蛋白质含量×蛋壳膜质量)×100
1.2.4 乙酸提取蛋白的试验设计
1.2.4.1 提取液(乙酸)浓度对蛋白提取率的影响
称取一定量的鸡蛋壳膜粉末,按照液料比为100∶1(mL/g)加入到乙酸中(设定乙酸浓度分别为0.5、1.0、1.5、2.0、2.5 mol/L),置于80℃的恒温振荡器中连续反应5 h取出,离心、定容,采用考马斯亮蓝G250法测定溶液中的蛋白质含量,以提取率为指标,确定适宜的乙酸浓度。
1.2.4.2 提取温度对蛋白提取率的影响
称取一定量的鸡蛋壳膜粉末,按照液料比为100∶1(mL/g)加入到1.5 mol/L乙酸中,置于恒温振荡器中连续反应5h取出(设定温度分别为50、60、70、80、90℃),离心、定容,采用考马斯亮蓝G250法测定溶液中的蛋白质含量,以提取率为指标,确定适宜的提取温度。
1.2.4.3 液料比对蛋白提取率的影响
称取一定量的鸡蛋壳膜粉末,分别按照液料比为40∶1、60∶1、80∶1、100∶1、120∶1(mL/g)加入到 1.5 mol/L 乙酸中,置于70℃的恒温振荡器中连续反应5 h取出,离心、定容,采用考马斯亮蓝G250法测定溶液中的蛋白质含量,以提取率为指标,确定适宜的液料比。
1.2.4.4 提取时间对蛋白提取率的影响
称取一定量的鸡蛋壳膜粉末,分别按照液料比为100∶1(mL/g)加入到 1.5 mol/L 乙酸中,置于 70 ℃的恒温振荡器中连续反应 2、3、4、5、6 h 取出,离心、定容,采用考马斯亮蓝G250法测定溶液中的蛋白质含量,以提取率为指标,确定适宜的提取时间。
1.2.4.5 乙酸提取可溶性鸡蛋壳膜蛋白的正交试验
在单因素试验的基础上,以乙酸浓度、提取温度、液料比、提取时间为试验因素,采用正交试验设计以确定乙酸提取可溶性鸡蛋壳膜蛋白的最佳提取工艺条件。正交试验因素与水平表见表1。
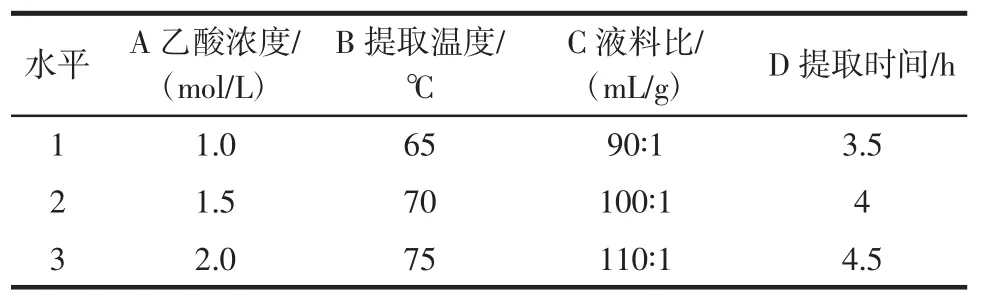
表1 正交试验因素与水平设计Table 1 Orthogonal experimental factors and level
1.2.5 胃蛋白酶提取蛋白的试验设计
1.2.5.1 酶添加量对蛋白提取率的影响
称取一定量乙酸提取后的鸡蛋壳膜残渣,在提取时间为5 h,提取温度为40℃,底物浓度6%,pH2.0条件下,选择不同的酶添加量(400、600、800、1 000、1 200 U/g)进行提取反应,之后90℃灭酶,离心,调节pH值至7.0,计算鸡蛋壳膜蛋白提取率。
1.2.5.2 底物浓度对蛋白提取率的影响
称取一定量乙酸提取后的鸡蛋壳膜残渣,在提取时间为5 h,提取温度为40℃,酶添加量800 U/g,pH2.0条件下,选择不同的底物浓度(2%、4%、6%、8%、10%),进行提取反应,之后90℃灭酶,离心,调节pH值至7.0,计算鸡蛋壳膜蛋白提取率。
1.2.5.3 提取温度对蛋白提取率的影响
称取一定量乙酸提取后的鸡蛋壳膜残渣,在提取时间为5 h,底物浓度6%,酶添加量800 U/g,pH2.0条件下,选择不同的提取温度(30、35、40、45、50 ℃),进行提取反应,之后90℃灭酶,离心,调节pH值至7.0,计算鸡蛋壳膜蛋白提取率。
1.2.5.4 提取时间对蛋白提取率的影响
称取一定量乙酸提取后的鸡蛋壳膜残渣,在温度为40℃,底物浓度6%,酶添加量800 U/g,pH2.0条件下,选择不同的提取时间(2、3、4、5、6 h),进行提取反应,之后90℃灭酶,离心,调节pH值至7.0,计算鸡蛋壳膜蛋白提取率。
1.2.5.5 pH值对蛋白提取率的影响
称取一定量乙酸提取后的鸡蛋壳膜残渣,在提取温度为40℃,底物浓度6%,酶添加量800 U/g,提取时间 5 h条件下,选择不同的 pH 值(1.5、2.0、2.5、3.0、3.5),进行提取反应,之后90℃灭酶,离心,调节pH值至7.0,计算鸡蛋壳膜蛋白提取率。
1.2.5.6 胃蛋白酶提取可溶性鸡蛋壳膜蛋白的正交试验
在单因素试验的基础上,以酶添加量、底物浓度、提取温度、提取时间为试验因素。采用正交试验设计以确定胃蛋白酶提取可溶性鸡蛋壳膜蛋白的最佳工艺条件。正交试验因素与水平见表2。
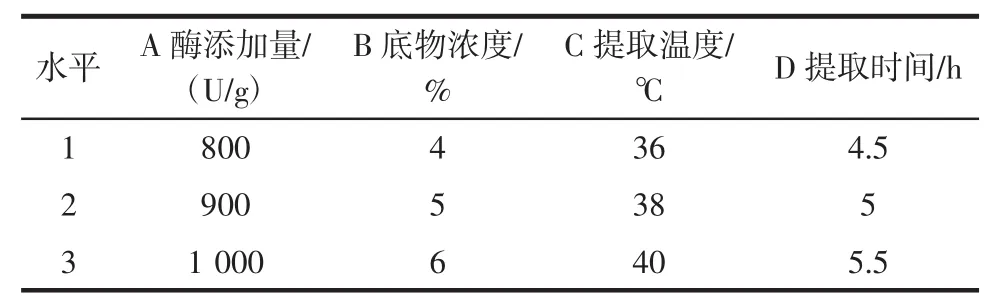
表2 正交试验因素与水平设计Table 2 Orthogonal experimental factors and level
1.3 数据处理
应用SAS软件和Excel软件进行数据分析。
2 结果与分析
2.1 乙酸提取鸡蛋壳膜蛋白的试验设计结果
2.1.1 提取液(乙酸)浓度对蛋白提取率的影响
乙酸浓度对蛋白提取的影响见图2。
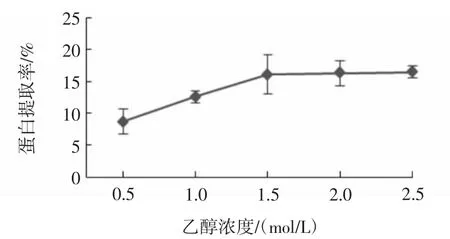
图2 乙酸浓度对蛋白提取的影响Fig.2 Effect of acetic acid concentration on protein extraction
由图2可知,随着乙酸浓度的增加,蛋白提取率也在增加,这是由于酸法提取是利用一定离子浓度的酸性条件破坏分子间的化学键,而引起纤维膨胀、溶解,且酸法提取可以最大程度地保持蛋白的三螺旋结构,利于进一步提取活性物质[13-15]。当乙酸浓度到1.5 mol/L后,曲线变化平缓。综合考虑,确定乙酸浓度为1.5 mol/L为最佳乙酸浓度。
2.1.2 提取温度对蛋白提取率的影响
提取温度对蛋白提取率的影响见图3。

图3 提取温度对蛋白提取的影响Fig.3 Effect of extraction temperature on protein extraction
由图3可知,在提取温度为50℃~60℃时,提取率增长较为平缓。这是由于鸡蛋壳膜具有高度交联的纤维结构,不易溶解。当提取温度达到70℃时,其提取率显著增加,这是由于在高温条件下,鸡蛋壳膜中的二硫键因还原反应逐渐断裂,致使鸡蛋壳膜结构逐步变薄、溶解。当提取温度超过70℃后,蛋白质提取率增长平缓,这可能是由于蛋白质因为温度过高发生变性,使蛋白质分子过度聚合导致。故在选择鸡蛋壳膜提取时的最佳温度为70℃[10]。
2.1.3 液料比对蛋白提取率的影响
液料比对蛋白提取率的影响见图4。

图4 液料比对蛋白提取率的影响Fig.4 Effect of liquid-material ratio on protein extraction rate
由图 4 可知,当液料比为 100∶1(mL/g)时,鸡蛋壳膜蛋白提取率曲线达到顶峰。底物浓度对于反应的速率影响较大,这可能是由于当底物浓度增加时,底物的黏度也随之增加,这有碍于提取剂与底物的充分接触,进而造成蛋白质提取率降低。因此,选用液料比为100∶1(mL/g)。
2.1.4 提取时间对蛋白提取率的影响
提取时间对蛋白提取率的影响见图5。

图5 提取时间对蛋白提取率的影响Fig.5 Effect of extraction time on protein extraction rate
由图5可知,蛋白质提取率随着提取时间的延长而不断提高,但当提取时间超过4 h后,蛋白质提取率基本趋于稳定。综合考虑,选择提取时间为4 h为宜。
2.1.5 乙酸提取可溶性鸡蛋壳膜蛋白的最佳工艺条件
根据单因素试验结果,进行正交试验。试验结果及方差分析结果如表3~表4所示。
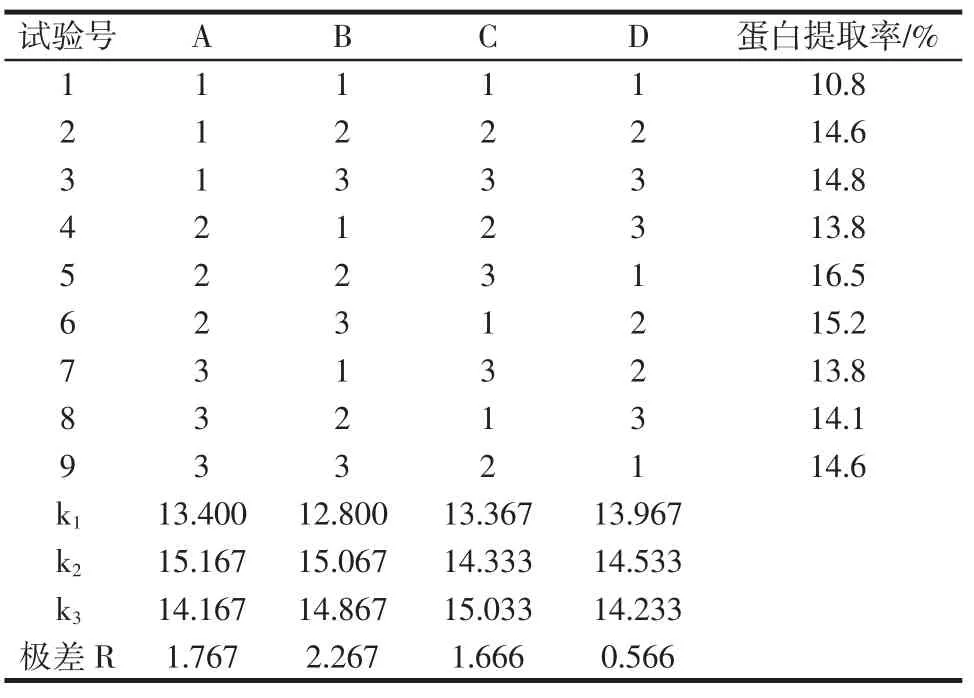
表3 正交试验结果及极差Table 3 Results of orthogonal test and range

表4 方差分析结果Table 4 Analysis of variance
由表3可知,4个因素对蛋白提取率影响的重要性依次为B提取温度>A乙酸浓度>C液料比>D提取时间。由表4可知,提取温度对蛋白提取率具有显著的影响,其影响在4个因素中相对最大。通过对比k值可以得到各因素最佳水平为A2B2C3D2,即理论优化工艺条件为乙酸浓度1.5 mol/L,提取温度为70℃,液料比为 110∶1(mL/g),提取时间为 4 h。在此条件下蛋白提取率为17.2%,提取率明显高于正交试验中最优组合A2B2C3D1(16.5%)。
2.2 胃蛋白酶提取鸡蛋壳膜蛋白的试验设计结果
2.2.1 酶添加量对蛋白提取率的影响
酶添加量对蛋白提取率的影响见图6。

图6 酶添加量对蛋白提取率的影响Fig.6 Effect of enzyme addition amount on protein extraction rate
由图6可知,随着酶添加量的增加,鸡蛋壳膜蛋白提取率也随之提高。当酶添加量大于800 U/g时,提取率增长缓慢。综合考虑,选取酶添加量为800 U/g。
2.2.2 底物浓度对蛋白提取率的影响
底物浓度对蛋白提取率的影响见图7。

图7 底物浓度对蛋白提取率的影响Fig.7 Effect of substrate concentration on protein extraction rate
由图7可知,当底物浓度增加时,蛋白质提取率呈下降趋势,这可能是由于底物浓度较高时,整个反应体系较为浓稠,提取剂不能均匀地分散在体系之中,提取剂与鸡蛋壳膜残渣得不到充分接触。因此不利于反应的充分进行。但经综合考虑,底物浓度过低时,试剂不能有效利用,造成资源浪费。因此底物浓度选择为4%~6%。
2.2.3 提取温度对蛋白提取率的影响
提取温度对蛋白提取率的影响见图8。
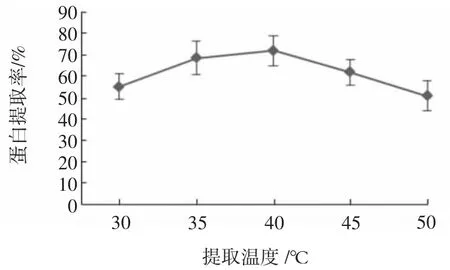
图8 提取温度对蛋白提取率的影响Fig.8 Effect of extraction temperature on protein extraction rate
由图8可知,提取温度对鸡蛋壳膜蛋白提取率的影响显著,当提取温度较低时,由于酶活力不足,提取率也不高。当提取温度升至35℃~40℃时,其提取率接近峰值。提取温度超过40℃以后,胃蛋白酶的活性受到抑制,提取率呈现下降趋势。因此鸡蛋壳膜蛋白二次提取的适宜温度为35℃~40℃。
2.2.4 提取时间对蛋白提取率的影响
提取时间对蛋白提取率的影响见图9。
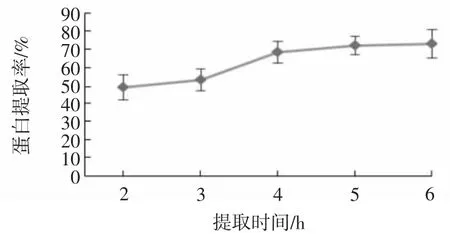
图9 提取时间对蛋白提取率的影响Fig.9 Effect of extraction time on protein extraction rate
由图9可知,随着提取时间的延长,鸡蛋壳膜蛋白的提取率也不断提高,但达到5 h以后,提取率增长趋于平缓。因此本试验选取提取时间为4 h~5 h。
2.2.5 pH值对蛋白提取率的影响
pH值对蛋白提取率的影响见图10。

图10 pH值对蛋白提取率的影响Fig.10 Effect of pH value on protein extraction rate
由图10可知,当溶液的pH值在1.5~2.5之间时,蛋白提取率逐渐升高。pH值在2.5~3.5之间时,提取率有下降趋势,故选取pH值为2.5的乙酸溶液作为本试验的提取剂。
2.2.6 胃蛋白酶提取壳膜蛋白的最佳工艺条件
正交试验结果及各因素对提取条件的方差分析如表5~表6所示。
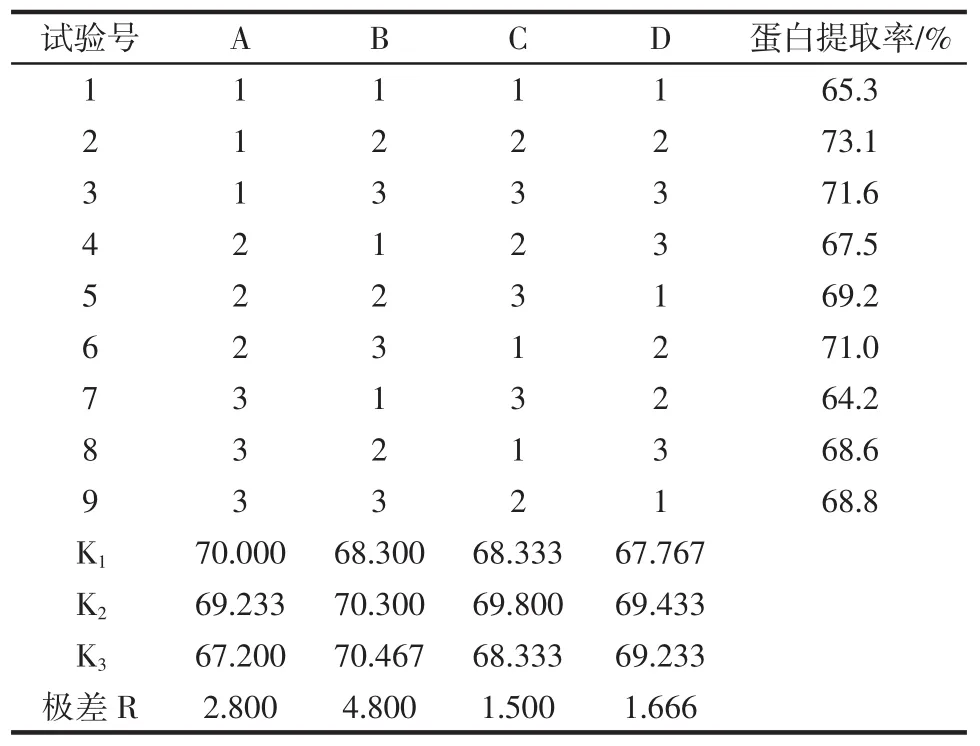
表5 正交试验结果及极差Table 5 Results of orthogonal test and range

表6 方差分析结果Table 6 Analysis of variance
由表5可知,4个因素对蛋白提取率影响的重要性依次为B底物浓度>A酶添加量>D提取时间>C提取温度。由表6可知,4个因素对蛋白提取率均无显著影响。通过对比K值得到各因素最佳水平为A1B3C2D2,即理论优化提取条件为酶添加量800 U/g,底物浓度6%,提取温度为38℃,提取时间5 h。在此条件下蛋白提取率最高为74.2%,高于正交试验中最优工艺A1B2C2D2(73.1%)。
综合一次及二次提取,可使鸡蛋壳膜蛋白的提取率高达91.4%。
3 结论
本研究采用乙酸-酶解联用分段提取技术对废弃鸡蛋壳进行深加工,研究乙酸-胃蛋白酶提取蛋白。结果表明,乙酸提取过程中,最优工艺条件为乙酸浓度1.5 mol/L、提取温度为 70 ℃、液料比为 110∶1(mL/g)、提取时间为4 h。在此条件下蛋白提取率为17.2%。胃蛋白酶提取过程中,最优提取条件为酶添加量800 U/g、底物浓度6%、提取温度为38℃、提取时间5 h。在此条件下蛋白提取率最高为74.2%。综合一次及二次提取,鸡蛋壳膜蛋白的提取率可高达91.4%。
