基于空心二硫化钼纳米球/金纳米花的神经元特异性烯醇化酶光电化学免疫传感器
2021-09-11刘仁喜王炎英黄雅娇李海燕李春涯
刘仁喜, 王炎英, 刘 蔻, 黄雅娇, 李海燕, 李春涯*
(1.中南民族大学化学与材料科学学院,湖北武汉 430074;2.温州医科大学药学院,浙江温州 325035)
光电化学免疫传感器不仅兼具光学测定及电化学传感的优势,还因免疫识别(如抗原抗体反应)而具有高特异性。同时,光电化学免疫传感器以光为激发源,电为输出信号,激励信号与输出信号彻底分离,可有效克服背景信号干扰,显示出超高灵敏度。此外,光电化学免疫传感器还具有高选择性、低背景信号、低成本等优势,已广泛用于肿瘤标志物等生物分子的检测[1 - 3]。
近年来,具有类石墨烯二维纳米结构的过渡金属二硫属化物,因其优良的光电特性而备受关注。MoS2作为过渡金属二硫属化物的典型代表,具有可调的带隙结构,易剥离、易于功能化等特性,已被广泛用于生物分析、光电化学传感器、催化等领域[4 - 6]。目前MoS2的尺寸和形貌对其性能影响很大,纳米片、纳米管、纳米棒、纳米线、纳米花等形貌各异的MoS2纳米材料均已成功制备。纳米MoS2的制备方法层出不穷,常见的有超声剥离和溶剂热法。其中,溶剂热法具有操作简单、结晶度良好、产物形貌可控、分散性好、成本低等优点,是MoS2合成的常见方法[7,8]。然而,相较于纯MoS2,其复合材料往往性能更佳[9]。贵金属纳米颗粒与MoS2组装是较为常见的复合材料制备方式[10,11]。与贵金属纳米金复合,可通过纳米金的优良导电性及表面等离子共振效应,显著增强MoS2的光电转换效率[12 - 14],提升检测灵敏度,拓展其在光电化学传感领域的应用前景。
本文以钼酸铵为钼源,硫脲为硫源,离子液体1-丁基-3-甲基咪唑四氟硼酸盐([BMimBF4])为溶剂和形貌控制剂,采用溶剂热法制备空心MoS2纳米球(MoS2NBs)。以乙二醇为溶剂,三乙醇胺为还原剂,采用水浴法制备金纳米花(AuNFs)。将空心MoS2NBs与AuNFs组装,制备AuNFs/MoS2纳米复合材料。将AuNFs/MoS2纳米复合材料修饰至玻碳电极(GCE,直径3 mm)表面构建光电响应平台,并用以负载神经元特异性烯醇化酶抗体(anti-NSE),制备NSE光电化学免疫传感器用于NSE定量分析,并成功用于临床血样中NSE的测定。
1 实验部分
1.1 仪器与试剂
CHI660E电化学工作站(上海辰华仪器有限公司);6700F场发射扫描电镜(日本,JEOL Ltd);Multilab 2000X-射线光电子能谱(美国,VG);Tecnai G2 20ST透射电子显微镜(捷克,FEI);D8 X射线衍射仪(德国,Bruker公司)。
钼酸铵(阿拉丁);硫脲(上海试剂一厂);1-丁基-3-甲基咪唑四氟硼酸盐([BMimBF4])(上海毕得医药科技有限公司);(NH4)6Mo7O24·4H2O、抗坏血酸、戊二醛溶液(25%)、三乙醇胺、L-组氨酸、葡萄糖、Na2HPO4、KH2PO4、HAuCl4(国药集团化学试剂有限公司);牛血清白蛋白(BSA)(上海普飞生物技术有限公司);神经元特异性烯醇化酶(NSE)、神经元特异性烯醇化酶抗体(anti-NSE)(北京博奥森生物技术有限公司)。其它试剂均为分析纯,实验用水均为超纯水。
1.2 实验条件
1.2.1 空心MoS2NBs将(NH4)6Mo7O24·4H2O(0.5 mmol,618 mg)和硫脲(14.0 mmol,1.0 g)溶于5 mL 超纯水中,超声混匀,再向混合溶液中加入10 mL离子液体[BMimBF4],搅拌30 min,混合均匀后,转移至25 mL高压反应釜的聚四氟乙烯内衬中,密闭后置于180 ℃烘箱中反应18 h,冷却至室温,离心洗涤,固体产物即为空心MoS2NBs,分散于超纯水中备用。
1.2.2 AuNFs制备将20 mL乙二醇置于100 mL圆底烧瓶,放入40 ℃水浴中,随后将200 μL 1%的HAuCO4水溶液加入到20 mL乙二醇中,缓慢搅拌下加入2.5 mol·L-1新制备的三乙醇胺溶液,反应60 min,11 000 r·min-1离心10 min,用超纯水离心洗涤数次,得到AuNFs,分散于超纯水中备用。
1.2.3 AuNFs/MoS2纳米复合材料制备分别将新制备的AuNFs、空心MoS2NBs分散到超纯水中配成1 mL分散液,然后,将二者混合,在300 r·min-1下搅拌10 h,完成自组装过程,在离心作用下,以超纯水洗净,制备出AuNFs/MoS2纳米复合材料,将AuNFs/MoS2纳米复合材料分散到超纯水中备用。
1.2.4 光电化学免疫传感器制备以Al2O3悬浊液抛光处理GCE,并依次在HNO3(1+1)、乙醇和水中超声清洗,室温下晾干。将6 μL AuNFs/MoS2纳米复合溶液滴涂至洁净的GCE表面,室温下晾干,得到AuNFs/MoS2/GCE光电响应界面。随后,在AuNFs/MoS2/GCE表面滴涂6 μL浓度为5 μg·mL-1的anti-NSE溶液,室温晾干后,将其转移到装有戊二醛蒸气的密闭容器中交联2 min,以增强抗体在生物传感界面的稳定性。随后,将生物传感界面在BSA溶液中孵育30 min,以封闭残余的醛基,超纯水洗净,获得光电化学免疫传感器,可表示为anti-NSE(BSA)/AuNFs/MoS2/GCE。
1.2.5 电化学和光电化学测试以LED白光灯(5 W)为激发光源,采用安培技术进行光电化学测量,记录电流-时间(i-t)曲线。使用辐射计(北京师范大学光电仪器厂)检测白光LED灯的光强度,大约为180 mW·cm-2。所有光电化学测量均在磷酸盐缓冲液(PBS,pH=7.0)中进行,以0.1 mol·L-1抗坏血酸为电子供体,工作电极电位设定为0.05 V(vs.SCE)。在5.0 mmol·L-1K3[Fe(CN)6]/K4[Fe(CN)6](1∶1)和0.1 mol·L-1KCl的混合溶液中,采用电化学交流阻抗谱(EIS)表征传感界面的特性,频率控制在0.1 Hz至100 kHz范围内,振幅为5 mV,初始电位为开路电位。对于NSE的测定,先将免疫传感器浸入NSE溶液中,在35 ℃下孵育30 min。随后用PBS洗涤,除去免疫传感器表面物理吸附的NSE。
2 结果与讨论
2.1 材料表征
2.1.1 透射电子显微镜(TEM)表征如图1所示,采用TEM表征MoS2NBs、AuNFs和AuNFs/MoS2纳米复合材料的形貌。从图1a可知,空心MoS2具有球状结构,同时球的中间部位呈空心透明状,表明成功制备空心MoS2NBs。如图1b所示,制备的AuNFs具有均匀的花朵状结构,其直径在105~155 nm范围内。由图1c可知,AuNFs紧密附着在空心MoS2NBs的表面,表明成功将二者复合。AuNFs可提供大的比表面积和更多的活性位点,以固定NSE抗体,从而提高光电免疫传感器的选择性和灵敏度。

图1 空心MoS2NBs(a)、AuNFs(b)和AuNFs/MoS2纳米复合材料(c)的透射电子显微镜(TEM)图Fig.1 TEM images of hollow MoS2 NBs(a),AuNFs(b) and AuNFs/MoS2 nanocomposites(c)
2.1.2 X射线衍射(XRD)表征采用XRD表征AuNFs/MoS2纳米复合材料的晶体结构。在图2a中,AuNFs/MoS2纳米复合材料的衍射峰,分别对应于MoS2晶体的(002)、(100)晶面和AuNFs的(111)、(200)、(220)和(311)晶面,表明成功制备AuNFs/MoS2纳米复合材料。
2.1.3 X射线光电子能谱(XPS)表征采用XPS表征AuNFs/MoS2纳米复合材料的化学组成。如图2b所示,结合能的峰值位于84.58 eV、162.1 eV、230.47 eV、284.83 eV和530.94 eV,分别归因于Au 4f、S 2p、Mo 3d、C 1s和O 1S电子能级,由此可知AuNFs/MoS2纳米复合材料中存在Au、Mo、S元素,表明AuNFs成功组装至空心MoS2NBs表面。
2.1.4 能量色散X射线光谱(EDS)表征以EDS表征材料元素组成。图2c表明空心MoS2NBs由Mo和S两种元素组成,定量计算表明Mo与S的原子比约为2.33∶1,与MoS2的化学计量比接近,表明成功制备空心MoS2NBs。图2d表明AuNFs/MoS2纳米复合材料由Mo、S和Au元素组成,表明成功制备该纳米复合材料。

图2 XRD(a)、XPS(b)表征AuNFs/MoS2纳米复合材料;EDS表征MoS2(c)和AuNFs/MoS2纳米复合材料(d)Fig.2 Characterization of AuNFs/MoS2 nanocomposite with XRD(a) and XPS(b);Characterizations of MoS2(c) and AuNFs/MoS2 nanocomposites(d) with EDS
2.2 光电化学免疫传感器表征
2.2.1 扫描电镜(SEM)表征采用SEM表征传感器制备过程中各界面的表面形貌。由图3a可知,裸露的GCE表面为光滑镜面。图3b为AuNFs/MoS2/GCE界面的形貌图,可以清楚地观察到空心MoS2NBs和AuNFs,AuNFs紧密附着于空心MoS2NBs表面。空心MoS2NBs表面修饰的AuNFs可以提供更多的活性位点以固载anti-NSE,并有助于增加它的固定量,从而提高免疫反应性能。将anti-NSE修饰在AuNFs/MoS2/GCE界面后,传感界面形貌发生了显著变化,其表面变得模糊,表明anti-NSE已成功固载至AuNFs/MoS2/GCE界面(图3c),即成功制备出光电化学免疫传感平台。

图3 GCE(a)、AuNFs/MoS2/GCE(b)和anti-NSE(BSA)/AuNFs/MoS2/GCE(c)的扫描电镜(SEM)图Fig.3 SEM images of a bare GCE(a),AuNFs/MoS2/GCE(b) and anti-NSE(BSA)/AuNFs/MoS2/GCE(c)
2.2.2 传感界面表征图4A为MoS2/GCE(a)和AuNFs/MoS2/GCE(b)的光电流响应曲线,其光电流分别为1.49 μA(a)和12.32 μA (b)。当AuNFs存在时,空心MoS2NBs的光电流响应显著增强,归于AuNFs的等离子体共振效应和优异的电子传输性能。结果表明,AuNFs复合至空心MoS2NBs表面可有效改善其光电流响应性能。电化学交流阻抗谱(EIS)是表征免疫传感器制备过程中各界面特性的典型策略。图4B为K3[Fe(CN)6]/K4[Fe(CN)6]在MoS2/GCE(a)和AuNFs/MoS2/GCE(b)上的Nyquist曲线。Nyquist曲线的半圆形部分对应于扩散控制过程,其直径对应于界面的电荷转移电阻(Rct)。比较图4B中的曲线a、b可知,曲线a的半圆直径明显大于曲线b,表明AuNFs可促进K3[Fe(CN)6]/K4[Fe(CN)6]在电极界面的电荷传输。

图4 MoS2/GCE(a)和AuNFs/MoS2/GCE(b)的光电流响应(A)和Nyquist曲线(B)Fig.4 Photocurrent responses(A) and Nyquist plots(B) of a MoS2/GCE(a) and an AuNFs/MoS2/GCE(b)
图5A为K3[Fe(CN)6]/K4[Fe(CN)6]在GCE(a)、AuNFs/MoS2/GCE(b)、anti-NSE/AuNFs/MoS2/GCE(c)、anti-NSE(BSA)/AuNFs/MoS2/GCE(d)和NSE/anti-NSE(BSA)/AuNFs/MoS2/GCE(e)上的Nyquist曲线。当anti-NSE固定在AuNFs/MoS2/GCE界面上,由于anti-NSE对K3[Fe(CN)6]/K4[Fe(CN)6]探针的电子传输和质量传输的阻滞作用,Rct值急剧增加。随后依次用戊二醛和BSA处理anti-NSE/AuNFs/MoS2/GCE,由于相同原因,Rct值相应增加。用于NSE测定时,将光电化学免疫传感器在0.1 ng·mL-1NSE溶液中孵育30 min,在完成孵育过程后,半圆直径显著增强,表明NSE已被选择性识别至传感界面。
抗坏血酸(0.1 mol·L-1)可与光生空穴发生反应,阻止电子-空穴对重新结合,从而增强光电流响应。在传感器逐步构建过程中,使用计时电流法用于记录光电化学传感界面的光电流。图5B为裸GCE(a)、AuNFs/MoS2/GCE(b)、anti-NSE/AuNFs/MoS2/GCE(c)、anti-NSE(BSA)/AuNFs/MoS2/GCE(d)和NSE/anti-NSE(BSA)/AuNFs/MoS2/GCE(e)的光电流曲线。裸GCE的光电响应非常微弱,其产生的背景干扰可忽略不计。当用AuNFs/MoS2纳米复合材料修饰GCE表面时,光电流明显增加,达到12.32 μA,表明AuNFs/MoS2纳米复合材料可以有效提升光电转换效能。随后,依次考察修饰anti-NSE、以BSA阻断非特异性位点、选择性识别NSE各过程所致界面的光电流响应,发现光电流不断减小。光电流的变化趋势与交流阻抗谱吻合,表明成功组装各传感界面。
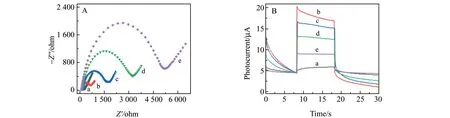
图5 GCE(a)、AuNFs/MoS2/GCE(b)、anti-NSE/AuNFs/MoS2/GCE(c)、anti-NSE(BSA)/AuNFs/MoS2/GCE(d)和NSE/anti-NSE(BSA)/AuNFs/MoS2/GCE(e)在 5.0 mmol·L-1 K3[Fe(CN)6]/K4[Fe(CN)6]溶液中的Nyquist曲线(A)和在白光照射下的光电流曲线(B)Fig.5 Nyquist plots(A) and photocurrent responses(B) of a GCE(a),an AuNFs/MoS2/GCE(b),an anti-NSE/AuNFs/MoS2/GCE(c),an anti-NSE(BSA)/AuNFs/MoS2/GCE(d) and a NSE/anti-NSE(BSA)/AuNFs/MoS2/GCE(e)
2.3 实验条件优化
当被白光照射时,空心MoS2NBs可被激发产生电子-空穴对,光生空穴可被电子给体抗坏血酸捕获,促进电子-空穴对分离,以产生光电流。因此,抗坏血酸是影响AuNFs/MoS2/GCE纳米复合材料光电转换效率的关键因素。从图6a可以看出,光电流响应随着抗坏血酸浓度从0增加到0.1 mol·L-1而相应增加。当抗坏血酸浓度为0.1 mol·L-1时可获得最大光电流。然而,当抗坏血酸浓度高于0.1 mol·L-1时,随抗坏血酸浓度增加,光电流响应逐渐降低。高浓度抗坏血酸可阻止光生电子与电极表面之间的电子转移,从而导致光生电子-空穴对重新组合,致使光电流减小。
在孵育NSE过程中,孵育时间会影响NSE在传感界面的识别量。如图6b所示,在0.1 ng·mL-1NSE溶液中,当孵育时间从15 min增加到30 min时,NSE可通过特异性识别作用结合到传感界面,光电响应差值逐渐增加,30 min时光电响应差值达最大值,30 min后光电响应差值基本保持不变,表明光电化学免疫传感器的抗原抗体特异性识别作用已经达到饱和。因此,最佳的孵育时间为30 min。
在孵育NSE过程中,孵育温度会影响NSE抗体的生物学活性,并进一步影响anti-NSE与NSE间的免疫识别反应。如图6c所示,在0.1 ng·mL-1NSE溶液中,当孵育温度从25 ℃增加到35 ℃时,anti-NSE活性增加,特异性识别作用增强,NSE在传感界面富集量增加,光电响应差值逐渐增加,35 ℃时,光电响应差值达到最大值;当孵育温度超过35 ℃后,anti-NSE的生物活性降低,光电响应差值逐渐减小。因此,最佳孵育温度为35 ℃。
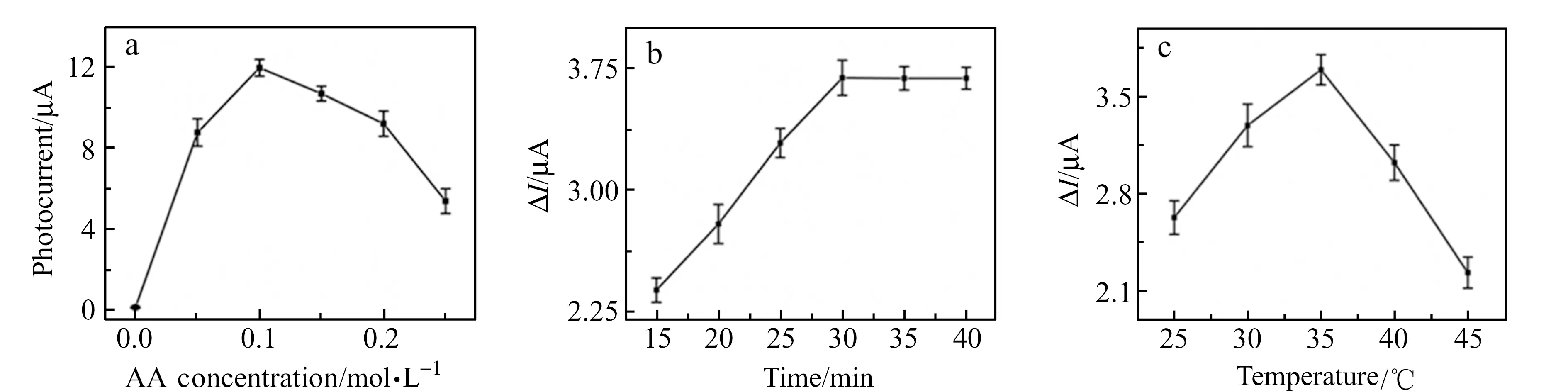
图6 AuNFs/MoS2/GCE的光电流响应与抗坏血酸(AA)浓度(a)及其在0.1 ng·mL-1NSE溶液中的孵育时间(b)和孵育温度(c)之间的关系Fig.6 Dependence of the photocurrent response of an AuNFs/MoS2/GCE on the ascorbic acid concentration(a),and the photocurrent decline of anti-NSE/AuNFs/MoS2/GCE upon interaction with NSE at different incubation time(b) and incubation temperature(c)
2.4 线性范围及检出限
在最优化条件下,光电流随NSE浓度增加成比例降低。光电流变化(ΔI=I0-I,I0和I表示将NSE结合至免疫传感界面之前和之后的光电流响应)与NSE浓度对数(lgc)呈线性相关,线性范围为4.0 pg·mL-1至2.5 ng·mL-1,线性回归方程为:ΔI=0.612lgc+4.06(R2=0.981),检出限(S/N=3)为1.83 pg·mL-1。
2.5 传感器性能测试
以5.0 ng·mL-1抗坏血酸(AA)、人血清白蛋白(HSA)、L-组氨酸(L-His)、心肌肝蛋白(cTnI)和葡萄糖(Glc)作为干扰物,考察光电化学免疫传感器对0.1 ng·mL-1NSE的光电流响应。如图7所示,传感器对NSE及其与干扰物共存时的光电流变化可以忽略,这意味着光电化学免疫传感器对NSE的测定具有较好的选择性。

图7 传感器选择性测试Fig.7 Selectivity of the PEC immunosensor towards NSE
分别制备5支基于anti-NSE(BSA)/AuNFs/MoS2/GCE免疫传感器,在4 ℃下存储19 d,并于存储前、后分别测定0.1 ng·mL-1NSE,用于评估光电化学免疫传感器的稳定性。存储后,测量值可保持初始值的97.33%,表明光电化学免疫传感器在该条件下可保持良好的稳定性。采用独立制备的4支基于anti-NSE(BSA)/AuNFs/MoS2/GCE,测定0.1 ng·L-1NSE的相对标准偏差(RSD)为3.50%,表明该光电化学免疫传感器有良好的制备重现性。
2.6 实际样品检测
为评估该光电化学免疫传感器对NSE测定的准确性,将其用于测定临床血清样品中的NSE,并与临床检测的电化学发光(ECL)免疫法测量结果进行比较。稀释后临床血清样品中NSE浓度测定结果如表1所示。光电化学法和电化学发光法测定结果的相对偏差小于3.88%,表明具有一致性。此外,还采用加标回收实验以分析光电化学免疫传感器的准确性。表2为临床血清样品中NSE的加标回收率,其值介于96.6%至102%之间,表明光电化学免疫传感器具有用于临床检测的潜在价值。

表1 光电化学免疫传感器和ECL法测定临床血清样品中NSE(n=3)Table 1 Determination of NSE in clinical serum samples using the photoelectrochemical immunosensor and ECL immunoassay(n=3)

表2 光电化学免疫传感器测定临床血清样品中NSE的回收率(n=3)Table 2 Recoveries for determining NSE in clinical serum samples using the photoelectrochemical immunosensor(n=3)
3 结论
将AuNFs与空心MoS2NBs复合制备AuNFs/MoS2纳米复合材料,基于AuNFs优异的电子传输性能和表面等离子体共振效应,提升半导体空心MoS2NBs的光电转换效率,并将AuNFs/MoS2纳米复合材料作为光电活性材料,固载神经元特异性烯醇化酶抗体(anti-NSE),构建NSE光电化学免疫传感器,实现NSE的高效检测。将该光电化学免疫传感器用于临床血样中NSE检测,与电化学发光法检测结果一致,表明该传感器在临床检测上具有潜在应用价值。
