山楂多糖提取工艺优化及其抗氧化活性研究
2021-09-10张全才田文妮罗志锋陈海平黎攀杜冰李德灵
张全才 田文妮 罗志锋 陈海平 黎攀 杜冰 李德灵







摘 要:目的:优化热水浸提法提取山楂多糖的最佳工艺条件,并研究其结构和体外抗氧化活性。方法:在单因素试验的基础上,以水浴温度、水浴时间、料水比、冷浸时间为因素,通过正交试验设计优化其提取工艺;多糖经纯化后分别采用GPC、GC-MS分析其分子量和单糖组成,并通过对超氧自由、羟自由基、DPPH(1,1-二苯基-2-三硝基苯肼)自由基清除试验测定山楂多糖的抗氧化活性。结果:最佳提取条件为浸提温度90 ℃、浸提时间6 h、料水比1∶20、冷浸时间为13 h,此条件下提取的多糖经过纯化后,其分子量为5.59×104 Da,单糖含量比例(阿拉伯糖∶木糖∶甘露糖∶葡萄糖∶半乳糖)为1∶1∶28∶8∶12。经测定,多糖具有一定的超氧自由基、羟自由基、DPPH自由基体外清除能力,在0.5~2.5 mg/mL的浓度范围内,清除率分别为12.3%~37.9%、12.3%~40.9%、15.3%~42.6%,说明抗氧化活性较好。结论:本研究可为山楂资源的开发利用和山楂多糖的药理研究提供科学依据。
关键词:山楂多糖;提取;单糖组分;抗氧化
山楂属植物分布于北温带[1],山楂树作为经济林遍布中国25个省、市、自治区,被列为主要树种之一。山楂是一种药食同源的水果[2],营养丰富[3],具有促消化、抗氧化、降血压等药理作用[4-7],是一种值得开发利用的植物资源[8]。目前,关于山楂的化学成分研究较多集中于黄酮类物质、蛋白质、维生素、鞣质等[9],但山楂中具有多种生物活性的山楂多糖卻被研究得较少,有研究采用水提醇沉法、超声波提取法和微波提取法3种方法提取山楂中的多糖成分,初步确定多糖结构是β型吡喃糖苷键构型[10]。还有研究表明,山楂多糖促进淋巴细胞转化从而对免疫力有提升作用[11]。但是对于山楂多糖单一成分的提取及其抗氧化性的研究报道在国内外仍较少,同时多糖的生物活性与其分子量和组成有密切关系。本文对山楂多糖的抗氧化活性、分子量、单糖组分以及利用水提醇沉法提取山楂多糖的最佳工艺条件进行了相关研究,为山楂资源的开发利用和山楂多糖的药理研究提供科学依据。
1 材料与方法
1.1 材料与试剂
大果山楂,由无限极(有限)公司提供,购自广东省信宜市大成填批发市场;水为纯化水;无水葡萄糖、浓硫酸、苯酚、95%乙醇、无水乙醇、盐酸、EDTA、维生素C,以上均为分析纯。
1.2 仪器与设备
752-N紫外分光光度计,上海精密仪器有限公司;气相色谱仪(Agilent Technologies6890N,检测器:FID)、色谱柱(Agilent19091N-113 HP-INNOWax Polyethylene Glycol,30.0 m×320 μm×0.25 μm),美国安捷伦公司;透析袋,BIOSHARP,截留分子量为7 000~14 000;SH 2-88台式水浴恒温器,江苏太仓市试验设备厂;型号为FA2004A的万分之一电子分析天平,上海精天电子仪器厂。
1.3 方法
1.3.1 多糖提取单因素试验 按“1.3.1”进行操作,分别考察不同料水比(1∶10、1∶15、1∶20、1∶25、1∶30)、提取温度(60、70、80、90、100 ℃)、提取时间(2、3、4、5、6 h)、冷浸时间(10、11、12、13、14 h)对山楂多糖得率的影响,其中各因素的固定水平为料水比为1∶20、提取温度为80 ℃、提取时间为4 h、冷浸时间为12 h。
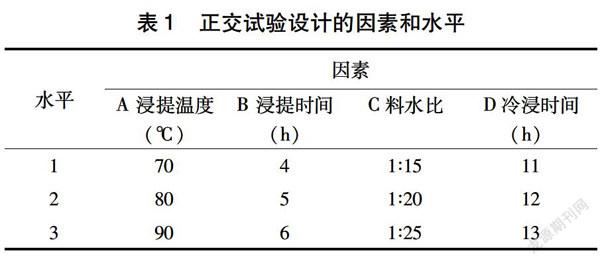
1.3.2 正交试验优化 根据单因素试验结果,各因素选取影响显著的3个水平,采用L9(34)正交表,各组试验平行3次,取山楂多糖得率平均值进行极差分析(表1)。
1.3.3 山楂多糖的提取 称取5.0 g山楂粉末,溶于蒸馏水中,在选定的温度、时间和料水比条件下水浴提取,过滤取滤液,55 ℃真空旋转浓缩,浓缩液加入4倍体积的无水乙醇在4 ℃下进行醇沉一定时间,离心,收集多糖沉淀,沉淀复溶于水,重复醇沉1次,沉淀依次用无水乙醇、丙醇反复洗涤3次,冷冻干燥后得到山楂粗多糖。
1.3.4 山楂多糖的分离 称量1.0 g山楂粗多糖于1 000 mL容量瓶中,加蒸馏水定容至刻度。利用Sevage法脱蛋白透析48 h,依次经浓缩、醇沉、洗涤,真空干燥得到多糖样品[12]。
1.3.5 多糖含量的测定与计算 本研究采用苯酚-硫酸法对山楂多糖含量进行测定[13]。
1.3.6 多糖的单糖组分分析 (1)多糖的水解:准确称量山楂多糖样品20 mg,加入2 mL 2 mol/L的硫酸溶液,于沸水浴中水解2 h,取出冷却后,加入5%碳酸钡中和至中性,置于10 mL容量瓶中定容,再300 r/min离心5 min,上清液用氮气吹干,得到单糖置于干燥器中保存备用[14-15]。(2)多糖及样品单糖的衍生化:具体的衍生化试验操作可参照[16]进行,盐酸羟胺、吡啶和醋酸酐加入量分别为11 mg、0.5 mL、1 mL,90 ℃水浴反应40 min,得到的产物减压蒸干,用1 mL氯仿溶解,进样做GC分析。GC分析条件:①载气:高纯氮,氢气流量50.0 mL/min、空气流量400 mL/min、氮气吹尾流量20.0 mL/min、恒定压力8.79 psi、平均线速度34 cm/s;②气化室温度:240 ℃;③检测器温度:260 ℃;④程序升温:140 ℃维持3 min,以10 ℃/min升至220 ℃,保持3 min,再以10 ℃/min升至240 ℃,保持3 min。分流比:20∶1,进样量:1 μL。
1.3.7 山楂多糖体外抗氧化活性测定[17-19]
(1)多糖清除DPPH自由基能力测定:精确称取山楂多糖,将其配置呈浓度为10 mg/mL的样品储备液,分别稀释成浓度分别为0.5、1.0、1.5、2.0、2.5 mg/mL的溶液。再精确称取抗坏血酸定容,制成浓度为10 mg/mL 维生素C溶液并分别稀释成浓度为0.5、1.0、1.5、2.0、2.5 mg/mL作参比。分别准确称量不同浓度的山楂多糖溶液、抗坏血酸溶液各2 mL分别与2 mL提前配制的DPPH溶液(0.004 0 g DPPH,甲醇定容至100 mL,4 ℃冰箱避光放置)混合,摇匀后放置30 min,以相对应的溶剂为对照,用紫外可见分光光度计分别测定上述溶液在波长为517 nm处的吸光度(AI)。2.0 mL不同浓度的样品溶液与2.0 mL甲醇混合液测定样品本底吸光度,2.0 mL DPPH与2 mL甲醇混合液测定对参比溶液吸光度。山楂多糖、抗坏血酸的抑制率计算公式为式(1):
DPPH自由基清除率=(1-Ax-Ax0A0)×100%(1)
式(1)中,Ax——不同浓度溶液吸光度、Ax0——样品本底吸光度、A0——参比溶液吸光度。
(2)多糖清除羟自由基能力测定:分别加入1.0 mL 9 mmol/L的FeSO4溶液、1.0 mL 9 mmol/L的水杨酸-乙醇溶液和不同浓度的样品溶液于试管中,然后加入1.0 mL 8 mmol/L的过氧化氢溶液。迅速置于水浴锅中水浴30 min,水浴温度为37 ℃,用紫外可见分光光度计分别测定不同浓度的溶液在波长为510 nm处的吸光度。用蒸馏水代替H2O2测得对应质量浓度样品溶液的本底吸光度值,用蒸馏水代替样品溶液测得对照吸光度值。羟自由基清除率计算公式如式(2):
羟自由基清除率=(1-Ax-Ax0A0)×100%(2)
式(2)中,Ax——不同浓度溶液吸光度、Ax0——样品本底吸光度、A0——参比溶液吸光度。
(3)多糖清除超氧自由基能力测定:先加入0.01 mol/L Tris-HCI(pH 8.20,内含1 mmol/L EDTA)缓冲液和二次蒸馏水,于25 ℃恒温20 min后加入25 ℃预热过的邻苯三酚溶液(3 mmol/L邻苯三酚于10 mmol/L HCI中),迅速摇匀,立即倾入光径1 cm 比色杯中,在波长325 nm处每0.5 min測定1次吸光值A325 nm,自氧化速率控制在0.06 min左右,测定3.5 min。在上述Tris-HCI缓冲液中预先加入一定量的维生素C溶液,再按式(3)计算邻苯三酚的自氧化速率,表示为每分钟光密度变化值。
超氧自由基清除率=(A0-AA0)×100%(3)
式(3)中,A0——空白溶液光密度变化速率、A——样品溶液光密度变化速率。
2 结果与分析
2.1 单因素对山楂多糖得率的影响
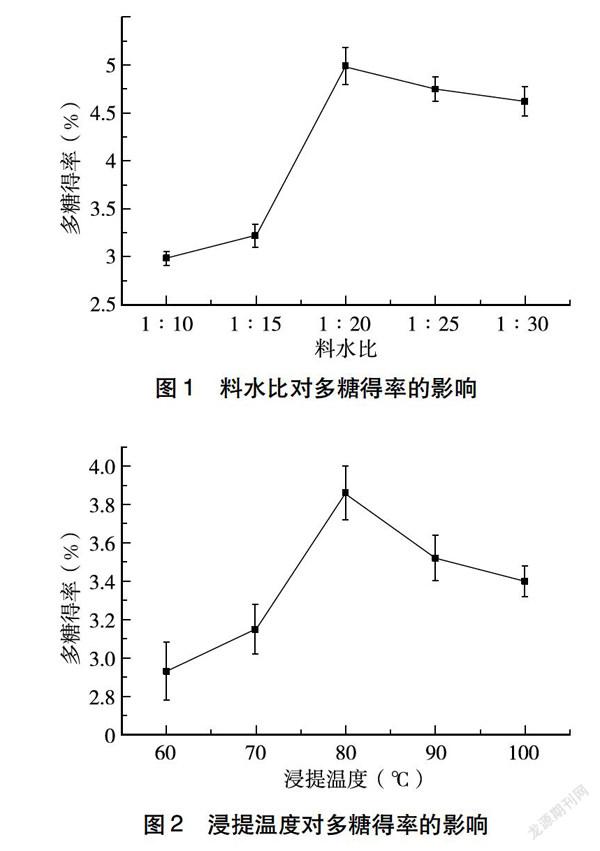
2.1.1 料水比对山楂多糖得率的影响 由图1可知,当料水比从1∶10增大到1∶30,山楂多糖得率先升高后下降,当料水比为1∶20时,山楂的多糖得率最高,为5.02%,可推测水用量的增加促进了传质过程的进行,从而增加多糖的溶出率,而过高的料水比可能会导致其他杂质的溶出从而抑制多糖的溶出[20]。
2.1.2 浸提温度对山楂多糖得率的影响 由图2可知,山楂多糖得率随着浸提温度的增大呈现先升高后降低的趋势,当浸提温度比为80 ℃时,山楂的多糖得率最高,为3.86%,可见温度的升高会促进多糖的溶出,但过高的温度可能会破坏多糖的结构使其降解。
2.1.3 浸提时间对山楂多糖得率的影响 由图3可知,随着时间的增长,多糖的得率呈上升的趋势,当浸提时间为5 h时,山楂的多糖得率最高,为3.91%,此时再延长时间多糖得率稍微下降,因此浸提时间过程可能不利于多糖的溶出。
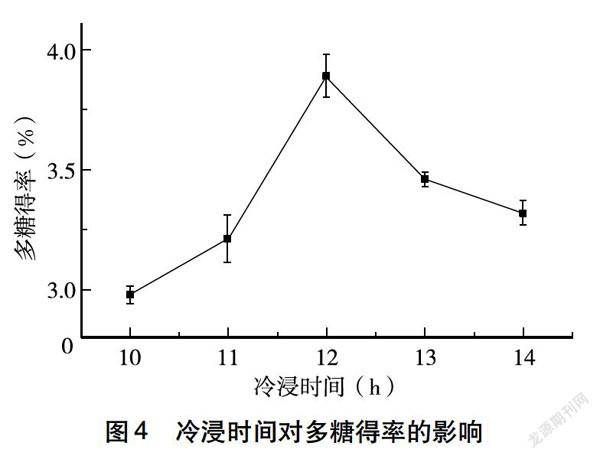
2.1.4 冷浸时间对山楂多糖得率的影响 由图4可知,当冷浸时间从10 h增大到14 h,山楂多糖得率先升高后下降,当冷浸时间为12 h时,山楂的多糖得率最高,为3.78%,可能时间过长时多糖会重新溶解于水中,因此选择合适的时间不仅可以提高多糖的得率,还能缩短工业生产周期,提高提取效率。
2.2 多糖提取的正交设计优化试验
在单因素试验的基础上,选取各因素的3个显著水平进行正交试验设计。比较表2的极差大小可知,在选择的4个因素中,对于多糖得率的影响大小,山楂的水浴温度>水浴时间>浸泡时间>料液比,即各因素影响山楂多糖得率的主次顺序为:A>B>D>C 。对此次正交试验结果进行直观分析,得到优化组合为A3B3C2D3。从表2可以看出,山楂的提取水浴温度为本试验的显著性因素,说明在试验过程中此因素对试验起主导因素,因此,山楂多糖提取优化试验的优化工艺条件是浸提温度90 ℃、浸提时间6 h、料水比1∶20、冷浸时间为13 h。
2.3 稳定性及验证试验
采用浸提温度90 ℃、浸提时间6 h、料水比1∶20、冷浸时间为13 h的条件进行验证试验。由表3可知,在最佳工艺条件A3B3C2D3下,山楂多糖的提取率为8.45%±0.04%,3次试验的数据较为稳定,说明提取工艺可靠,有利于提高多糖的提取效率。
2.4 山楂多糖的分子量测定及其单糖组分分析
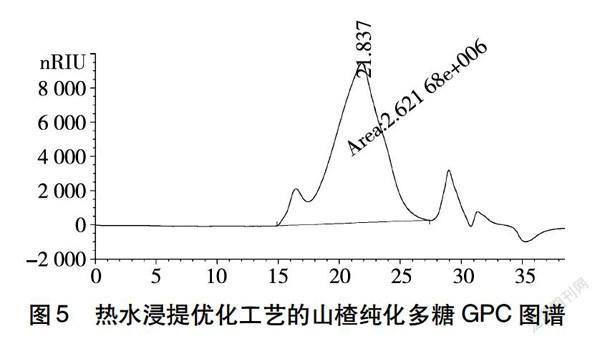
利用经过正交试验优化后的工艺对山楂多糖进行提取,再利用Sevage法脱蛋白透析48 h,依次经浓缩、醇沉、洗涤,真空干燥得到多糖样品,用凝胶渗透色谱(GPC)对其分子量进行测定。结果如图5所示,测得其分子量为5.59×104 Da。
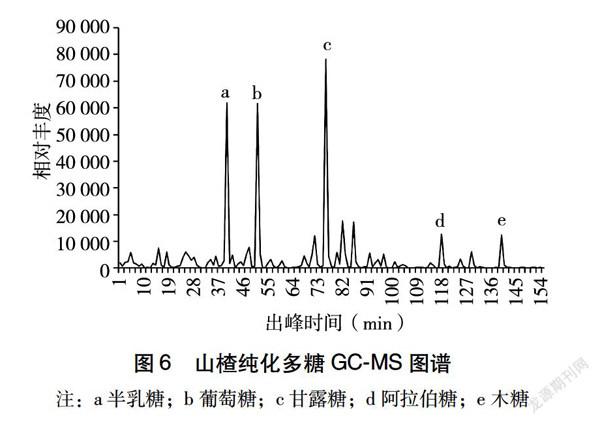
如图6所示,可以通过各色谱峰与标准样品的保留时间进行对比,从而得出样品山楂多糖中的多糖组成。而组成多糖的各个单糖组分的含量可通过面积归一法进行计算,单糖的质量分数结果见表4。通过与标准品的色谱峰进行对比,可以得知山楂纯化多糖的图谱中出现了阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖这5个吸收峰,说明山楂多糖由这5种单糖组成。同时用面积归一化法对其进行定量分析,这5种单糖的成分含量分别为阿拉伯糖2.00%、木糖2.01%、甘露糖56.50%、葡萄糖16.10%和半乳糖23.40%。
2.5 山楂多糖的体外抗氧化性
2.5.1 山楂多糖对超氧自由基的清除作用 由图7可知,浓度为0.5~2.5 mg/mL的山楂多糖随着浓度的上升,其对超氧自由基的清除率也随着增大,清除率为12.3%~37.9%。而维生素C对于超氧自由基的清除率随着浓度的增大而上升,在2.5 mg/mL时达到最大,其清除率为25.8%~90.6%。因此说明山楂多糖具有一定的超氧自由基清除活性,但弱于维生素C。
2.5.2 山楂多糖对羟自由基的清除作用 由图8可知,浓度为0.5~2.5 mg/mL的山楂多糖、维生素C溶液随着浓度的上升,它们对羟自由基的清除率也随着增大,清除率分别为12.3%~40.9%、16.3%~42.9%,山楂多糖对羟自由基清除率与维生素C的比较接近;以上结果说明,山楂多糖具有较好的羟自由基清除活性。
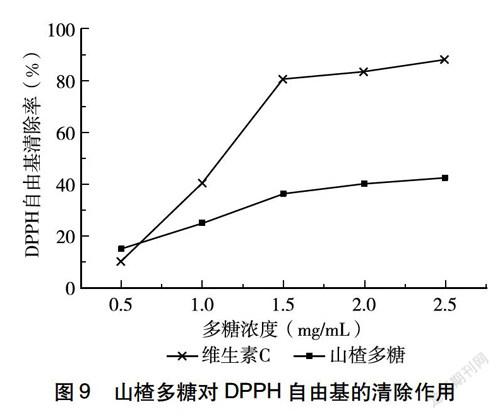
2.5.3 山楂多糖对DPPH自由基的清除作用 由图9可知,山楂多糖和维生素C的DPPH自由基清除活性都随着浓度的增大而增大,在0.5~2.5 mg/mL的浓度范围内,二者的清除率分别为15.3%~42.6%和10.3%~88%,在0.5 mg/mL浓度处山楂多糖的清除能力稍强于维生素C,但从整体来看维生素C的DPPH清除能力要强于山楂多糖。以上结果说明,山楂多糖具有一定的DPPH自由基清除能力。
3 讨论
本研究以单因素试验为基础,利用正交试验设计优化水提醇沉法提取山楂多糖的工艺。结果发现,水浴温度和水浴时间对于山楂多糖的提取效果的影响最为显著,其次是冷浸时间和料水比。同时得出最佳的提取工艺条件为浸提温度90 ℃、浸提时间6 h、料水比1∶20、冷浸时间为13 h,并经验证试验可得最优提取工艺下得率为8.45%±0.04%。高铎迅等[21]利用正交试验优化山楂多糖提取条件,最佳提取率为1.52%,而本研究通过将冷浸和水浴浸提法相结合,并且优化提取步骤,提升提取率达到8.45%,说明进一步优化了山楂多糖的提取条件,有利于对山楂多糖的开发。本研究还利用HPGFC方法测定了山楂纯化多糖的分子量和单糖组成,结果确定了其分子量为5.59×104 Da,并且参照了各单糖标准品,得出其单糖成分主要是多糖的图谱中出现了阿拉伯糖、木糖、甘露糖、葡萄糖和半乳糖,经过计算各单糖的相对含量分别为2%、2.01%、56.5%、16.1%和23.4%。与其他研究测定山楂多糖的单糖组成相比[22],检测出了含量较高的甘露糖,但阿拉伯糖、木糖和甘露糖相对较低,也没有检测出核糖、鼠李糖和果糖。
超氧自由基、羟自由基和DPPH自由基会产生引起细胞功能衰退、致癌和DNA损伤的活性氧,对生命有机体产生重大的影响[23]。有研究指出,山楂粗黄酮对DPPH具有一定的清除能力,对细菌也有较强的抑制作用[24]。还有研究证明,山楂果实中的原花青素具有清除自由基和抑制脂质过氧化的能力,具有和黄酮不完全相同的生理活性,尤其是抗氧化活性明显强于黄酮[25-26]。山楂多糖具有抗疲劳、增强免疫力以及调血脂等药理作用,尤其是山楂多糖的抗氧化能力与其抗衰老等功能有密切关联。本研究发现,山楂多糖对超氧自由基、羟自由基和DPPH自由基均具有一定的清除能力,并且抗自由基活性随着浓度的增大而增大。虽然对3种自由基的清除活性均低于维生素C,其中山楂多糖对于羟自由基的清除能力与维生素C最接近,但与同浓度的鹿茸多糖相比,山楂多糖对于3种自由基清除能力明显强于鹿茸多糖[27],有研究表明,鹿茸多糖具有较强的自由基清除能力且能够起到抗肿瘤作用,说明山楂多糖具备抗氧化、抗肿瘤的功效[28]。有研究发现,具有高摩尔比例甘露糖的多糖很容易通过模式识别受体加以区分,从而有助于增强免疫调节[29]。另外,甘露糖具有抗氧化作用,可作为潜在的天然抗氧化剂来源[30-31]。因此山楂多糖中较高的甘露糖比例可能是其具有较好的抗氧化活性的原因,但具体的机制仍需要进一步的探究。通过以上的研究,可以更好地对山楂多糖进行开发利用,为其创新研发提供科学依据。
参考文献
[1]俞德浚,陆玲娣,谷粹芝,等.中国植物志[M].1987:36、37、38卷.
[2]王坦,苗明三,苗艳艳.山楂的现代研究特点分析[J].中医学报,2015(5):708-710.
[3]Janene M Rigelsky,Burgunda V Sweet.Hawthorn:pharmacology and therapeutic uses[J].American Journal of Health-system Pharmacy:AJHP:Official Journal of the American Society of Health-System Pharmacists,2002,59(5):417-422.
[4]余家桓,陳文发,李文福等.山楂精降脂片对心血管功能改变的分析[J].海峡药学,1995(2):38-39.
[5]刘作屏,郭法长.山楂提取物对人胚肺2BS细胞及有关癌细胞的抑制作用[J].河南肿瘤学杂志,1994(3):173-174.
[6]尹卫靖,郭希让.复方山楂饮对毒性视网膜损害保护作用的实验研究[J].河南医学研究,1996(4):302-305.
[7]D A Rakotoarison,B Gressier,F Trotinet al.Antioxidant activities of polyphenolic extracts from flowers,in vitro callus and cell suspension cultures of Crataegus monogyna[J].Die Pharmazie,1997,52(1):60.
[8]Yuki Masuda,Koichi Ito,Morichika Konishi et al.A polysaccharide extracted from Grifola frondosa enhances the anti-tumor activity of bone marrow-derived dendritic cell-based immunotherapy against murine colon cancer[J].Cancer Immunol Immunother,2010,59(10):1531-1541.
[9]谢玉如,戴伦凯,郭梦如,等.山里红的成分分析及国产山楂属植物果实的比较[J].Journal of Integrative Plant Biology,1981(5):47-52.
[10]黄瑶,梁俊慧,李颖,等.大果山楂多糖的分离纯化与结构的初步分析[J].现代食品,2017(19):93-97.
[11]闫启光.山楂多糖对小鼠免疫功能的影响[J].中国中医药咨讯,2009(6):134.
[12]Tong Liu.Immunopontentiating and antitumor activities of a polysaccharide from Pulsatilla chinensis(Bunge)Regel[J].International Journal of Biological Macromolecules,2013,54(3):225-229.
[13]李艳红,林勤保,罗莹.山楂多糖提取的研究[J].农产品加工(学刊),2006(5):43-46.
[14]Weifang Yang,Ying Wang,Xiuping Li et al.Purification and structural characterization of Chinese yam polysaccharide and its activities[J].Carbohydrate Polymers,2015,117(5):1021-1027.
[15]Xuejing Jia,Zhang Chao,Jianfeng Qiu et al.Purification,structural characterization and anticancer activity of the novel polysaccharides from Rhynchosia minima root[J].Carbohydrate Polymers,2015,132:67-71.
[16]張艳萍,俞远志,张虹.气相色谱分析生地黄多糖的单糖组成及其含量[J].中国中药杂志,2009,34(4):419.
[17]郑朋朋,李珊,戚丽蓉,等.山楂多糖的提取及其抗氧化性作用[J].中国酿造,2015,34(6):107-113.
[18]苏文涛,皮宁宁,苏东海,等.紫茎泽兰多糖提取优化及抗氧化活性研究[J].四川大学学报(自然科学版),2009,46(3):814-818.
[19]严成,严夏.枸杞多糖提取工艺比较及体外抗氧化性研究[J].食品科学,2008,29(7):183-187.
[20]张聪颖.地鳖虫多糖提取工艺的优化研究[J].安徽农业科学,2012,40(28):13978-13979.
[21]高铎迅,韩秋菊,马宏飞.正交试验优化山楂多糖提取工艺[J].食品与发酵科技,2013(2):59-60.
[22]邓旭坤,江善青,穆俊,等.山楂多糖的成分测定及其单糖组分分析研究[J].中南民族大学学报(自然科学版),2017,36(3):52-56.
[23]J L Marx.Oxygen free radicals linked to many diseases[J].Science,1987,235(4788):529-531
[24]袁永成.山楂粗黄酮抗氧化能力及抑菌活性研究[J].农产品加工(学刊),2012,2012(2):53-56.
[25]Soon Hoe Kim,Keon Wook Kang,Kye Won Kim et al. Procyanidins in crataegus extract evoke endothelium-dependent vasorelaxation in rat aorta[J].Life Sciences,2000,67(2):121-131.
[26]金宁,刘通讯.山楂原花青素的抗氧化活性研究[J].食品与发酵工业,2007,33(1):45-47.
[27]赵玉红,金秀明,韩睿.鹿茸多糖分离纯化及抗氧化活性研究[J].食品工业科技,2012,33(12):155-158.
[28]张传奇,郑毅男,张成中,等.鹿茸多糖的研究概况[J].经济动物学报,2013,17(1):45-48.
[29]Hui Chen,Mingchao Yan,Jinwei Zhu,et al.Enhancement of exo-polysaccharide production and antioxidant activity in submerged cultures of Inonotus obliquus by lignocellulose decomposition[J].Journal of Industrial Microbiology & Biotechnology,2011,38(2):291-298.
[30]朱秀珍,尹楠,谭志诚,等.核糖和甘露糖的低温热容[A].中国化学会第五届全国热分析动力学与热动力学学术会议论文摘要集,2015.
[31]李哲丽.甘露糖对重症急性胰腺炎大鼠肠粘膜免疫屏障的影响[D].石家庄:河北医科大学,2013.
Optimization on Extraction Process and Antioxidant Activity of Hawthorn Polysaccharides
ZHANG Quan-cai1,TIAN Wen-ni2,LUO Zhi-feng2,CHEN Hai-ping1,LI Pan2,DU Bing2,LI De-ling1
(1Infinitus(China)Company Ltd.,Guangzhou 510623,China;2College of Food Science,South China Agricultural University,Guangzhou 510642,China)
Abstract:【Objective】 To study the optimum process conditions for extraction of polysaccharides from hawthorn by hot water extraction,and study its structure and antioxidant activity in vitro.【Method】 On the basis of single factor experiment,the extraction process was optimized by orthogonal experiment design with water extraction temperature,water extraction time,feed water ratio and cold immersion time.After purification,the polysaccharides were analyzed by GPC and GC-MS for molecular weight and monosaccharide composition.The antioxidant activity of HP was determined by superoxide free radical,hydroxyl radical,DPPH free radical scavenging test.【Result】 The optimum extraction conditions were extraction temperature 90 ℃,extraction time 6 h,ratio of material to water 1∶20,cold soaking time 13 h.After purification of the polysaccharide extracted under this condition,the molecular weight was 5.59×104 Da.The ratio of monosaccharide content(arabinose∶xylose∶mannose∶glucose∶galactose)was 1∶1∶28∶8∶12,and the polysaccharide had certain ability to remove superoxide radical,hydroxyl radical and DPPH free radical in vitro,indicating better antioxidant activity.【Conclusion】 The research can afford scientific foundation for the development and utilization of hawthorn resources and the pharmacological research on hawthorn polysaccharides.
Keywords:hawthorn polysaccharides(HP);extraction;monosaccharide component;antioxidant
作者簡介:张全才(1983— ),男,硕士,研究方向:中草药提取工艺。
通信作者:李德灵(1974— ),男,高级工程师,研究方向:中草药原料开发利用。
