IVF-ET采用短效长方案治疗发生OHSS的不孕症患者基础状态下的相关因素分析
2021-09-10滕敏曾妮覃捷万里凯黄泰帅
滕敏 曾妮 覃捷 万里凯 黄泰帅

【摘要】目的:探讨在体外受精-胚胎移植(IVF-ET)人类辅助生育中采用短效长方案治疗发生卵巢过度刺激综合征(OHSS)患者基础状态下的相关因素。方法回顾性分析2015~2020年在我院生殖中心行IVF-ET治疗中采用短效长方法超控制性促排卵的3887例不孕症患者进入周期前的一般臨床资料,如年龄、身高、体重、基础性激素、抗穆勒氏抗体(AMH)、窦卵泡数(AFC)等指标,按治疗后是否发生OHSS分为OHSS组(实验组)38例,未发生OHSS组(对照组)3849例,比较两组间上述指标的差异性。结果 实验组年龄小于对照组,AFC、AMH大于对照组,差异有统计学意义(P<0.05);身高、体重、BMI、基础性激素指标差异无统计学意义(P>0.05)。结论IVF-ET中采用短效长方案患者发生OHSS基础状态下的因素主要与年龄偏低、高AMH、AFC数量多有关,在进入周期治疗前要密切关注上述指标,以预防OHSS的发生。
【关键词】卵巢过度刺激综合征;体外受精-胚胎移植;短效长方案;基础状态;相关因素
【中图分类号】R71 【文献标识码】A 【文章编号】2026-5328(2021)05-004-03
【ABSTRACT】Objective To investigate the related factors with basal station of ovarian hyperstimulation syndrome (OHSS) in patients with short acting long protocol inIn Vitro Fertilization and EmbryoTransfer(IVF-ET).MethodsThe general clinical data,such as age,height,weight,basic sex hormones,Anti-Mullerian hormone(AMH), antralfollicle aount (AFC) and other indicatorsbefore entering the cycleof 3887 infertile patients who underwent controlled ovarian hyperstimulationwith short acting long protocol in the reproductive center of our hospital were retrospectively analyzed in 2015 to 2020.According to the occurrence of OHSS after IVF-ET treatment,38 patients were divided into the OHSS group (experimental group) and 3849 patients in the non-OHSS group (control group).The differences of the above indicators between the two groups were compared. Results The age was yonger in the experimental group than those of the control group, AFC and AMH of the experimental group were higher than those of the control group, and the difference was statistically significant (P<0.05). There were no significant differences in the indicators of height,weight,BodyMassIndex(BMI) and basic sex hormone (P>0.05).ConclusionThe factors for the occurrence of OHSS in patients with short acting long protocol in the basal state are mainly related to low age, high AMH and large number of AFC. The above indicators should be closely paid attention to before entering the cycle treatment of IVF-ET to prevent the occurrence of OHSS.
【Keywords】Ovarian hyperstimulation syndrome,IVF-ET,short acting long protocol,basal station,Related factors
卵巢过度刺激综合征(ovarian hyperstimulation syndrome, OHSS)是体外受精-胚胎移植(In Vitro Fertilization and EmbryoTransfer,IVF-ET)中卵巢刺激的严重医源性并发症,与不孕症治疗中药物促排卵治疗相关,是一种卵巢明显增大、性激素浓度较高、血管外渗出物积聚的综合征[1]。在IVF-ET中,轻度OHSS发生率在20%-30%左右,中重度OHSS的发生率则为2-3%[2]。国内外研究发现,OHSS的发生与年龄、体质指数(BodyMassIndex,BMI)、抗穆勒氏抗体(Anti-Mullerian hormone,AMH),窦卵泡数(antralfollicle aount,AFC)等指标相关[3-5]。目前,在刺激周期开始前预测患者OHSS风险,指导临床选择合理促排方案,使患者在安全、稳定的环境中获得满意的助孕结局是临床关注所在。在 IVF-ET 的控制性超促排卵(COH)治疗过程中,对于卵巢储备功能良好的患者,黄体期短效长方案被认为是 IVF COH 的“金标准”方案[6]。因此,本研究拟通过对IVF-ET过程中使用短效长方案中发生OHSS组与未发生OHSS组患者的基础状态下的相关指标进行对比分析,旨在探讨IVF-ET中采用短效长方案COH患者发生OHSS的基础状态下的相关因素。
1资料与方法
1.1一般临床资料及分组回顾性分析2015至2020年在我院生殖中心采用短效长方案行IVF-ET助孕的3887例患者一般临床资料,包括年龄、身高、体重、BMI等,按是否发生OHSS 分为两组:OHSS组(以下称实验组)及非OHSS组(以下称对照组)。
1.2纳入标准:采用短效长方案行IVF-ET助孕。排除标准:排除卵巢低储备、卵巢低反应患者。
1.3治疗方案采用黄体期短效长方案:(1)月经规律者于月经周期黄体中期开始皮下注射短效GnRH-a 0.1mg/d 进行降调节;月经不规律者,于月经周期2-5 天开始用口服短效避孕药,连用21天,服药的第17-18天予降调。(2)降调时间一般约14-18天。(3)降调节标准:雌二醇(Estradiol,E2)<50ng/L,卵泡刺激素(FollicleStimulatingHormone,FSH)<5 IU/L,黄体生成素(LuteinzingHormone,LH)<5 IU/L,子宫内膜厚度<5mm,无功能性囊肿;(4)达到降调标准后给予促性腺激素(Gonadotropin,Gn)112.5—300U启动;Gn后4-6 天后开始首次监测,并根据卵泡生长情况调整Gn剂量;(5) 当超声显示2个主导卵泡直径达到18 mm以上,或3个主导卵泡直径达17mm时,注射绒毛膜促性腺激素(human chorionic gonadotrophin,HCG),36~38 h 后取卵。
1.4实验室检测项目及方法:患者于降调前1至2个月的月经周期第 2-4 天空腹抽取少量静脉血,使用罗氏cobas e 801电化学发光法分析仪检测人绒毛膜促性腺激素(HumanChorionicGonadotropin,hCG)、AMH、基础性激素包括FSH、LH、E2、泌乳素(Prolactin,PRL)、孕酮(Progesterone,P)、睾酮(Testosterone,T)。
1.5窦卵泡计数方法采用迈瑞DC-N6彩色超声诊断仪进行检测,检测时间为降调前1~2个月的月经期第 2-4 天进行检查。检查前嘱患者排空膀胱与直肠,取截石位暴露外阴进行检查,探头频率6.5-9.0MHz,探头涂抹少量耦合剂后套避孕套,缓慢置入阴道内旋转探头对子宫及附件进行多切面扫查,连续纵切及横切扫查完整卵巢并记录每侧卵巢中所有直径为2~9 mm的卵泡数量。
1.6统计学处理采用 SPSS23.0 软件进行统计学分析。计量资料以均数±标准差()表示;组间比较采用独立样本 t/t’ 检验;以 P<0.05 为差异有统计学意义。
2 结果
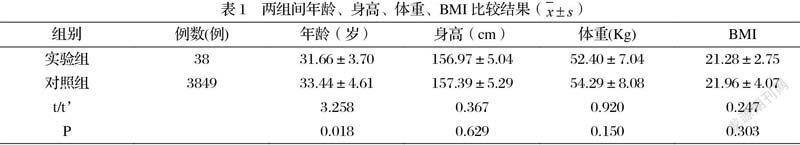
2.1一般臨床基线资料比较结果 实验组年龄小于对照组,差异有统计学意义(P<0.05);身高、体重、BMI两组间差异无明显统计学意义(p>0.05),具体数值详见表1。
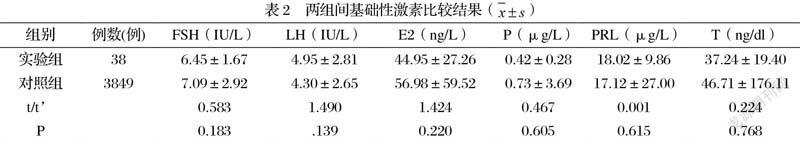
2.3两组间基础性激素比较结果 实验组与对照组间性激素结果差异无明显统计学意义(p>0.05),具体数值详见表2
2.3 两组间抗穆勒氏抗体及窦卵泡数比较结果 实验组的AMH、AFC明显高于对照组,差异有统计学意义(P<0.05),具体数值详见表3。
3讨论
临床中根据hCG注射后发生OHSS的时间将OHSS类型分为早发型和晚发型,早发型多发生在hCG注射后9天内,与促排卵治疗有关;晚发型多发生在9 天后,与早孕期内源性hCG升高及外源性hCG黄体支持相关;同时,根据临床症状、影像学及实验室检查严重程度OHSS可分为轻度、中度、重度[1]。OHSS患者由于毛细血管通透性增加,血管内大量液体转移到腹膜腔和其他腔室,由此导致血液浓缩,许多重要器官的灌注减少,严重者可发生胸腔积液、急性肾功能不全和静脉血栓栓塞等严重并发症,危及患者生命[7]。因此,在IVF-ET患者在进入周期治疗前有效识别具有OHSS风险患者,制定个性化促排方案及时予以系统的支持治疗将有助于避免不良预后的发生。
女性卵巢储备功能随着年龄增长而下降,高龄女性的卵母细胞非整倍体发生率增加,引起卵母细胞数量和质量同时下降[8, 9]。在IVF患者中,年龄偏小较年龄偏大的患者卵巢储备功能好,其发生OHSS机率相对较高,因此可认为年龄是OHSS的危险因素,可用于预测OHSS发生风险;其中伴有AFC数量多、血清E2水平高和获卵数多的年轻女性更容易发生OHSS[5, 10]。本组研究结果显示采用短效长方案促排卵行IVF-ET的患者发生OHSS组年龄明显小于未发生OHSS组,与上述研究类似。说明患者在IVF-ET采用短效长方案COH治疗中年龄同样是影响患者发生OHSS的重要因素之一。
女性卵巢储备指标如AFC、AMH在患者促排卵前有助于预测OHSS,其中AMH>3.36 ng/ml或AFC>24有很好的特异性和敏感性,现被常规用于促排卵治疗前识别有OHSS风险患者[11, 12]。此外,Malek Mansour Aghssa提出AMH预测OHSS的最佳临界值为6.95 ng/ml,其敏感性为75%,特异性为84%,这一结论可能是由于该研究中OHSS组多囊卵巢综合征患者数量较多导致[13]。本组资料显示OHSS组患者AMH显著高于未发生OHSS组患者,结合前人研究,可认为在采用短效长方案治疗的人群中高AMH同样是OHSS发生的影响因素,在进入周期治疗前可用于预测患者OHSS风险的发生。多数研究表明,AFC是预测OHSS的重要指标,了解AFC对规划和管理辅助生殖助孕至关重要[5]。本研究结果显示OHSS组AFC数量明显多于对照组,提示在短效长方案促排卵患者中,AFC也是发生OHSS风险的重要因素,与先前的研究结果相似。还有学者研究结果显示年龄、FSH、LH、E 2和T对AMH的预测有显著作用,其中AMH与T呈正相关(r= 0.346,P <0.001)[3]。但本组研究结果显示OHSS组与非OHSS组患者两组间的T值差异无明显统计学差异(P <0.05),可能与在我中心采用短效长方案的患者中多囊卵巢综合征患者较少有关。
综上所述,从本研究得出的结果可认为在IVF-ET中采用短效长方案COH的患者发生OHSS基础状态下的因素主要与年龄偏小、AMH高和AFC数量多有关。在临床进入周期前要密切关注上述指标,根据上述指标选择合理的治疗方案以预防OHSS的发生,使患者在安全、稳定的环境中获得满意的助孕结局。
参考文献
[1] 刘风华, 杨业洲, 张松英, 等. 辅助生殖技术并发症诊断及处理共识 [J]. 生殖与避孕, 2015, 35(7): 431-439.
[2] Chen C D, Chen S U, Yang Y S. Prevention and management of ovarian hyperstimulation syndrome [J]. Best Pract Res Clin ObstetGynaecol, 2012, 26(6): 817-827.
[3] Lv P P, Jin M, Rao J P, et al. Role of anti-Müllerian hormone and testosterone in follicular growth: a cross-sectional study [J]. BMC EndocrDisord, 2020, 20(1): 101.
[4] Mathur R S, Akande A V, Keay S D, et al. Distinction between early and late ovarian hyperstimulation syndrome [J]. FertilSteril, 2000, 73(5): 901-907.
[5] Sun B, Ma Y, Li L, et al. Factors Associated with Ovarian Hyperstimulation Syndrome (OHSS) Severity in Women With Polycystic Ovary Syndrome Undergoing IVF/ICSI [J]. Front Endocrinol (Lausanne), 2020, 11,615957.
[6] Depalo R, jayakrishan K, Garruti G, et al.GnRH agonist versus GnRH antagonist in in vitro fertilization and embryo transfer(IVF/ET) [J].Reprod Biol Endocrinol,2012,10 :26
[7] Blumenfeld Z. The Ovarian Hyperstimulation Syndrome [J]. VitamHorm, 2018, 107:423-451.
[8] Ata B, Kaplan B, Danzer H, et al.Array CGH analysis shows that aneuploidy is not related to the number of embryos generated [J]. Reprod Biomed Online, 2012, 24(6): 614-620.
[9] Ng E H, Yeung W S, Fong D Y, et al. Effects of age on hormonal and ultrasound markers of ovarian reserve in Chinese women with proven fertility [J]. Hum Reprod, 2003, 18(10): 2169-2174.
[10] Ma T, Niu Y, Wei B, et al. Moderate-to-severe ovarian hyperstimulation syndrome: A retrospective multivariate logistic regressio n analysis in Chinese patients [J]. Adv Clin Exp Med, 2020, 29(1): 85-90.
[11] Jayaprakasan K, Chan Y, Islam R, et al. Prediction of invitro fertilization outcome at different antral follicle count thresholds in a prospective cohort of 1,012 women [J]. FertilSteril, 2012, 98(3): 657-663.
[12] Lee T H, Liu C H, Huang C C, et al. Serum anti-mullerian hormone and estradiol levels as predictors of ovarian hyperstimulation syndrome in assisted reproduction technology cycles [J]. Hum Reprod, 2008, 23(1): 160-167.
[13] Aghssa M M, Tarafdari A M, Tehraninejad E S, et al. Optimal cutoff value of basal anti-mullerian hormone in iranian infertile women for prediction of ova rian hyper-stimulation syndrome and poor response to stimulation [J]. Reprod Health, 2015, 12:85.
基金项目:广西壮族自治区科技攻关课题(10124001A-52);广西壮族自治区医药卫生课题(Z2011474);
参考格式:滕敏,女,汉,1983年11月生,广西玉林人,本科,主管护师,广西壮族自治区人民医院生殖医学与遗传中心。
广西壮族自治区人民医院生殖与遗传中心,南寧,530021
