MiR-23a靶向HOXC8在肾癌发生中的作用及机制
2021-09-10张锐
张锐
肾癌是泌尿系常见的恶性肿瘤之一[1],针对肾癌的相关研究一直是人们关注的焦点,基于前期的研究成果,推测“在肾癌发病的过程中,MiR-23a调控着肿瘤增殖、凋亡、侵袭等过程,其作用的结合位点是靶基因HOXC8[2]。为了证实该假说,本研究通过体外、体内实验,采用MiR-23a inhibitor基因沉默的方法作为研究手段,观察MiR-23a及HOXC8在肾癌细胞株中的表达和MiR-23a对肾癌细胞的生物学影响,并在大鼠体内实验中进行验证,揭示MiR-23及HOXC8在肾癌细胞和组织中的表达规律[3],以及MiR-23a在肾癌细胞的生物学作用,从新的角度揭示肾癌细胞发生、发展的新的机制,为源头防治肾癌提供新的思路及治疗靶点。
1 材料与方法
1.1 一般材料
选取2019年1月培养的大鼠60例,MiR-23a inhibitor转染组(实验组)20例,空载体转染组20例(阴性对照组),空白组20例(空白对照组)。所有大鼠均进行体内与体外两种实验方法。实施方法主要包括细胞培养、细胞转染、反转录反应、引物扩增、实时定量聚合酶链式反应(polymerase chain reaction,PCR)实验方法、蛋白质免疫印迹(Western Blot)实验、动物实验等。
1.2 方法
(1)细胞培养:肾癌细胞株HK-2,786-O,CAKI-1均采用DMEM培养基培养,其内含1%青链霉素的双抗和10%始牛血清。置于5%二氧化碳、37℃细胞培养箱中常规培养,每2~3天传代一次,待细胞处于对数生长期用于实验。(2)细胞转染(适用于MiR-23a inhibitor):①将对数生长期的HK-2,786-O,CAKI-1细胞,分别用胰酶消化,用完全培养基收集细胞,以3.0×105/孔的密度接种于六孔板,接种后将细胞混悬液摇匀,常规条件培养。②过夜培养过后的细胞,状态生长良好,融合密度达到50%~60%,进行转染。转染分为三组,每组均设复孔,以平衡实验误差。分组:MiR-23a inhibitor转染组(实验组):MiR-23a inhibitor+转染试剂。空载体转染组(阴性对照组):MiRNA inhibitor negative control+转染试剂(negative control)。空白组(空白对照组):单加转染试剂(blank control)。③配制转染工作溶液。④细胞转染前1 h,釆用无血清培养基POTI MEMI更换细胞的完全培养基,预处理约1 h。⑤MiR-23a inhibitor的终浓度:1.5 μmol/L。⑥转染后24 h,采集2 mL新鲜的完全培养基更换转染体系。随后根据实验需要在合适的时间节点收集细胞,予进一步实验。(3)细胞总RNA提取。(4)反转录反应、引物扩增。(5)实时定量PCR实验方法,MTT法检测细胞增殖,流式细胞仪检测细胞凋亡,Transwell小室检测细胞侵袭,Western Blot实验。(6)动物实验:常规饲养→细胞培养及转染同上→皮下(左侧腹股沟)接种,控制肿瘤大小10~15 cm→记录瘤体大小→每3天观察并记录瘤体大小→第29天处死大鼠测量肿瘤体积→称取肿瘤组织进行Western Blot实验。
1.3 观察指标
观察体外实验中MiR-23a靶向HOXC8在肾癌发生表达的变化及在体内实验中MiR-23a靶向HOXC8在肾癌发生表达的变化。
1.4 统计学处理
利用统计学软件SPSS 22.0对数据进行分析,计数资料以率(%)表示,采用χ2进行检验,计量资料以(x-±s)表示,进行F检验,组间比较用t值检验;采用皮尔森相关性检验进行相关性研究,以P<0.05表示差异有统计学意义。
2 结果
2.1 体外实验中MiR-23a靶向HOXC8在肾癌发生表达的变化
在三组肾癌细胞系中转染MiR-23a inhibitor后抑制了细胞增殖,促进了细胞凋亡,降低了细胞侵袭性,同时HOXC8的表达下调,MiR-23a inhibitor转染组HK-2、786-O、CAKI-1、HOXC8均显著低于空载体转染组及空白组,组间比较差异有统计学意义(P<0.05),具体统计结果见表1。
表1 三组大鼠肝组织中肾癌细胞株的表达比较 (±s)
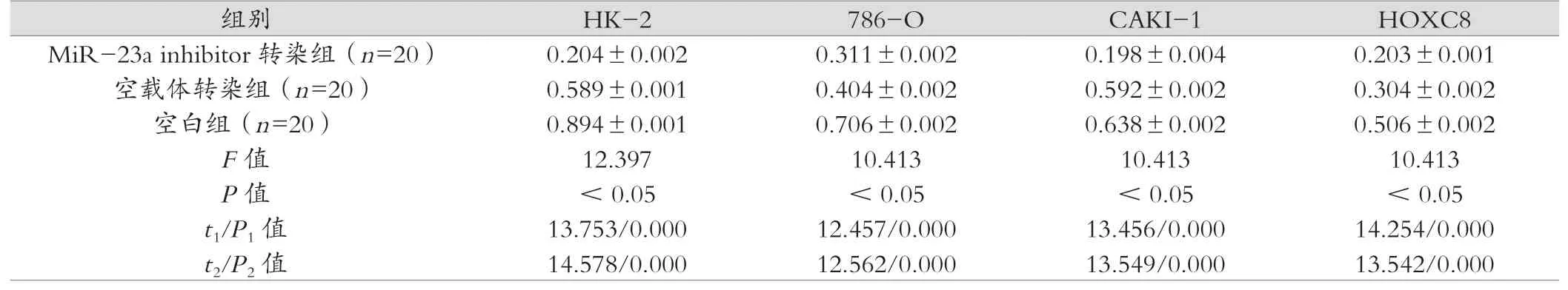
表1 三组大鼠肝组织中肾癌细胞株的表达比较 (±s)
注:t1、P1为MiR-23a inhibitor转染组与空载体转染组比较,t2、P2为MiR-23a inhibitor转染组与空白组比较
?
2.2 体内实验中MiR-23a靶向HOXC8在肾癌发生表达的变化
在体内实验中转染MiR-23a inhibitor后抑制了肿瘤的生长,其机制与下调HOXC8的表达有关,具体统计结果见表2。
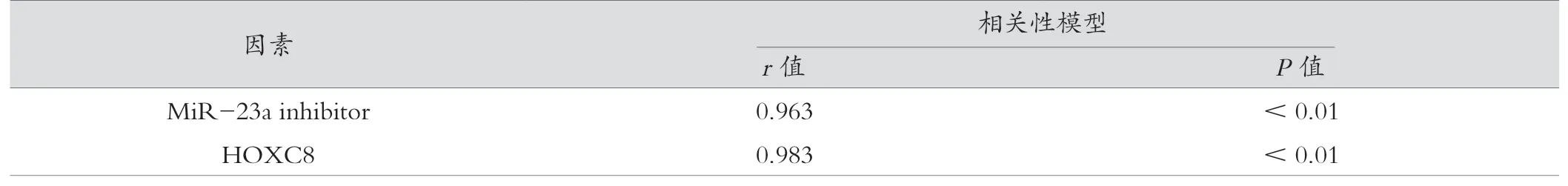
表2 Pearson相关性分析
3 讨论
肾癌是最常见的肾脏恶性肿瘤,早期症状不典型,晚期预后差[4]。近年来,新的证据显示一些MiRNA在肾癌的发生和发展中起着重要作用[5]。因此,学术领域多项研究为了解MiR-23a在肾细胞癌中的分子机制,并确定其潜在的临床价值,采用流式细胞术和流式细胞术检测MiR-23a在肾细胞癌中的表达及其增殖、迁移和凋亡[6]。通过生物信息学分析、逆转录-定量聚合酶链反应(quantitative reverse transcription PCR,RTqPCR)、Western Blot和荧光素酶报告子分析来识别和检测MiR-23a与其潜在靶点之间的关系。相关研究了118例福尔马林固定石蜡包埋的RCC标本中MiR-23a-3p表达与临床病理变量或总生存率(OS)的关系,RCC细胞系和TCGA数据库。上调MiR-23a-3p可增强ACHN和786-O细胞系中MiR-23a-3p,而沉默MiR-23a-3p则可抑制细胞活力、增殖和移动性[7]。此外,MiR-23a-3p的过度表达可抑制细胞凋亡。另据相关研究[8]进一步揭示MiR-23a-3p通过靶向富含脯氨酸的核受体辅活化子2(proline rich nuclear receptor coactivator,PNRC2)来调控肿瘤的发生。cox比例风险回归分析显示MiR-23a-3p低表达患者的OS显著延长,该项研究结果表明MiR-23a-3p不仅可以作为一种新的预后生物标志物,而且可以作为一种新的治疗策略[9]。但是目前显少见MiR-23a靶向HOXC8在肾癌发生中的作用及机制的相关研究[10],为了进一步证实MiR-23a靶向HOXC8在肾癌发生中的作用及机制,本研究针对MiR-23a靶向HOXC8的表达,采取了体内实验与体外实验。研究结果显示,在三组肾癌细胞系中转染MiR-23a inhibitor后抑制的细胞增殖,促进了细胞凋亡,降低了细胞侵袭性,同时HOXC8的表达也下调。组间比较差异有统计学意义(P<0.05)。在体内实验中转染MiR-23a inhibitor后抑制了肿瘤的生长,其机制与下调HOXC8的表达有关[11]。目前,MiR-23a已被基因芯片分析证实为多种疾病的致癌基因。然而,MiR-23a作为最常见的肾肿瘤,其在肾癌中的表达及功能尚不清楚[12]。本研究采用RT-qPCR和细胞计数试剂盒、Transwell、MTT和流式细胞术检测MiR-23a靶向HOXC8在肾细胞癌中的作用。研究表明,MiR-23a靶向HOXC8在肾细胞癌组织中的表达明显下降。此外,转染MiR-23a inhibitor后抑制了肿瘤的生长,其机制与下调HOXC8的表达有关。
综上所述,本研究结果提示MiR-23a是肾癌发生发展过程中的一个癌基因,MiR-23a靶向HOXC8的相关性来看,可能是肾癌的一个新的治疗靶点。
