柳州酸笋中降胆固醇乳酸菌的筛选及鉴定
2021-09-10熊建文桂扬周小玲陈正培吴锦兰崔娜巩僖
熊建文,桂扬,周小玲,陈正培,吴锦兰,崔娜,巩僖
(柳州工学院 食品与化学工程系,广西 柳州 545616)
随着人民生活水平的普遍提高,膳食营养越来越丰富,人群平均血清总胆固醇(cholesterol,TC)水平显著升高,由此引发的心脑血管疾病已成为威胁人类健康的头号杀手[1]。服用降胆固醇的药物虽然能有效控制体内胆固醇含量,但同时容易引起肝酶异常、肾功能受损等副作用[2]。作为国际公认的食品级益生菌,乳酸菌(lactic acid bacteria,LAB)大量存在于人体和动物体的肠道内,具有维持胃肠道微生态平衡、提高机体免疫力等重要生理功能[3-4]。同时,乳酸菌也是发酵食品中的重要细菌,在发酵食品和饮料的生产中具有长期和安全的应用和消费历史[5]。有研究表明,一些乳酸菌具有降胆固醇的能力,能产生高活性的胆汁盐水解酶和胆固醇氧化酶,在降解胆固醇及其同系物上起到了重要作用[6-8]。这为降低血清中胆固醇含量的研究提供了新的方向,而获得高效降胆固醇的乳酸菌菌株是利用乳酸菌降低胆固醇技术的关键,已成为近年来的研究热点[9]。马长路等[10]从自然发酵的传统东北酸菜中筛选出了降解胆固醇的优良乳酸菌,并且这类降解胆固醇的乳酸菌在干酪乳杆菌(Lactobacilluscasei)、棒状乳杆菌(Lactobacilluscoryneformes)和植物乳杆菌(Lactobacillusplantarum)中均有存在。
酸笋(fermented bamboo shoot)是我国南方地区传统特色发酵食品,也是柳州螺蛳粉的重要辅料,因其独特的风味,深受人们钟爱。酸笋是利用竹笋中自然附着的乳酸菌发酵而制成,其中蕴藏着丰富的乳酸菌资源[11]。目前有关酸笋的研究主要集中在其营养成分、风味物质和制作工艺上[12-14],而有关酸笋中功能性乳酸菌的研究仍相对匮乏。本研究以柳州传统发酵酸笋为原料,采用MRS-CaCO3培养基对酸笋发酵液中的乳酸菌进行分离,通过硫酸铁铵显色法对降胆固醇乳酸菌进行筛选,随后对该优良菌株进行分子生物学鉴定,最后探究影响降解胆固醇能力的因素,为开发降胆固醇功能性乳酸菌产品提供了参考。
1 材料与仪器
1.1 材料
1.1.1 原料
酸笋自然发酵液样品:采集于广西柳州市。
1.1.2 化学试剂
牛肉膏、酵母浸粉、细菌学蛋白胨、蛋白胨、胰蛋白胨、多聚蛋白胨和琼脂粉:广东环凯微生物科技有限公司;葡萄糖、乳糖、可溶性淀粉和蔗糖:国药集团化学试剂有限公司;碳酸钙:广东光华科技股份有限公司;琼脂糖:Biowest公司;胆固醇:上海麦克林生化科技有限公司;牛胆盐:上海源叶生物科技有限公司;DNA 提取试剂盒:北京天根生化试剂有限公司;Ⅱ型核酸染料:Pitoop公司。
1.1.3 培养基
按文献[15]配制MRS液体培养基;MRS固体培养基:MRS液体培养添加质量浓度为15 g/L的琼脂;含碳酸钙MRS培养基:在MRS培养基中添加3 g/L的碳酸钙;含胆固醇MRS-CHOL培养基:在MRS培养基中添加0.2%牛胆盐、100 μg/mL或者200 μg/mL胆固醇。
1.1.4 仪器与设备
SW-CJ-2F 超净工作台 苏净集团安泰公司;ZQLY-180S振荡培养箱 上海知楚仪器有限公司;H1650R高速离心机 湖南湘仪仪器开发有限公司;HH-S6数显恒温水浴锅 江苏金怡仪器科技有限公司;Master-S15超纯水机 上海和泰仪器有限公司;UV-1800 型紫外可见分光光度计 上海美谱达仪器有限公司;Nikon Eclipse E200生物显微镜 日本尼康公司;GenoSens 1880凝胶成像分析系统 上海勤翔科学仪器有限公司;L9800基因扩增仪 北京莱普特科学仪器有限公司。
1.2 方法
1.2.1 酸笋中乳酸菌的分离与纯化
将采集的酸笋发酵液样品梯度稀释(10-1~10-6)后,利用倾注法接种在MRS-CaCO3固体培养基平板上,于37 ℃恒温培养24 h,挑取溶钙圈明显的菌落,在MRS多次纯化后进行甘油保存。
1.2.2 降胆固醇乳酸菌的初筛
取1环目标菌株,接种到MRS液体培养基中,于37 ℃培养10 h,调整菌液的OD600 nm值为0.6,将其作为种子液,按1%(V/V)的接种量接种于含有100 μg/mL胆固醇的MRS-CHOL液体培养基中,37 ℃恒温静置培养48 h。取30 μL发酵液置于2 mL离心管中,加入1.5 mL无水乙醇,混匀后于10000 r/min离心2 min,取1.0 mL上清液于试管中,加入1.0 mL硫酸铁铵显色液,先摇匀混合,待冷却后于波长560 nm处测定吸光度值。绘制标准曲线,按照标准曲线回归方程计算胆固醇含量,并按下列公式计算胆固醇降解率。
式中:D为菌株的胆固醇降解率,%;C0为原培养基中胆固醇质量浓度,μg/mL;C1为测试菌株发酵后上清液样品胆固醇质量浓度,μg/mL。
1.2.3 降胆固醇乳酸菌的复筛
按1%的接种量(V/V)将目标菌株接种于含有200 μg/mL胆固醇的MRS-CHOL液体培养基中,在37 ℃下恒温静置培养48 h,测定发酵液中的胆固醇含量,计算降解率,方法同上。
1.2.4 降胆固醇菌株的初步鉴定
1.2.4.1 形态学观察
将目标菌株在MRS固体培养基上进行培养,观察菌株的菌落形态特征,再对菌株进行革兰氏染色,观察菌体细胞形态特征,参照《伯杰氏细菌鉴定手册》,进行初步形态学鉴定。
1.2.4.2 分子生物学鉴定
利用16S rDNA测序法对菌株进行分子生物学鉴定,具体方法参考文献[15]。
1.2.5 不同因素对乳酸菌降解胆固醇能力的影响
碳源的影响:分别按比例使用葡萄糖、蔗糖、乳糖、可溶性淀粉等碳源作为200 μg/mL含胆固醇MRS-CHOL液体培养基的碳源,将目标菌株的种子液按照1.0%(V/V)接种量接种到上述培养基中,于37 ℃恒温静置培养,分别在24 h和48 h后,测定每组发酵液中胆固醇含量,考察不同碳源对菌株降解胆固醇能力的影响。
氮源的影响:分别按比例使用蛋白胨、胰蛋白胨、细菌学蛋白胨、多聚蛋白胨等氮源作为含200 μg/mL胆固醇MRS-CHOL液体培养基的氮源进行上述菌株降解胆固醇试验,培养24 h和48 h后,测定每组发酵液中胆固醇含量,考察不同氮源对菌株降解胆固醇能力的影响。
接种量的影响:分别取1.0%、2.0%、3.0%、4.0%、5.0%的接种量接入到含200 μg/mL胆固醇MRS-CHOL液体培养基中进行上述菌株降解胆固醇试验,培养24 h和48 h后,测定每组发酵液中胆固醇含量,考察不同接种量对菌株降解胆固醇能力的影响。
pH值的影响:将含200 μg/mL胆固醇MRS-CHOL液体培养基的pH值分别调节为3.0,4.0,5.0,6.0,7.0,8.0的条件下进行上述菌株降解胆固醇试验,培养24 h和48 h后,测定每组发酵液中胆固醇含量,考察不同pH值对菌株降解胆固醇能力的影响。
温度的影响:将培养温度分别设置为 22,27,32,37,42 ℃的条件下进行上述菌株降解胆固醇试验,培养24 h和48 h后,测定每组发酵液中胆固醇含量,考察不同温度对菌株降解胆固醇能力的影响。
2 结果与分析
2.1 酸笋中乳酸菌的分离
利用MRS-CaCO3培养基对酸笋发酵液的乳酸菌进行分离,得到48株形态均一的白色菌株,菌落周围都出现典型的溶钙圈,将其纯化后进行编号,分别为LZ-1-1~LZ-1-24、LZ-2-1~LZ-2-24。
2.2 降胆固醇乳酸菌的初筛和复筛
在 100 μg/mL胆固醇质量浓度下48株菌的胆固醇降解率结果见表1。初筛结果显示,不同的菌株降胆固醇能力不同,其中菌株LZ-1-8、LZ-1-10、LZ-1-14、LZ-2-11、LZ-2-12、LZ-2-14、LZ-2-15、LZ-2-19、LZ-2-20、LZ-2-22的胆固醇降解率均超过60%。

表1 48株菌的胆固醇降解率Table 1 The degradation rates of cholesterol of 48 strains
对这10株菌胆固醇降解率进行复筛,结果见表2,复筛结果表明,这10株菌胆固醇的降解能力大小依次为菌株LZ-2-12>菌株LZ-1-10>菌株LZ-2-14>菌株LZ-2-19>菌株LZ-1-14>菌株LZ-2-22>菌株LZ-2-15>菌株LZ-2-20>菌株LZ-1-8>菌株LZ-2-11,其中菌株LZ-2-12胆固醇降解率最大,平均值为54.27%。因此,对菌株LZ-2-12进行下一步试验。
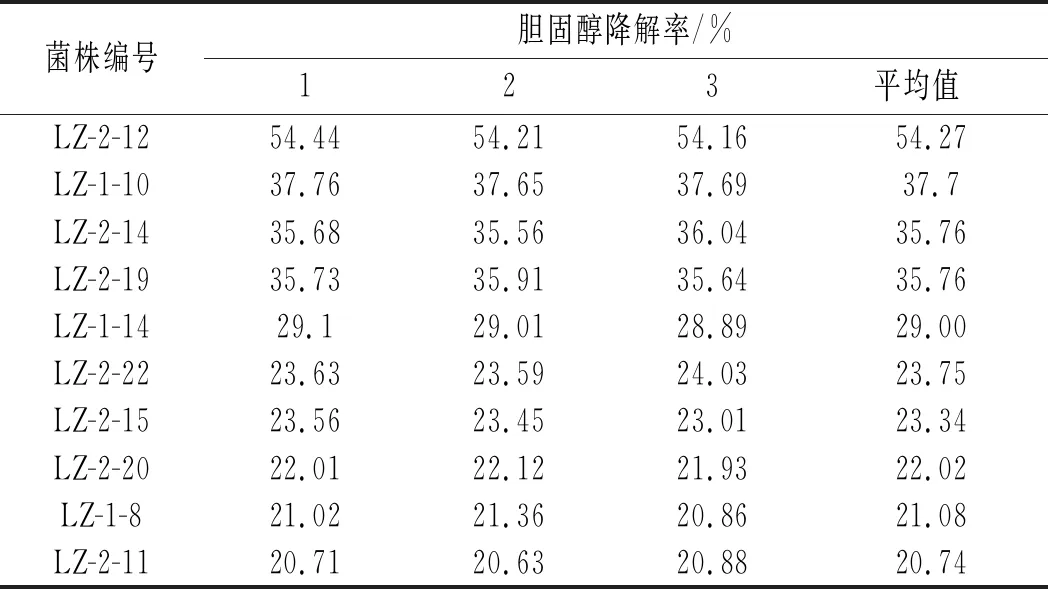
表2 200 μg/mL胆固醇浓度下10株菌的胆固醇降解率Table 2 The degradation rates of cholesterol of 10 strains with cholesterol concentration of 200 μg/mL
2.3 降胆固醇菌株的鉴定结果
菌株LZ-2-12在MRS培养基培养24 h后,菌落形态为圆形、乳白色、表面光滑、边缘整齐、中央微凸起(见图1中A)。在光学显微镜下观察菌株呈短杆状、单个或成对存在,无芽孢,革兰氏染色为紫色呈阳性(见图1中B)。
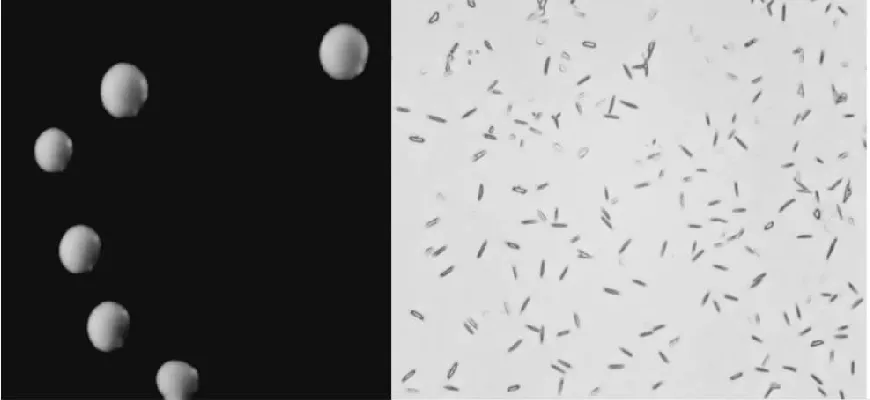
A B图1 菌株LZ-2-12的形态特征 Fig.1 The morphological characteristics of strain LZ-2-12注:A为菌落形态;B为菌株形态(革兰氏染色40x)
以菌株LZ-2-12的基因组DNA为模板,以细菌鉴定16S rDNA通用引物27F及1492R为引物进行PCR扩增,PCR产物的琼脂糖凝胶电泳结果见图2,扩增产物大小与预期结果相符,符合条件,纯化后送测序公司进行测序。

图2 菌株LZ-2-12的16S rDNA PCR扩增产物电泳图 Fig.2 The electrophoretogram of 16S rDNA PCR amplified products of strain LZ-2-12注:M为DL 2000 DNA Marker;1为菌株LZ-2-12;2为空白对照。
菌株LZ-2-12的16S rDNA序列经同源性比对,选取同源性较高的模式菌株的16S rDNA基因序列,构建系统发育树。在GenBank的核苷酸BLAST比对结果表明,菌株LZ-2-12序列和植物乳杆菌Lactobacillusplantarumstrain 8187 序列同源性高达99.58%且与其在系统发育树同一分支(见图3),结合形态学特征将其鉴定为植物乳杆菌Lactobacillusplantarum。

图3 菌株LZ-2-12的系统进化分析 Fig.3 The phylogenetic analysis of strain LZ-2-12
2.4 降胆固醇菌株的发酵条件优化
2.4.1 碳源的优化
按照1.2.5的方法,用4种碳源分别作为培养基中唯一碳源培养LZ-2-12,分别在24 h和48 h取样测定发酵液中的胆固醇含量,计算胆固醇降解率,分析它们作为唯一碳源对LZ-2-12降解胆固醇的影响,结果见图4。
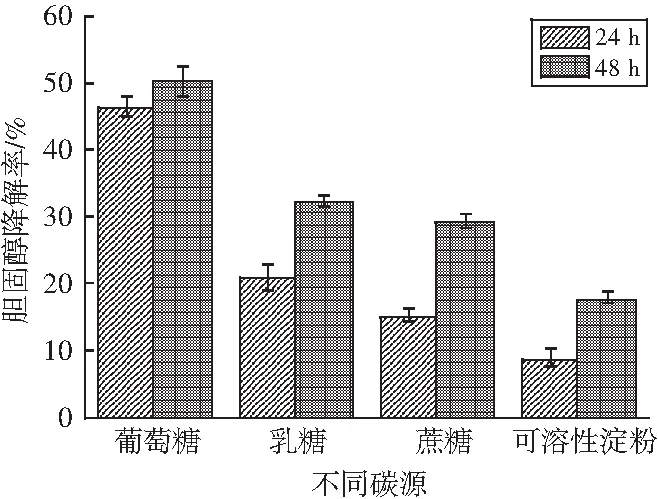
图4 不同碳源对菌株LZ-2-12降胆固醇能力的影响Fig.4 Effect of different carbon sources oncholesterol-reducing ability of strain LZ-2-12
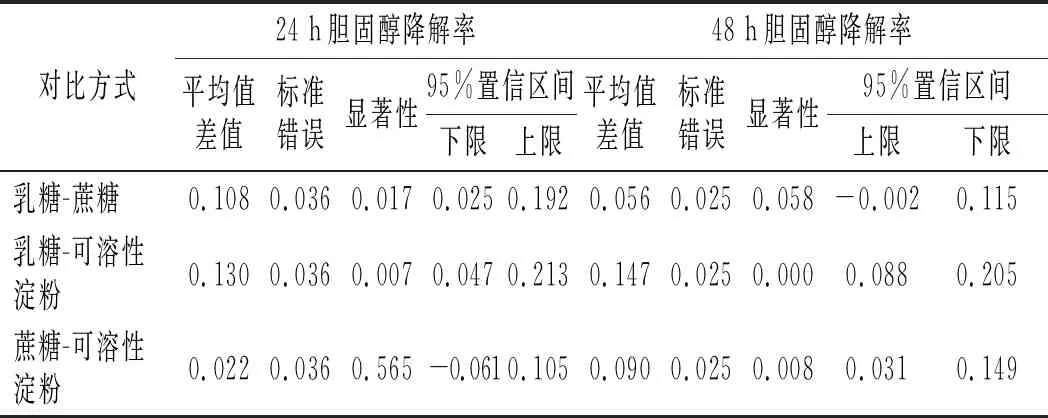
由图4可知,不同的碳源作为唯一碳源对胆固醇降解率的大小为葡萄糖>乳糖>蔗糖>可溶性淀粉。通过事后检验,对碳源进行两两比较,分析显著性差异,结果见表3。
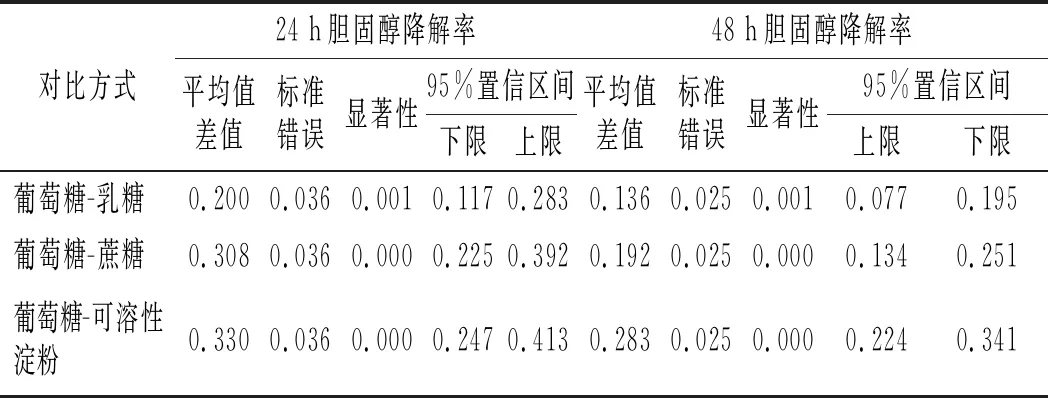
表3 4种碳源间的差异性分析 Table 3 The difference analysis among four carbon sources
续 表
由表3可知,培养24 h时,除蔗糖与可溶性淀粉间无显著性外(P>0.05),其他均有显著性差异(P<0.05)。培养48 h时,除蔗糖与乳糖无显著差异外(P>0.05),其他均有显著性差异(P<0.05)。出现这种差异可能是碳源结构、单糖种类和糖苷键种类综合影响的结果,葡萄糖作为单糖,可以直接被LZ-2-12利用,促进菌的生长,有利于对胆固醇的降解;蔗糖与乳糖均为二糖,不能直接被菌利用,需要被分解为单糖后才能被利用,故其降解胆固醇的效果次之;而蔗糖比乳糖利用慢,可能是糖苷键和糖苷差异的原因。可溶性淀粉属于多糖,也不能被菌直接利用,被分解的效率更低,故其降解胆固醇的效果更差。
2.4.2 氮源的优化
按照1.2.5的方法,用4种氮源分别作为培养基中唯一氮源来培养LZ-2-12,分别在24 h和48 h取样测定其发酵液中胆固醇的含量,计算胆固醇降解率,分析它们作为唯一氮源对LZ-2-12降解胆固醇的影响,结果见图5。
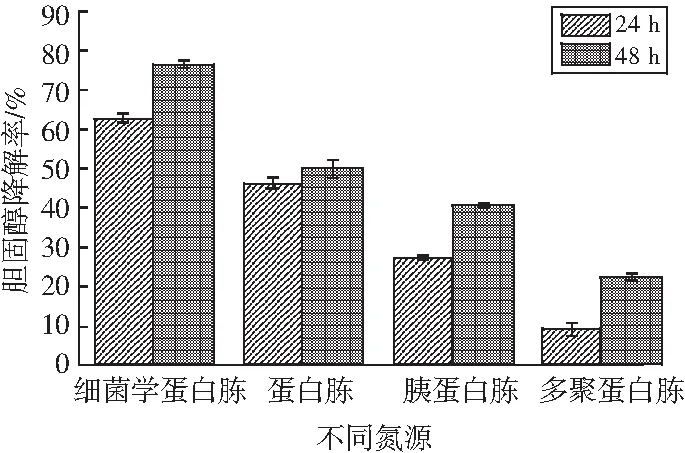
图5 不同氮源对菌株LZ-2-12降胆固醇能力的影响Fig.5 Effect of different nitrogen sources on cholesterol-reducing ability of strain LZ-2-12
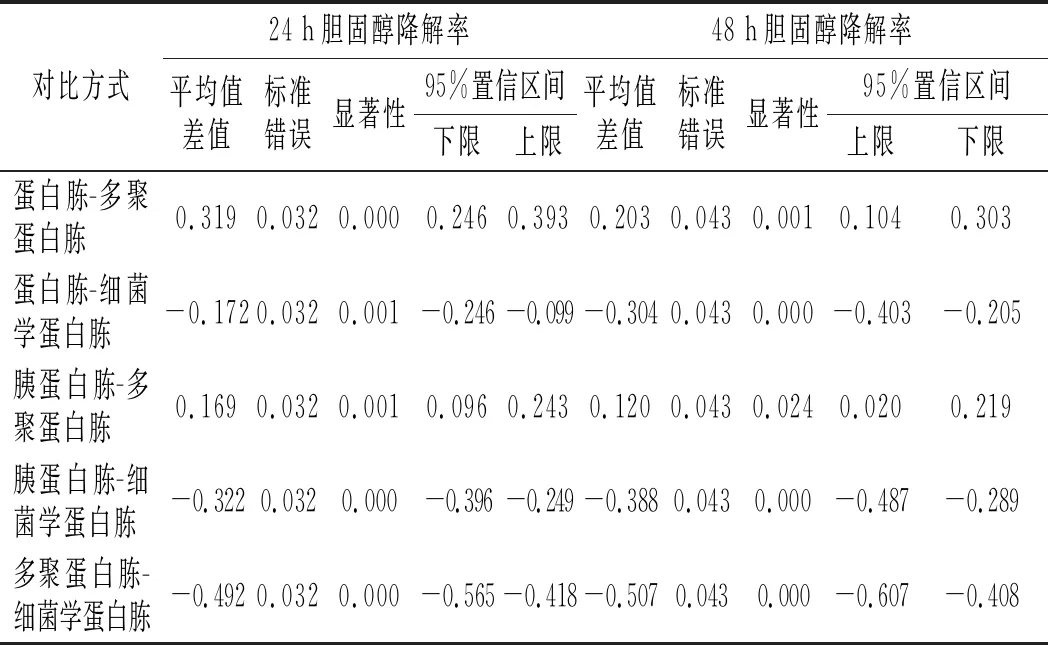
由图5可知,不同的氮源作为唯一氮源的胆固醇降解率大小为细菌学蛋白胨>蛋白胨>胰蛋白胨>多聚蛋白胨。通过事后检验,对氮源进行两两比较,分析氮源间的显著性差异,见表4。

表4 4种氮源间的差异性分析 Table 4 The difference analysis among four nitrogen sources
续 表
由表4可知,在培养的24 h和48 h后,细菌学蛋白胨作为唯一氮源的胆固醇降解率显著大于其他3种氮源的胆固醇降解率,且均有显著性差异(P<0.05),因此细菌学蛋白胨是植物乳杆菌LZ-2-12降解胆固醇的最优氮源。
2.4.3 接种量的优化
将植物乳杆菌LZ-2-12分别以1.0%、2.0%、3.0%、4.0%、5.0%进行接种,在培养后的24 h和48 h取样测定发酵液中胆固醇的含量,分析接种量对植物乳杆菌LZ-2-12降解胆固醇的影响,结果见图6。
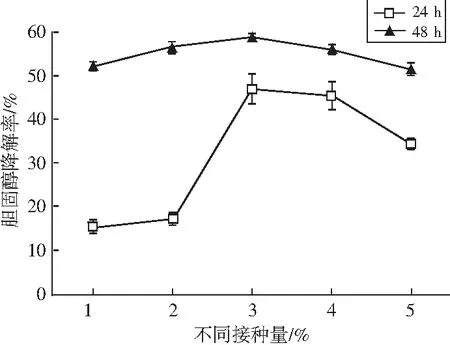
图6 不同接种量对菌株LZ-2-12降胆固醇能力的影响Fig.6 Effect of different inoculation amount on cholesterol-reducing ability of strain LZ-2-12
由图6可知,不同时期胆固醇降解率随接种量的增加呈现先升高后降低的趋势,在接种量为3%时达到最高。对它们进行两两比较,分析接种量间的显著性,结果见表5。
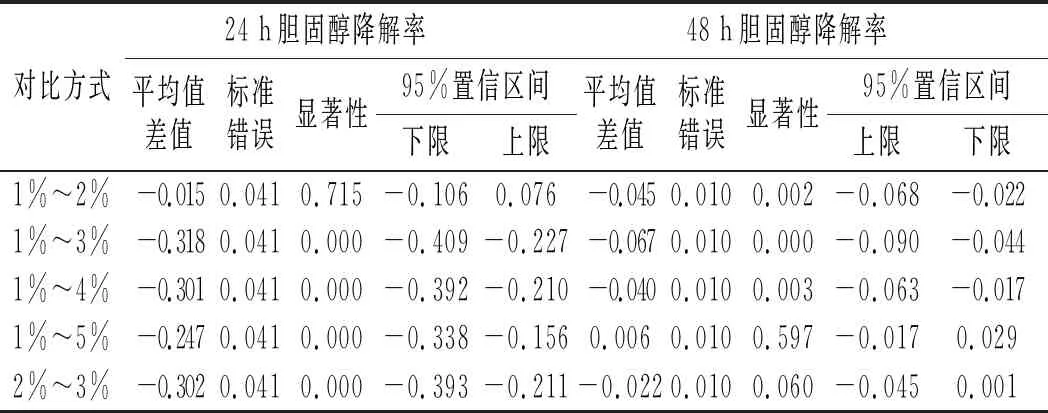
表5 接种量间的差异性分析 Table 5 The difference analysis among the inoculation amount
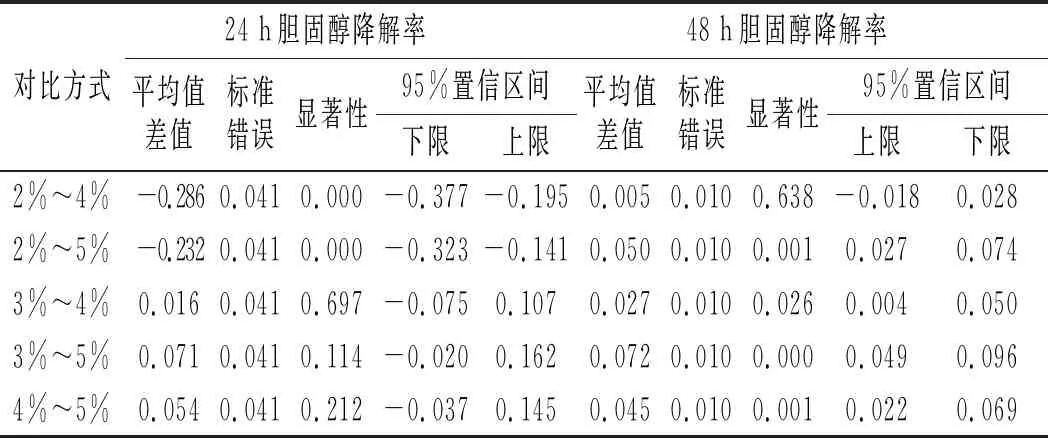
续 表
由表5可知,培养24 h时,1%和2%接种量间的胆固醇降解率无显著差异(P>0.05),3%、4%和5%接种量间的胆固醇降解率两两无显著性差异(P>0.05),3%、4%和5%接种量的降解率显著高于1%和2%接种量(P<0.05)。出现这种现象的原因可能是,植物乳杆菌LZ-2-12对胆固醇的降解与活菌数呈正比关系,在培养24 h时,1%与2%的接种量较低,生物量也低,因此降胆固醇降解率低;接种量超过3%时,接种量越大,培养基中的营养物质消耗越快,细菌活细胞数越低,导致胆固醇的降解率越低。培养48 h时,接种量为2%、3%和4%的胆固醇降解率显著高于1%和5%(P<0.05),随着培养时间的延长,接种量间的胆固醇降解率差异逐渐缩小,但总体呈现接种量为3%时的胆固醇降解率为最佳。
2.4.4 pH的优化
将植物乳杆菌LZ-2-12分别在pH 3.0,4.0,5.0,6.0,7.0,8.0下培养,在培养后的24 h和48 h取样测定发酵液中胆固醇的含量,分析接种量对植物乳杆菌LZ-2-12降解胆固醇的影响,结果见图7。
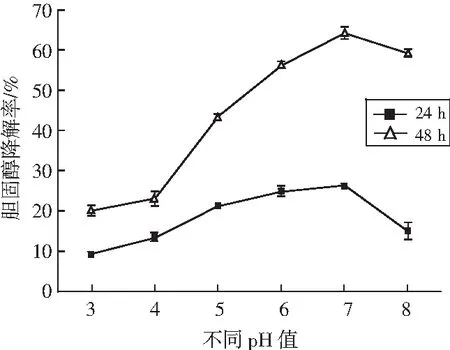
图7 不同pH值对菌株LZ-2-12降胆固醇能力的影响Fig.7 Effect of different pH values on cholesterol-reducing ability of strain LZ-2-12
由图7可知,当pH值在3.0~7.0之间时,菌株LZ-2-12的胆固醇降解率随着pH的增加而增大;当pH值为7.0时,菌株LZ-2-12的降胆固醇能力达到最高,pH值大于7.0时,菌株LZ-2-12的胆固醇降解率随pH值的增加而减小。两两比较pH间的差异显著性,结果见表6。
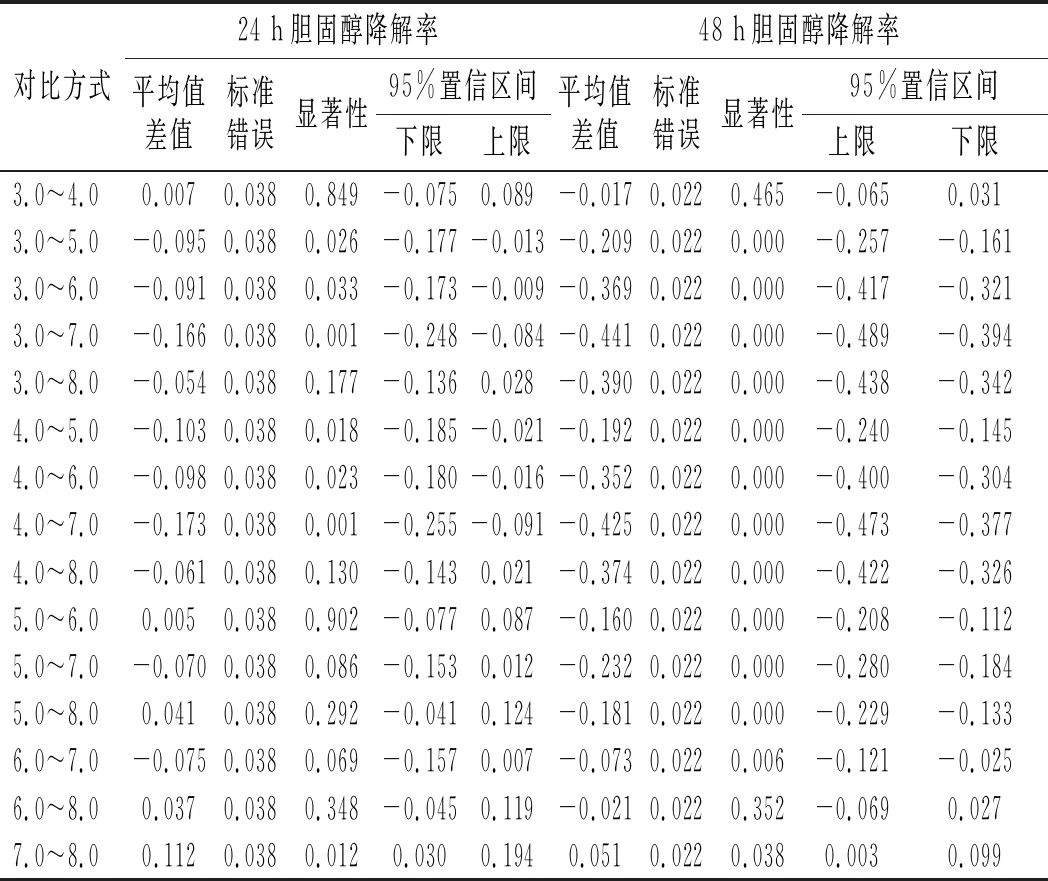
表6 pH值间的差异性分析 Table 6 The difference analysis among the pH values
由表6可知,培养24 h时,pH 5.0,6.0,7.0间的胆固醇降解率无显著性差异(P>0.05),培养48 h时,pH 7.0的胆固醇降解率显著高于pH 6.0和pH 7.0(P<0.05)。因此,中性环境有利于菌株LZ-2-12对胆固醇的降解,植物乳杆菌LZ-2-12代谢产生的酸环境不利于其对胆固醇的降解。
2.4.5 培养温度的优化
将植物乳杆菌LZ-2-12分别在不同温度下培养,在培养后的24 h和48 h取样测定发酵液中胆固醇的含量,分析温度对植物乳杆菌LZ-2-12对降胆固醇的影响,结果见图8。
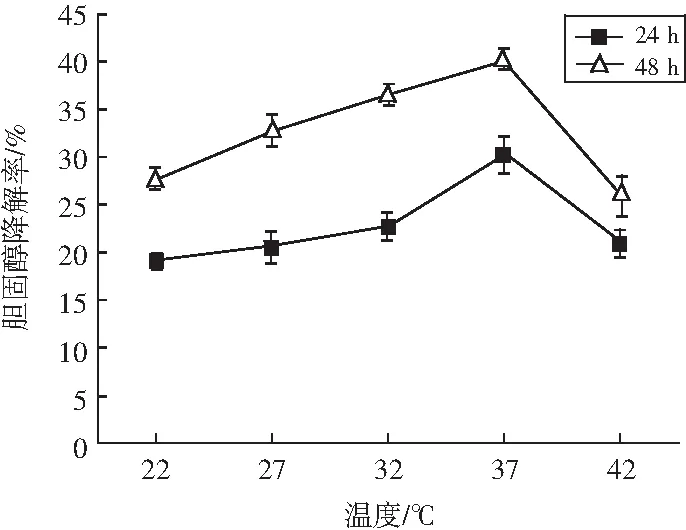
图8 不同温度对菌株LZ-2-12降胆固醇能力的影响Fig.8 Effect of different temperatures on cholesterol-reducing ability of strain LZ-2-12
由图8可知,当温度在22~37 ℃之间时,菌株LZ-2-12的降解率随着温度的升高而增大;当温度为37 ℃时,菌株LZ-2-12的降胆固醇能力最佳,在24 h和48 h的胆固醇降解率分别为30.17%和39.97%;当温度大于37 ℃时,菌株LZ-2-12的胆固醇降解率随着温度的升高而减小。两两比较不同温度对胆固醇降解率的影响,结果见表7。
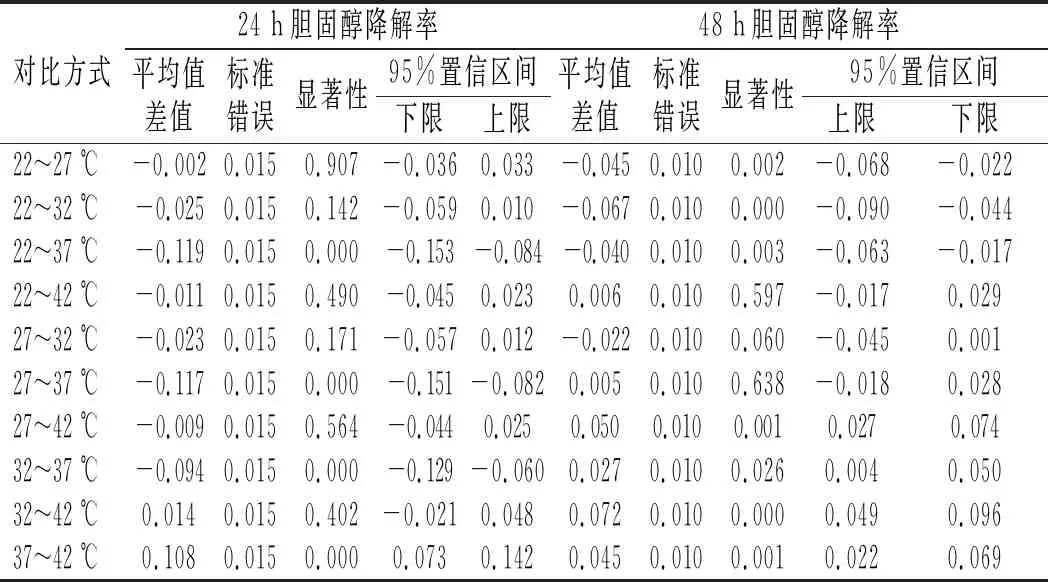
表7 温度间的差异性分析 Table 7 The difference analysis among the temperatures
由表7可知,温度为37 ℃时胆固醇降解率显著高于32 ℃和42 ℃(P<0.05),因此菌株LZ-2-12降解胆固醇的最佳温度为37 ℃。
3 结论
本研究从柳州自然发酵酸笋中分离纯化获得一株降胆固醇能力较好的菌株LZ-2-12,经形态学观察、分子生物学鉴定其为植物乳杆菌(Lactobacillusplantarum)。该菌株在MRS培养基中生长良好,采用MRS培养基的其他组分及其浓度,以葡萄糖为唯一碳源(添加量为20 g/L)、细菌学蛋白胨为唯一氮源(添加量为10 g/L)、接种量为3%、pH值为7.0、温度为37 ℃的条件下,最适合植物乳杆菌LZ-2-12对胆固醇的降解。该菌株源于广西发酵酸笋,将其用于酸笋发酵具有安全性高的显著特点,此外,该菌株在37 ℃和中性环境下降胆固醇效果较好,有在人体肠道定殖的良好基础,该菌株的获得在开发降胆固醇的功能性酸笋以及其他食品方面有良好的应用价值。
