广西醋醅中醋酸菌的分离鉴定及发酵特性
2021-09-10杨杰黄翠姬林培娇卢宏皓刘昭明
杨杰,黄翠姬,林培娇,卢宏皓,刘昭明
(广西科技大学 生物与化学工程学院,广西 柳州 545006)
我国食醋酿造历史悠久,醋酸菌作为食醋酿造过程中醋酸发酵阶段的主要菌种,其发酵性能的优劣对企业的生产发展有着极大的影响。在乙酸化过程中,醋酸菌的活性受许多变量的影响,例如乙酸浓度、乙醇浓度、溶解氧和温度。现今,我国食醋酿造工业中最常用的醋酸菌菌种为巴氏亚种(沪酿1.01)、浑浊变种(中科AS1.41)等,但它们存在一定的发酵缺陷,不利于生产发展。因此,选育出高产酸、耐酒精、耐高温、耐乙酸等性能更强的醋酸菌菌株对我国的食醋酿造工业发展和醋酿企业生产都具有很重要的意义[1]。从近几年来的文献资料可以看出,从醋醅中分离筛选出优势醋酸菌已经成为目前醋酸菌研究的热点之一,如刘阳等[2]、陈洋等[3]曾分别从保宁醋曲和工业醋醅中分离得到产酸量较高、耐受性能较好的醋酸菌,具有一定的应用价值。
广西民间有着非常丰富的醋醅资源,可以说是研究醋酸菌的良好菌种来源。因此,本研究旨在对广西民间酿醋作坊的醋醅进行醋酸菌菌种的分离和鉴定,筛选出产酸量较高的醋酸菌,然后对其发酵性能进行研究,最终筛选出一株产酸量高、温度耐受能力、酒精耐受能力、乙酸耐受能力等性能较优的醋酸菌菌株,以期能够为工业化醋酸生产和优良菌株的选取提供一定的理论参考。
1 材料与方法
1.1 试验材料
1.1.1 菌种
醋酸菌菌种来源:广西民间和工业酿醋作坊的醋醅。这些醋醅都是在广西自治区收集的,将收集的样品装入无菌袋并转移到冰箱(4 ℃)中,在实验室分析。
革兰氏染色对照菌株:枯草芽孢杆菌(Bacillussubtilis)为阳性菌株,大肠杆菌(Escherichiacoli)为阴性菌株,均为广西科技大学生物与化学工程学院微生物实验室保藏菌种。
1.1.2 试剂药品
葡萄糖、碳酸钙、无水乙醇、酚酞指示剂(IND)、氯化钠、氢氧化钠、丙三醇、FeCl3·6H2O、邻苯二甲酸氢钾:优级纯(GR),天津市科密欧化学试剂有限公司;盐酸、冰乙酸:均为分析纯(AR),西陇化工股份有限公司;酵母膏、琼脂、琼脂糖:生化试剂,上海汉尼生物技术有限公司。
1.1.3 仪器设备
E220显微镜 北京瑞宏诚科技发展有限公司;P3PC紫外分光光度计 上海美谱达仪器有限公司;DYY-6D电泳仪 北京市六一仪器厂;T100PCR扩增仪 美国Bio-Rad公司;H3-18KR台式高速冷冻离心机 湖南可成仪器设备有限公司。
1.1.4 培养基
种子培养基:酵母膏1%,葡萄糖1.55%,蒸馏水200 mL,121 ℃高压蒸汽灭菌20 min,冷却后在使用前加入3%(V/V)的无水乙醇。
葡萄糖碳酸钙培养基(分离培养基):葡萄糖1.5%,酵母膏1%,琼脂 2%,pH自然,蒸馏水200 mL,121 ℃高压蒸汽灭菌20 min,灭菌后在培养基温度降到75 ℃左右加入3%(V/V)的无水乙醇和1%的无菌碳酸钙(165 ℃干热灭菌 30 min)。
发酵培养基:酵母膏2%,葡萄糖2%,蒸馏水200 mL,121 ℃高压蒸汽灭菌20 min,冷却后在使用前加入6%(V/V)的无水乙醇。
斜面保藏培养基:葡萄糖1%,酵母膏1%,琼脂2%,丙三醇2.5%,121 ℃高压蒸汽灭菌20 min。
产酸培养基:葡萄糖1%,酵母膏1%,121 ℃高压蒸汽灭菌20 min,使用前加入6%(V/V)的无水乙醇。
1.2 试验方法
1.2.1 醋酸菌的分离鉴定
采用平板分离纯化培养[4],在葡萄糖碳酸钙分离培养基的平板上,产酸的菌株能够利用底物而生成醋酸,醋酸再与培养基中的CaCO3发生反应从而使CaCO3溶解,所以在产酸的菌株周围会形成一个比较清楚的溶钙圈,由此可以分离出产酸的细菌,然后通过定性试验、分子生物学鉴定等可以鉴定出筛选得到的菌株属于哪种菌种。
1.2.1.1 醋醅中菌体富集
配制30 mL种子培养基装于500 mL锥形瓶中,121 ℃高压蒸汽灭菌20 min,冷却后无菌操作加入2 mL醋醅样品,在30 ℃、200 r/min的恒温振荡培养器中振荡培养24 h,使菌种快速繁殖。
1.2.1.2 稀释涂布
取1 mL富集好的菌液置于装有9 mL无菌生理盐水的25 mL锥形瓶中,充分混合均匀,此时菌液浓度为10-1,依次稀释至10-6,并取 10-4、10-5、10-6样品稀释液,分别在平板分离培养基上涂布,每一个梯度用100 μL稀释液涂布两个平板,涂布完成后在30 ℃培养箱中倒置培养48 h。
1.2.1.3 平板划线分离
观察1.2.1.2中培养好的菌,在单菌落较多、菌落形态明显的平板上选取溶钙圈较大、形态大小不一的、具有生长优势的单菌落进行平板划线分离[5],纯化培养,直至平板上是形态一致且透明圈清晰的单菌落,进行下一步试验。
1.2.1.4 斜面保藏培养
将1.2.1.3中纯化后的菌株分别取1环生长较好的单菌落接种于斜面培养基中,编号,在培养箱中30 ℃培养24 h后取出,于4 ℃冰箱中保藏。
1.2.1.5 产酸定性试验
将1.2.1.4中的斜面菌株分别取1环接种于产酸试验培养基中,500 mL锥形瓶装30 mL培养液,置于30 ℃、200 r/min恒温振荡培养器中振荡培养48 h。取5 mL培养好的菌液,在8000 r/min的条件下离心5 min,然后分别取上清液于试管中,编号,并用1 mol/L氢氧化钠调整pH至7.0,加入5~6滴10%三氯化铁溶液(质量体积比),煮沸,若形成红褐色沉淀说明有醋酸产生,则对应菌株判定为产醋酸的细菌。
1.2.1.6 革兰氏染色
将1.2.1.4中的斜面菌株取1环于5 mL种子培养基中进行一级种子培养,在摇床中30 ℃、200 r/min培养12 h。一级种子培养好后取出,接种于装有100 mL种子培养基的锥形瓶中进行二级种子培养,培养条件:恒温摇床中30 ℃、200 r/min振荡培养。在二级种子培养到18~24 h时进行革兰氏染色,以Bacillussubtilis作阳性对照、Escherichiacoli作阴性对照,镜检并观察细胞形态[6]。
1.2.1.7 初筛
根据产酸定性试验和革兰氏染色结果,筛选出产醋酸且为革兰氏阴性的菌株,初步判定其为醋酸菌菌株,对筛选出的菌株进行编号,并用甘油在-80 ℃条件下保藏菌种。
1.2.1.8 复筛
采用碱滴定法[7]对初筛得到的菌株进行产酸能力的测定,弃去产酸能力较弱的菌株,选出产酸能力相对较强的菌株,进行下一步试验。方法:将斜面菌株进行一级种子、二级种子培养,在二级种子培养至18~24 h时,取10%(体积分数)菌液接种于含50 mL发酵培养基的500 mL挡板锥形瓶中,置于30 ℃、200 r/min恒温振荡培养器中振荡培养72 h。按照GB/T 12456-2008《食品中总酸的测定》方法测定样品的总酸,以醋酸计,根据产酸量的高低来选择优势菌株进行下一步试验。
1.2.1.9 16S rDNA鉴定
对复筛得到的高产酸菌株进行菌种鉴定[8]。取2 μL富集好的菌液于离心管中,用16S rDNA通用引物进行PCR扩增。PCR扩增反应体系为:ddH2O 19 μL,Master Mix酶25 μL,上游引物27f 2 μL(5′-GCTGGCGGCATGCTTAACACAT-3′),下游引物1492r 2 μL(5′-AACCACATGCTCCACCGCTTG-3′[9]),DNA模板2 μL,混匀,放入PCR扩增仪中进行扩增。PCR扩增程序条件见表1。

表1 PCR扩增程序条件Table 1 PCR amplification program conditions
PCR产物用1%的琼脂糖凝胶电泳检测,在凝胶成像系统中观察条带,用无菌手术刀切下目的片段,再用通用型DNA纯化回收试剂盒进行目的片段的纯化回收。将纯化回收后的目的片段送往生物公司测序,测序基因拼接好后将其结构提交至NCBI的GenBank数据库中进行BLAST序列对比,利用MEGA 7.0构建系统进化树,根据同源性鉴定结果得出筛选得到的菌株属于哪种醋酸菌种[10]。
1.2.2 醋酸菌的发酵特性1.2.2.1 菌株生长曲线的测定
一级种子的培养:将在斜面保藏好的高产酸醋酸菌菌种分别取1环接种于装有5 mL种子培养基的试管中进行一级种子的培养,培养条件:在恒温振荡培养器中30 ℃、200 r/min振荡培养12 h。
生长曲线的测定:一级种子培养好后取出,接种于装有50 mL种子培养基的500 mL挡板锥形瓶中进行二级种子的培养,培养条件:在恒温振荡培养器中30 ℃、200 r/min振荡培养28 h。每隔2 h取一次样,然后用紫外分光光度计测定其OD600值,绘制生长曲线,在其对数生长期末期前用平板计数法测定其活菌数。
1.2.2.2 温度耐受能力的测定
对筛选得到的产酸能力较强的醋酸菌进行温度耐受能力的测定[11]。将菌种活化,在对数生长期接种于含50 mL发酵培养基的500 mL挡板锥形瓶中,菌液接种量为10%(体积分数),分别置于27,30,33,36,39,42 ℃ 6个不同温度条件下的恒温振荡培养器中培养,摇床转速为200 r/min,每隔12 h取一次样,用紫外分光光度计测定其在600 nm下的OD值并按照GB/T 12456-2008《食品中总酸的测定》方法测定其醋酸产量,直至稳定。
1.2.2.3 酒精耐受能力的测定
发酵培养基灭菌冷却后分别加入6%、7%、8%、9%、10%、11%、12% (V/V)的无水乙醇。对筛选得到的产酸能力较强的醋酸菌进行酒精耐受能力试验。将菌种活化,在对数生长期接种于含酒精量不同的50 mL发酵培养基的500 mL挡板锥形瓶中,菌液接种量为10%(体积分数),置于30 ℃、200 r/min的恒温振荡培养器中培养,每隔12 h取一次样,用紫外分光光度计测定其在600 nm下的OD值并按照GB/T 12456-2008《食品中总酸的测定》方法测定其醋酸产量,直至稳定。
1.2.2.4 乙酸耐受能力的测定
按比例配制发酵培养基,发酵培养基中分别加入0%、1%、2%、3%、4%、5%的乙酸。对筛选得到的产酸能力相对较强的醋酸菌进行乙酸耐受能力测定。将菌种活化,在对数生长期接种于含乙酸量不同的50 mL发酵培养基的500 mL挡板锥形瓶中,菌液接种量为10%(体积分数),分别置于30 ℃、200 r/min的恒温振荡培养器中培养,每隔12 h取一次样,用紫外分光光度计测定其在600 nm下的OD值并按照GB/T 12456-2008《食品中总酸的测定》 方法测定其醋酸产量,直至稳定。
1.3 统计学分析
除特殊说明外,对每个试验进行2次平行测定,利用Microsoft Office Excel 2010、Origin 9、MEGA 7.0软件进行数据计算和图谱制作。
2 结果与分析
2.1 醋酸菌的分离及鉴定
2.1.1 平板初筛菌落形态
醋醅经过富集后10倍梯度稀释,涂布平板,30 ℃恒温培养48 h后,平板上的菌落生长情况见图1。
图1 平板初筛菌落形态Fig.1 The colony morphology of plate primary screening
从此类型平板上选取溶钙圈较大、形态大小不一的5个单菌落进行平板划线,菌株编号依次为A1、A2、A3、A4、A5。
2.1.2 产酸定性试验
由于醋醅中微生物的多样性,所含菌相较为复杂,平板初筛并不足以判定筛选得到的一定是醋酸菌,因此对平板初筛得到的5株菌株进行产酸定性试验,得到相关试验结果见表2。

表2 产酸定性试验结果Table 2 The qualitative test results of acid production
由表2可知,A1、A2、A3、A4、A5菌株经培养后,菌液中和时都消耗一定量的氢氧化钠,能与三氯化铁共热生成红褐色沉淀。其中生成红褐色沉淀的现象是由于用氢氧化钠中和菌液后生成了相应的钠盐,该钠盐与三氯化铁共热反应,生成红褐色沉淀,表明试验的菌株是能产酸的细菌,经过培养后产酸使得菌液呈酸性,根据醋酸菌产酸定性试验的理论依据,可以初步判断这5株菌均为醋酸菌。
2.1.3 菌落形态及革兰氏染色
经过产酸定性获得的菌株,其平板菌落形态见图2,革兰氏染色镜检结果见图3。
由图2可知,各菌株在平板上的菌落形态为圆形,较小,表面光滑,边缘整齐,颜色为浅黄色,均符合醋酸菌培养的菌落形态特征。由图3可知,通过革兰氏染色镜检,各个菌株的细胞个体形态为椭圆或杆状,有单个分布、成对分布和成链状3种排列方式。革兰氏染色后细胞被染成红色,表明该菌为革兰氏阴性菌,符合醋酸菌的个体细胞的形态特征。综合以上产酸定性试验及革兰氏染色结果,根据醋酸菌的定义,可判定所得的菌株为醋酸菌。

图2 平板菌落形态Fig.2 The colony morphology on plate

图3 革兰氏染色结果Fig.3 The Gram staining results
2.1.4 菌株产酸能力测定
将所有试验菌株在含6%的发酵培养基中培养3 d,采用酸碱滴定法测定各菌株的产酸情况。由图4可知,A2菌株的产酸能力最强,为39.9 g/L,其次是A3菌株26.6 g/L和A5菌株21.3 g/L。而 A1菌株和A4菌株的产酸能力很弱,这不利于醋酸发酵生产,弃去。

图4 72 h后各菌株产酸情况Fig.4 The acid production of each strain after fermentation for 72 hours
2.2 醋酸菌的发酵性能测定
2.2.1 菌株生长曲线测定
由图5可知,A2菌株在0~6 h时的生长曲线较为平缓,此时菌种生长缓慢,处于生长延滞期;在6~24 h,A2菌株的生长曲线基本呈直线上升趋势,此时菌种生长繁殖很快,处于对数生长期;在24~28 h,A2菌株处于生长稳定期。A3菌株在0~12 h处于生长延滞期,在12~24 h处于对数生长期,在24~28 h处于生长稳定期。A5菌株在0~10 h处于生长延滞期,在10~24 h处于对数生长期,在24~28 h处于生长稳定期。且由图5可知,菌株A2的OD600菌体浓度显著大于菌株A3和A5,说明菌株A2的生长速度高于菌株A3和A5。24 h后菌体进入对数生长期末期,且最终菌株A2的菌体浓度明显高于菌株A3和A5。由此可知在后续的发酵试验中,A2菌株应选择在24 h接种发酵,此时菌体浓度和活性都是最高的,因此二级种子培养时间为24 h[12]。
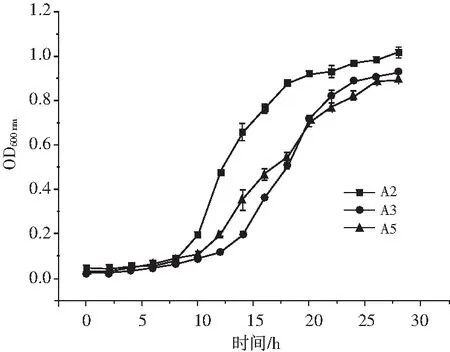
图5 各菌株的生长曲线Fig.5 The growth curves of each strain
2.2.2 乙醇耐受能力测定
筛选出的3株产酸较高的醋酸菌在不同乙醇含量下发酵,其生长情况及产酸情况见图6。
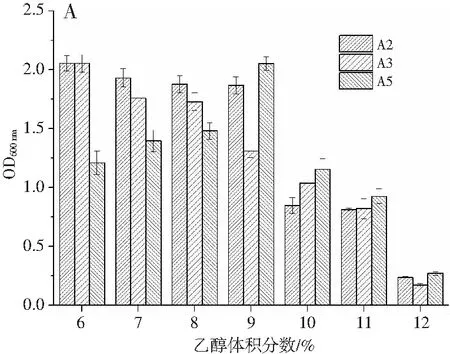
图6 乙醇含量对菌体生物量和产酸量的影响Fig.6 Effect of ethanol content on bacterial biomass and acid production amount注:A为菌体生长量,B为产酸量。
由图6可知,在乙醇含量不断增加的过程中,各菌株的产酸量均出现先上升后下降的趋势,对生长量也都有一定抑制。表明高浓度乙醇对各醋酸菌的生长均有一定程度的抑制作用,而一定体积分数的乙醇对产醋酸有利[13]。A2菌株在乙醇体积分数为7%时产酸量最大,为50.6 g/L。A5菌株在乙醇体积分数为8%时产酸量达到最高,为24.9 g/L。A3菌株在乙醇体积分数为9%时产酸量达到最高,为26.6 g/L,具有较好的乙醇耐受性。当乙醇体积分数为10%以上,所有菌株均受到抑制作用,这可能与乙醇抑制生长代谢有关。结合产酸量和生长量,综合分析得出A2菌株有更好的乙醇耐受性。
2.2.3 乙酸耐受能力测定
筛选出的3株产酸较高的醋酸菌在不同初始乙酸浓度下发酵,其生长情况及产酸情况见图7。
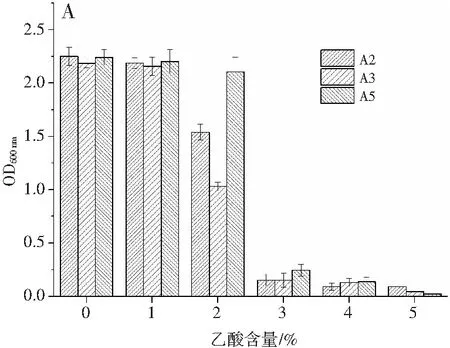
图7 乙酸含量对菌体生物量和产酸量的影响Fig.7 Effect of acetic acid content on bacterial biomass and acid production amount注:A为菌体生长量,B为产酸量。
由图7可知,在乙酸含量不断增加的过程中,3株醋酸菌均受到一定抑制,在乙酸含量为0%和1%的条件下,3株菌均具有较好的生长量。而A2菌株的产酸量最优,为39.9 g/L。随着酸度逐渐升高,所有醋酸菌的生长量和产酸量都受到一定的抑制,因为酸度过高的环境会影响菌体的生长和相关酶的活性,故醋酸菌的产酸能力和生长会受到抑制[14]。可以得出,A2菌株在乙酸体积分数为2%以下有较好的生长和产酸量。
2.2.4 温度耐受能力测定
温度耐受性试验结果见图8。

图8 培养温度对菌体生物量和产酸量的影响Fig.8 Effect of culture temperature on bacterial biomass and acid production amount注:A为菌体生长量,B为产酸量。
由图8可知,在一定的温度范围内(27~36 ℃),3株醋酸菌的生长和产酸均较稳定,36~42 ℃时,所有菌株的生长均趋于停滞,且产酸量较低。3株醋酸菌的最适宜培养温度均在30 ℃左右,其中A2菌株的产酸量最高,达39.9 g/L。A2菌株能耐受36 ℃的温度,随着温度不断升高,A2菌株的产酸量较为稳定。在一定的培养温度范围内,温度上升有利于醋酸菌的生长和代谢,而温度过高会导致醋酸菌的产酸能力降低,因此产酸下降。综合分析可知,A2菌株具有更好的温度耐受性。
2.3 16S rDNA的鉴定
2.3.1 基因片段提取和PCR扩增结果
PCR扩增产物经过凝胶电泳检测,在凝胶成像系统中的条带见图9,分别为Marker、A2菌株的琼脂糖凝胶电泳条带。
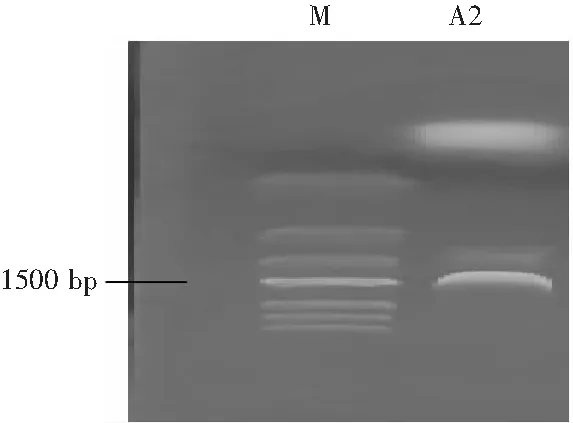
图9 醋酸菌A2的16S rDNA扩增基因片段Fig.9 The 16S rDNA amplified gene fragments of acetic acid bacterium A2
由图9可知,菌株在1500 bp附近出现亮条带。用通用型DNA纯化回收试剂盒纯化回收DNA并提交生物公司测序,构建系统发育树。
2.3.2 序列分析
醋酸菌A2的16S rDNA核苷酸序列:GCGACGTGTCGGTGCGTCTTGCGGTTCGCTCACCGGCTTAAGGTCAAACCAACTCCCATGGTGTGACGGGCGGTGTGTACAAGGCCCGGGAACGTATTCACCGCGGCATGCTGATCCGCGATTACTAGCGATTCCACCTTCATGCACTCGAGTTGCAGAGTGCAATCCGAACTGAGACGGTTTTTAGAGATCGGCACGATGTCGCCATCTAGCTTCCCACTGTCACCGCCATTGTAGCACGTGTGTAGCCCAGGACATAAGGGCCATGAGGACTTGACGTCATCCCCACCTTCCTCCGGCTTGTCACCGGCAGTCTCTTTAGAGTGCCCACCCAAACATGCTGGCAACTAAAGATAAGGGTTGCGCTCGTTGCGGGACTTAACCCAACATCTCACGACACGAGCTGACGACAGCCATGCAGCACCTGTGCAAGAGGTCCCTTGCGGGAAATATCCATCTCTGAATACAGCCTCTCCATACAAGCCCTGGTAAGGTTCTGCGCGTTGCTTCGAATTAAACCACATGCTCCACCGCTTGTGCGGGCCCCCGTCAATTCCTTTGAGTTTCAACCTTGCGGCCGTACTCCCCAGGCGGTGTGCTTATCGCGTTAGCTACGACACTGAGTAACTAAGTTACCCAACATCCAGCACACATCGTTTACAGCGTGGACTACCAGGGTATCTAATCCTGTTTGCTCCCCACGCTTTCGCGCCTCAGCGTCAGTAATGAGCCAGGTTGCCGCCTTCGCCACCGGTGTTCTTCCCAATATCTACGAATTTCACCTCTACACTGAGAATTCCACAACCCTCTCTCATACTCTAGTCTGCACGTATCAAATGCAGCTCCCAGGTTAAGCCCGGGGATTTCACATCTGACTGTACAAACCGCCTACACGCCCTTTACGCCCAGTCATTCCGAGCAACGCTAGCCCCCTTCGTATTACCGCGGCTGCTGGCACGAAGTTAGCCGGGGCTTCTTCTGCGGGTACCGTCATCATCGTCCCCGCCGAAAGTGCTTTACAATCCGAAAACCTTCTTCACACACGCGGCATTGCTGGATCAGGGTTGCCCCCATTGTCCAATATTCCCCACTGCTGCCTCCCGTAGGAGTCTGGGCCGTGTCTCAGTCCCAGTGTGGCTGATCATCCTCTCAGACCAGCTATTGATCATCGCCTTGGTAGGCCTTTACCCCACCAACAAGCTAATCAAACGCAGGCTCCTCCACAGGCGACTTGCGCCTTTGACCCTCAGGTATCATGCGGTATTAGCTCCAGTTTCCCGGAGTTATCCCCCACCCATGGATAGATTCCTACGCGTTACTCACCCGTCCGCCACTAAGGCCGAAGCCTTCGTGCGACTGCATGTGTATGAC。
选取菌株A2,对其16S rDNA基因进行部分测序。利用BLAST比对核苷酸显示,菌株A2的序列与Acetobacter属中编码为NBRC 14818的AcetobacteracetiNBRC 14818关系密切,相似度为99%。此外,为了解菌株A2与不同AAB物种之间的关系,采用Bootstrap分析(1000次重复)构建系统发育邻位连接树,见图10。
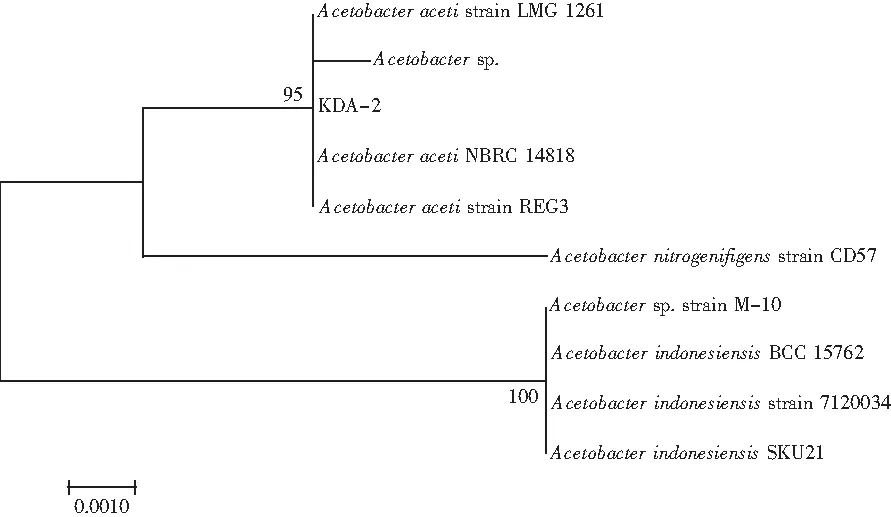
图10 基于16S rDNA基因序列的邻近连接法研究AAB物种和A2分离菌株的系统发育树Fig.10 The phylogenetic tree of AAB species and A2 separated strains studied by 16S rDNA gene sequence neighbour-joining method
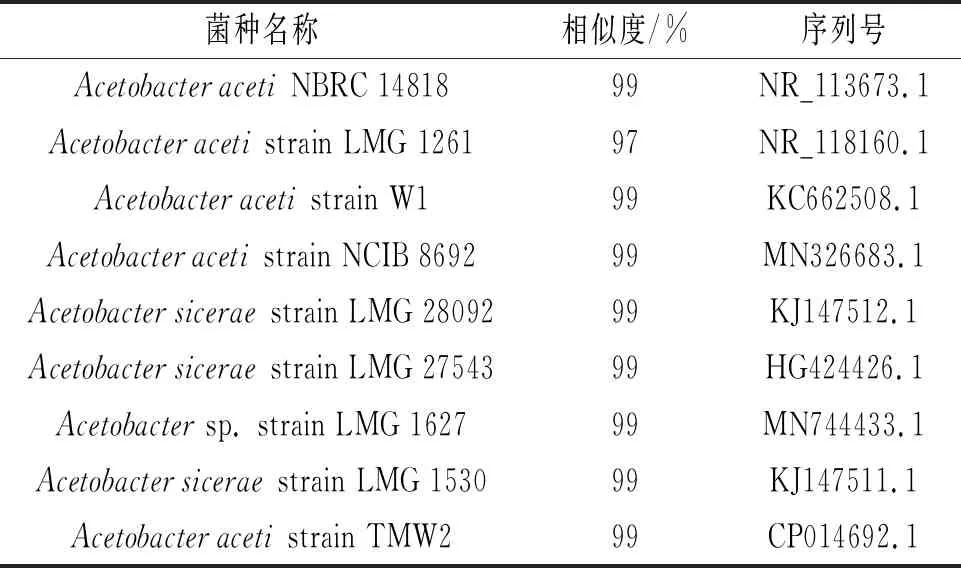
表3 醋酸菌A2的比对结果Table 3 The comparison results of acetic acid bacterium A2
2.3.3 系统进化树
系统进化树显示所筛选的菌株A2与AcetobacteracetiNBRC 14818等3株菌处在同一分支。通过进行BLAST比对,与参考菌株AcetobacteracetiNBRC 14818的相似度很高[15]。综合以上分析结果,得出筛选的A2菌株为醋酸杆菌属(Acetobacteraceti),并且命名为醋酸杆菌KDA-2(AcetobacteracetiKDA-2)。
3 结论
本试验以广西民间酿醋作坊的醋醅为菌种来源,采用平板分离法,经过初筛、复筛及3个耐性试验,最后分离筛选出了一株产酸能力较强以及温度耐受性能、乙醇耐受性能、乙酸耐受性能较好的醋酸菌KDA-2,其具有潜在的利用价值。该菌株的优良性能具体表现为:在30 ℃、180 r/min、6%乙醇体积分数下培养3 d醋酸产量可达39.9 g/L;能耐受36 ℃的温度,在30 ℃下生长量和产酸量达到最大值;能耐受9%(V/V)的乙醇,在7%的乙醇体积分数下产酸量和生长量达到最大值;能耐受2%(V/V)的乙酸。
