新辅助同步放化疗对直肠癌微环境浸润免疫细胞的影响
2021-09-10周春香蒋玉娜李镇江马进安
杨 群,周春香,韩 宸,张 颖,蒋玉娜,李镇江,马进安
中南大学湘雅二医院1临床护理学教研室,2肿瘤科,3胃肠外科,湖南 长沙410011
我国2018 年癌症报告显示,结直肠癌发病率居第3位,死亡率居第5位,且直肠癌发病率略高于结肠癌。直肠癌由于其特殊的解剖结构和位置,手术切除时技术难度大于结肠癌,其复发率也明显高于结肠癌,术后5年生存率为50%左右[1]。术前新辅助同步放化疗(CRT)是局部晚期直肠癌的标准治疗策略,20%~30%患者达到临床完全缓解[2],有5%~44%患者可达到病理完全缓解[3-5]。研究表明新辅助CRT后达到临床完全缓解的患者,观察-等待策略的生存数据不劣于根治性手术方案,观察等待组和手术组的3 年无复发生存率(88%vs78%)和总生存率(96%vs87%)无统计学差异[6]。直肠癌“新辅助CRT-观察-等待”的保肛策略越来越受到患者和医生的重视,但目前新辅助CRT的临床完全缓解率仅30%左右,限制了绝大部分直肠癌患者的这种临床选择。如何提高直肠癌新辅助CRT的完全缓解率是临床实施保肛策略急需解决的难题,免疫治疗联合新辅助CRT也许是一个很好的策略。
肿瘤微环境中浸润免疫细胞的数量和表型可在一定水平上预测PD-1/PD-L1单抗免疫治疗的疗效,富集免疫细胞的“热肿瘤”对免疫治疗更为有效[7,8]。放疗可以诱发肿瘤远隔效应说明其具有一定的免疫激活作用[7],但放疗对肿瘤浸润免疫细胞的影响一直存在争议。有观点认为放疗在杀伤肿瘤细胞的同时,还可以抑制淋巴细胞,削弱抗肿瘤免疫[9,10]。也有研究表明放疗可以增加肿瘤局部浸润免疫细胞从而调节免疫,肿瘤局部预先存在浸润免疫细胞也是免疫检控点抑制剂起效的前提[11]。大部分实体瘤内缺乏浸润免疫细胞,微环境处于免疫抑制状态,对PD-1/PD-L1单抗反应性欠佳,放疗可能是一个潜在的激发启动策略[7,8]。化疗也可诱导肿瘤局部CD8+T细胞的浸润,下调Treg细胞等抑制性免疫细胞[12,13]。理论上同步放化疗肿瘤杀灭能力增强,但新辅助CRT前后直肠癌微环境中浸润免疫细胞的数量和表型如何变化目前尚不明确。本研究拟采用免疫组织化学方法,检测直肠癌新辅助CRT前后活检与手术标本组织中肿瘤浸润免疫细胞(CD3、CD4、CD8、CD56、Foxp3)的数量和表型变化,前后自身对照比较分析新辅助CRT 对直肠癌免疫微环境的影响,以期为临床联合免疫治疗增效直肠癌新辅助CRT提供理论基础。
1 资料和方法
1.1 一般资料
本研究共纳入2016年1月~2018年12月于中南大学湘雅二医院确诊,新辅助CRT后接受直肠癌根治术的临床Ⅱ~Ⅲ期直肠癌患者20例。所有患者的术前活检与术后石蜡包埋组织标本均在病理科存档,排除术后病理完全缓解患者,均有完善的临床病理资料及随访资料,随访截止至2019年12月,详细临床资料见表1。其中男性15例,女性5例;年龄39~68岁,平均年龄52.9±8.5岁,中位年龄51岁;病理诊断均为直肠腺癌;病理组织学分级:高分化(G1)7 例(35%),中分化(G2)3 例(15%),低分化(G3)10例(50%);临床TMN分期:Ⅲ期17例(85%),Ⅱ期3例(15%);放疗模式:总剂量50 Gy/2.0 Gy/25F,所有患者均使用卡培他滨片(825 mg/m2,口服,2 次/d)同步化疗;16 例(80%)患者在新辅助CRT 前接受至少1 周期XELOX 方案化疗(奥沙利铂130 mg/m2,静脉滴注,d1+卡培他滨片1000 mg/m2,口服,2次/d,d1-d14,21 d重复);完成新辅助CRT与手术的间隔时间为43.5±17.6 d,中位数为38.5 d;新辅助CRT后肿瘤缩退分级(TRG)0级患者0例,TRG 1级患者4例(20%),TRG 2级患者6例(30%),TRG 3级患者10例(50%);其中17例患者为微卫星稳定型,3例患者为高频微卫星不稳定型;随访截止时有6例患者(30%)出现复发或转移,患者的无复发生存期为14~44月,理论中位无复发生存期为26.5月。
1.2 试剂
兔单克隆抗体CD3、CD4、CD8、CD56及鼠单克隆抗体FoxP3均购自福州迈新生物技术开发有限公司;ElivisionTM Plus二抗试剂盒购自福州迈新生物技术开发有限公司。
1.3 实验方法
所有直肠癌组织标本均经4%甲醛固定、石蜡包埋,5 μm厚连续石蜡常规切片脱蜡水化,抗原修复,内源性过氧化物酶的灭活,行免疫组织化学染色,具体操作步骤均按照试剂盒说明书进行。同时采用已知阳性片作阳性对照,采用PBS液替代相应一抗为空白对照。
1.4 结果判定
CD3、CD4、CD8、CD56主要以细胞膜和细胞浆出现黄色或棕黄色颗粒为阳性,FoxP3阳性则主要为细胞浆着色。先于低倍镜下观察着色细胞的均匀性,然后随机选取5个高倍镜视野(×200),计算标本的染色强度,未见染色记0分、淡黄色记1分、黄色记2分、棕褐色记3分。利用Image J软件分别计算出每个视野中可见的所有细胞面积和免疫组化染色呈阳性细胞的面积,以染色阳性细胞面积/视野中所有细胞面积=阳性细胞所占百分比,取5个视野的平均值为免疫组化染色的平均阳性率[14],0%~5%为0 分,6%~25%为1 分,26%~75%为2分,>75%为3分,染色强度、平均阳性率二者得分相乘得出总分,0~3分为低表达,4~9分为高表达。
1.5 统计分析
采用SPSS 23.0 软件对数据进行统计学处理,服从正态分布的配对样本均数的比较采用配对t检验,不服从正态分布的配对样本均数的比较采用Wilcoxon 符号秩检验。变量之间的相关性采用Pearson 相关性分析以及Spearman 相关性分析,多因素分析采用COX回归模型。以P<0.05 为差异有统计学意义。
2 结果
2.1 新辅助CRT前后CD3的表达情况
直肠癌新辅助CRT后CD3的平均阳性率较前显著增高[(21.8%±10.5%)vs(48.8%±16.3%)],差异有统计学意义(P<0.001,图1)。15例(75%)患者新辅助CRT后CD3阳性率较前升高。

图1 新辅助CRT前后CD3表达的变化Fig.1 Changes of CD3 expression before and after neoadjuvant CRT(P<0.001).
2.2 新辅助CRT前后CD4的表达情况
直肠癌新辅助CRT后CD4平均阳性率较前显著增高[(16.5±8.7)%vs(42.2±12.6)%],差异有统计学意义(P<0.001,图2)。18例(90%)患者CD4阳性率较前升高。
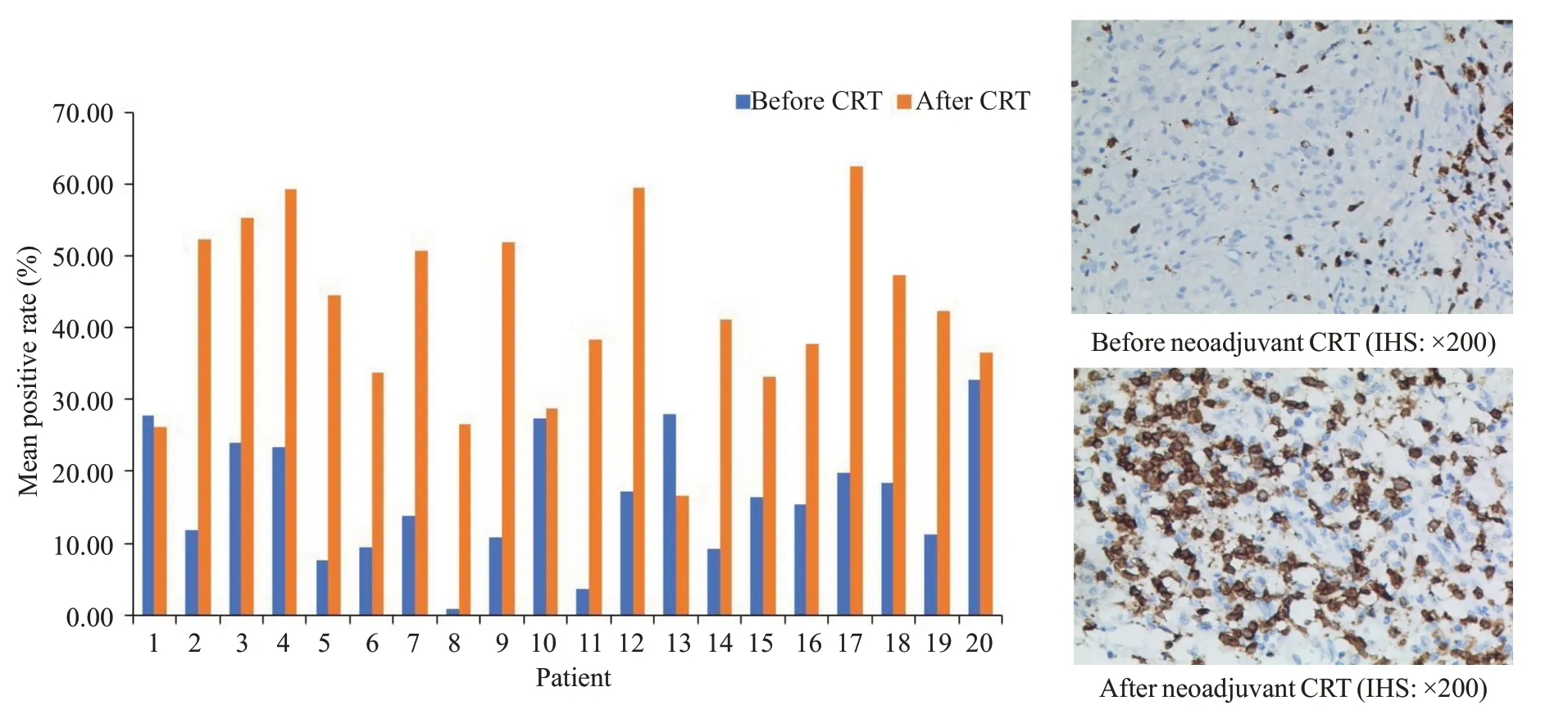
图2 新辅助CRT前后CD4表达的变化Fig.2 Changes of CD4 expression before and after neoadjuvant CRT(P<0.001).
2.3 新辅助CRT前后CD8的表达情况
直肠癌新辅助CRT后CD8平均阳性率较前显著升高[(8.3±6.8)%vs(33.4±20.7)%],差异有统计学意义(P<0.001,图3)。15 例(75%)患者新辅助CRT 后CD8阳性率较前升高。CD4/CD8平均比值在新辅助CRT 后较前升高[(2.7±2.3)%vs(5.1±12.8)%],但差异无统计学意义(P=0.075)。

图3 新辅助CRT前后CD8表达的变化Fig.3 Changes of CD8 expression before and after neoadjuvant CRT(P<0.001).
2.4 新辅助CRT前后CD56的表达情况
直肠癌新辅助CRT 后肿瘤组织中CD56 的平均阳性率较前明显升高[0vs(7.6±12.1)%],差异有统计学意义(P=0.012,图4)。所有患者新辅助CRT前CD56阳性率为0,6例(30%)患者新辅助CRT后CD56阳性率升高。
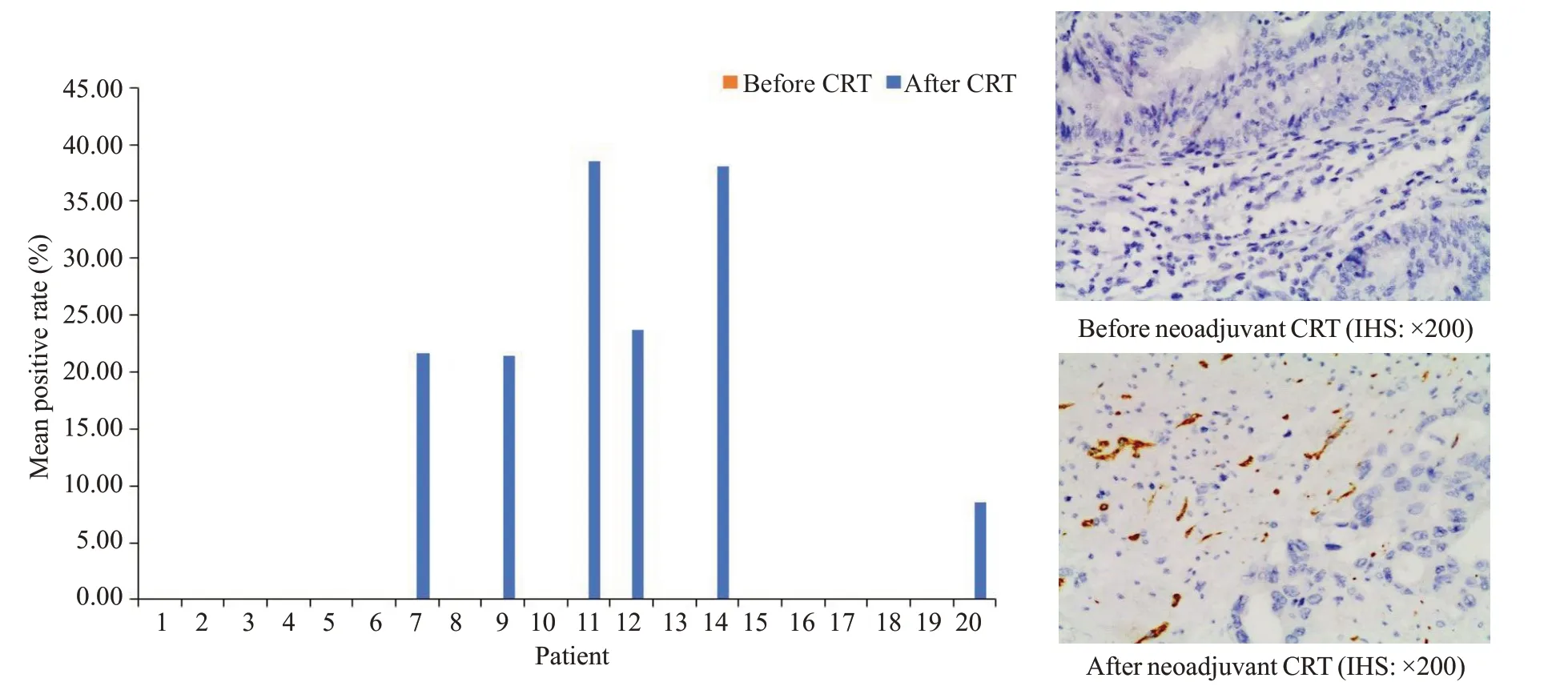
图4 新辅助CRT前后CD56表达的变化Fig.4 Changes of CD56 expression before and after neoadjuvant CRT(P=0.012).
2.5 新辅助CRT前后Foxp3的表达情况
直肠癌新辅助CRT后肿瘤组织中Foxp3平均阳性率较前显著下降[(26.0±21.5)vs(15.3±21.8)%],差异有统计学意义(P=0.005,图5)。13例(65%)患者新辅助CRT后Foxp3阳性率下降。

图5 新辅助CRT前后Foxp3表达的变化Fig.5 Changes of Foxp3 expression before and after neoadjuvant CRT(P=0.005).
2.6 新辅助CRT前后免疫标记物的变化与患者临床病理因素的相关性
新辅助CRT前后CD3和CD8表达升高的患者有着更长的无复发生存期,但CD4、CD56、Foxp3的表达变化与患者临床病理因素无显著相关性(表2、图6)。
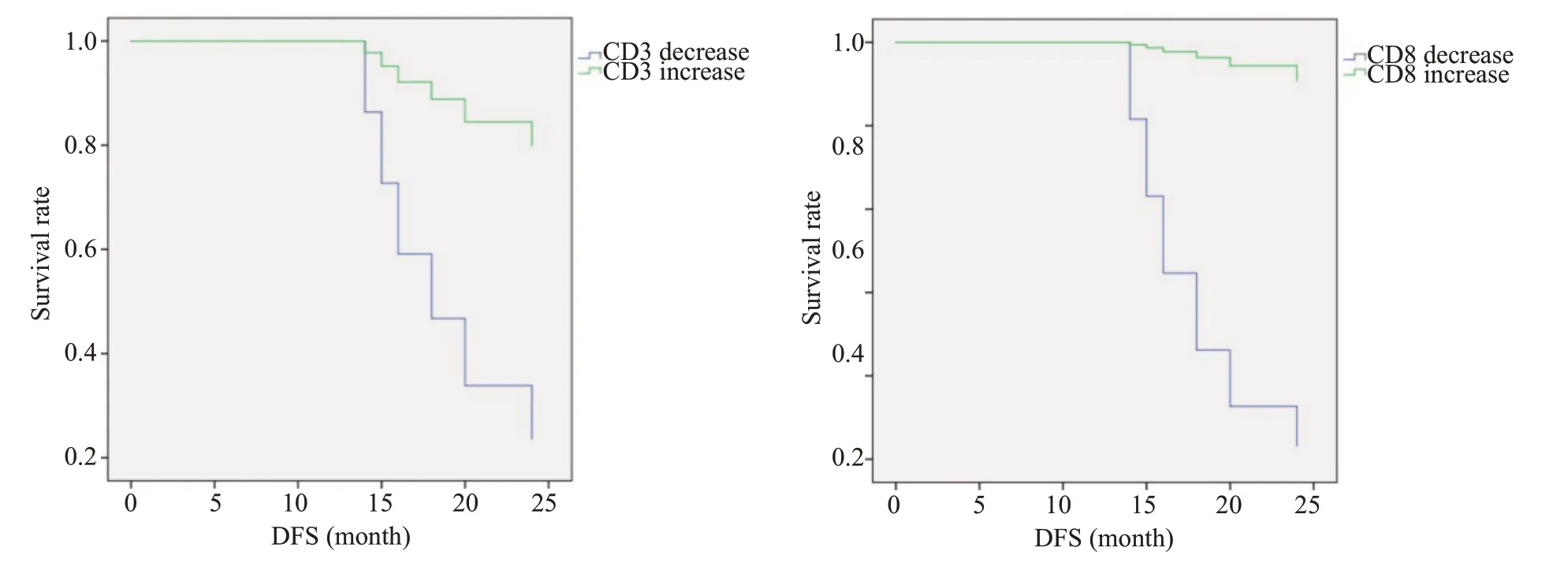
图6 CD3、CD8的变化与DFS的相关性Fig.6 Correlation of changes of CD3-(P=0.028) and CD8-positive cells (P=0.001) with disease-free survival of the patients,

表2 新辅助CRT前后免疫标记物的变化与DFS的多因素分析Tab.2 Multivariate analysis of the changes of immune markers and disease-free survival before and after neoadjuvant CRT
3 讨论
肿瘤组织中浸润免疫细胞不仅作用于肿瘤的发生发展,而且可以对肿瘤的治疗反应和预后产生影响。通过GEO数据库分析结直肠癌患者和健康人大肠组织中免疫细胞的浸润情况,发现肿瘤组织中浸润的T细胞和B细胞数量少于健康人,而肿瘤组织中浸润的巨噬细胞、中性粒细胞、肥大细胞和树突状细胞数量则大于健康人[15]。CD3主要表达在成熟T细胞表面,某种程度上反应T细胞的整体水平。CD4主要表达在辅助T细胞表面,CD4+T细胞主要在抗肿瘤免疫应答中起免疫监视作用,可通过释放溶细胞酶直接杀伤肿瘤细胞,也能通过调节肿瘤免疫微环境、增强B细胞和CD8+T细胞的活性间接杀伤肿瘤细胞[16,17]。CD8主要表达在细胞毒性T细胞表面,在肿瘤浸润免疫细胞中起主要杀伤作用。在炎症因子的趋化下,CD8+T细胞向肿瘤局部聚集,对肿瘤细胞进行识别和杀伤。
本研究发现新辅助CRT可以对直肠癌微环境浸润免疫细胞的数量和表型产生明显影响,增加术后直肠癌组织中CD3+T、CD4+T和CD8+T细胞的数量。尽管本研究的样本量偏少,但采用直肠癌新辅助CRT前后的活检标本、术后标本进行自身对照,所以得到的CRT对直肠癌微环境中免疫细胞影响的结果比较直接可靠,有一定临床意义。Ogura等18]研究了新辅助CRT前后直肠癌肿瘤组织中CD8+T细胞的变化,发现新辅助CRT后CD8+T细胞较治疗前明显升高。新辅助CRT通过杀灭肿瘤细胞,可增加肿瘤新抗原的表达与释放,从而促进炎症趋化因子募集免疫细胞来激活直肠癌局部的免疫效应。
本研究发现CD3+T、CD8+T细胞的增加与患者预后呈正相关,说明CD3+T、CD8+T细胞数量的变化可以作为评估直肠癌患者预后的潜在指标。荟萃分析证实头颈部鳞癌中CD3+T细胞的浸润预示良好的预后[19]。肿瘤微环境中CD8+T细胞的数量被认为可以预测直肠癌[20]、肛门癌[21]的预后。但CD4+T细胞浸润密度对肿瘤预后的影响与癌种相关,CD4+T 细胞在肺癌[22]、乳腺癌[23]中与预后不良相关,而在大肠癌患者中却是预后良好的因素[24],造成这种差异的原因可能是CD4+T细胞在不同肿瘤类型的免疫微环境中有着不同的功能。
NKT细胞兼具T细胞和NK细胞的特性,可以通过分泌溶细胞酶和细胞毒性因子并且以非MHC限制的方式杀伤肿瘤细胞[25]。胃癌、肺癌中高密度的NKT细胞浸润已被证实与患者的生存改善有关[26,27]。本研究新辅助CRT前肿瘤组织中CD56的表达均为阴性,提示NKT细胞在直肠癌组织中低表达。既往大样本结直肠癌肿瘤组织中,仅9%的患者发现了阳性NKT细胞[28],说明NKT细胞在结直肠癌组织中的浸润存在障碍。我们的研究发现新辅助CRT后,直肠癌组织中CD56的表达显著升高,表明CRT可以导致NKT细胞的瘤内浸润增加。
Foxp3作为一种关键的转录因子参与Treg细胞的分化与功能行使。Foxp3+Treg细胞被认为能抑制抗肿瘤免疫,肿瘤组织中Foxp3+Treg细胞的浸润往往提示预后不良[29-31]。本研究发现新辅助CRT能够显著降低直肠癌组织中Foxp3+Treg细胞的数量,说明CRT可以通过抑制Treg细胞表达调节肿瘤免疫微环境的抑制状态。
具有放疗史的非小细胞肺癌患者接受PD-1单抗治疗,其疗效是无放疗史人群的2倍[32],化疗联合PD-1单抗也能大幅提高其有效率[33],证实肺癌中放疗、化疗对PD-1单抗免疫治疗具有增效作用。本研究结果显示同步放化疗可以诱导直肠癌局部微环境中免疫细胞的募集,增加肿瘤浸润淋巴细胞水平,可以让直肠癌转化成“热肿瘤”。因此,PD-1/PD-L1 单抗免疫治疗在理论上支持增效直肠癌新辅助CRT,值得临床进一步探索。
