人骨形态发生蛋白-2/人胰岛素样生长因子-1对钛种植体表面细胞的成骨效率的影响
2021-09-10朱安棣钟惠兰李少萍杨晓喻
张 迪,邓 甜,罗 震,朱安棣,杨 勃,钟惠兰,李少萍,杨晓喻
1南方医科大学口腔医院种植科,广东 广州 510280;2中山大学附属第七医院口腔科,广东 深圳518107
钛(Ti)及其合金被广泛用作牙科和矫形领域的植入物,其成功植入取决于它们在功能上的初始骨整合和长期持久性,目前各种表面修饰,如激光照射,酸蚀刻等均是为了实现该目的[1-3]。近十年来,骨形态发生蛋白(BMP)家族的生长因子的被用于表面修饰,而且取得了较为良好的效果[4,5]。在这些BMP家族中,BMP-2因显著增强骨整合和骨形成受到了研究者的重点关注[6]。与BMP-2相比,人胰岛素样生长因子-1(IGF-1)较少被认为是增强骨形成的生长因子[7]。然而,有研究表明,IGF-1能通过促进骨祖细胞的增殖和分化,刺激骨基质形成和成骨细胞增殖,促进新生小鼠颅骨的RNA和胶原合成[8]。hBMP-2与hIGF-1两者都具有间充质干细胞成骨分化的能力,都可以促进骨细胞的增殖和骨细胞的形成[9]。单独将hIGF-1或hBMP-2作为种植体的表面修饰物,均能有效提高种植体植入受体后的成骨作用[10,11]。不管是BMP-2还是IGF-1,当这些生物分子单独存在于生物体内时,由于生物体内的酶降解作用,半衰期均较短,而导致骨形成不足[12]。此外,这些生物分子的局部过量表达,往往还可能诱导恶性肿瘤。为了克服这些缺点,研究者必须对这些生物分子进行表面修饰,例如壳聚糖、透明质酸、肝素等[13,14]。
肝素是高度硫酸化的糖胺聚糖和线性天然多糖,它与各种生长因子(包括BMP-2和IGF-1)具有结合亲和力[15,16]。肝素的Ti表面改性,能够增加这些生长因子的半衰期[17]。已有部分文献通过在Ti表面涂覆IGF-1、BMP-2来增强骨形成和骨整合的研究[18-20],但关于IGF-1,BMP-2二者联用对增强骨形成和骨整合的组合效应研究目前国内外尚未有报道。因此,本研究设计并制备了一种双层hBMP-2/hIGF-1涂层,检测其对增强骨形成和骨整合的功效,通过体外检测碱性磷酸酶(ALP)活性、钙沉积以及骨钙素与骨调素的表达,验证本研究设计的Ti表面修饰方法在临床应用中的可行性。
1 材料和方法
1.1 实验试剂与药品
醋酸地塞米松(DEX),β-甘油磷酸二钠盐水合物,抗坏血酸(Sigma);肝素12 000~15 000 g/mol(Thermo Fisher);胎牛血清(FBS)、DMEM培养基(Gibco);磷酸盐缓冲盐水(PBS)、青霉素-链霉素(PS)溶液(Sigma);4-(4,6-二甲氧基-1,3,5-三嗪-2-基)-4-甲基吗啉氯化物(DMT-MM)(Sigma);人骨形态发生蛋白-2(hBMP-2)、人类生长和分化因子-2(hIGF-1)及其ELISA试剂盒(广州赛业生物)。
1.2 制备hBMP-2/hIGF-1涂层的Ti表面
制备hBMP-2/Ti、hIGF-1/Ti和hBMP-2/hIGF-1/Ti(图1)。将原始Ti 片加入到2.5 mol/L NaOH 水溶液(500 mL)中,在80 ℃下连续搅拌48 h。在蒸馏水中超声处理5 min后,将Ti片用蒸馏水洗涤3次,并用氮气干燥,得到Ti-COOH。Ti-COOH在室温下用DMT-MM(1 mmol,27 mg)活化1 h。将肝素(1 mmol,10 mg)加入蒸馏水中与活化的Ti-COOH的混合后,在室温下反应3 d。用蒸馏水洗涤3次后,用氮气干燥Ti片,储存在充满氮气的干燥器中。将hBMP-2(50 ng),肝素(10 mg)和hIGF-1(50 ng)按顺序包被在PBS(40 mL,pH7.4)中的Ti片上,在4 ℃下反应24 h。用蒸馏水清洗Ti片3次后,用氮气将所得Ti片干燥,并储存在-20 ℃冰箱中待用。
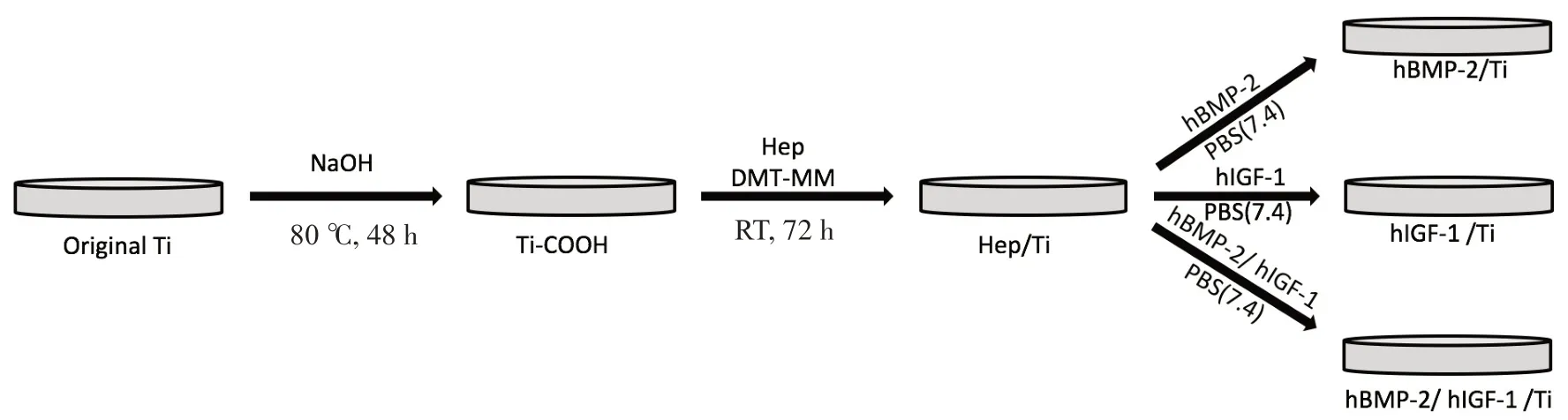
图1 hBMP-2/Ti,hIGF-1/Ti和hBMP-2/hIGF-1/Ti的制备技术路线Fig.1 Roadmap for preparing hBMP-2/Ti,hIGF-1/Ti and hBMP-2/hIGF-1/Ti materials.
1.3 扫描电镜观察Ti片表面形态
使用离子溅射涂布机(Eiko IB-3,Eiko Engineering Co.,Ltd,日本)对Ti 片包被金粉,通过SEM(S-2300,Hitachi,Japan)在15 kV下检查表面形态。
1.4 接触角测量
将水滴滴在样品膜上60 s后照相,通过软件测定照片中水滴的高度和水滴与膜接触面的直径,得到静态接触角,即膜的亲水性。每个样本重复检查3次,结果取均值。
1.5 MG63细胞系培养
将MG63细胞(国家实验细胞资源共享平台)在含有10%FBS和1%PS的200 μLDMEM的48孔板中在保持在37 ℃的加湿培养箱中培养并补充5%CO2。每3 d更换培养基。
1.6 体外细胞增殖率
将MG63细胞接种在Ti片上(5×103/孔),放置在培养板中,加入含有10% FBS 和1% PS 的DMEM,在37 ℃培养箱中培养3 d,之后加入10 μL/孔CCK8(碧云天),培养细胞4 h,充分显色后,收集样品,并根据制造商提供的试剂使用说明,在450 nm分光光度计下测定吸光度A450nm。每个样本重复检查3次,结果取均值。
1.7 ALP活性测定
将MG63细胞(1×105/孔)在具有成骨培养基(含有10%FBS,1%PS,10 mmol/Lβ-磷酸甘油磷酸二钠盐水合物,300 μmol/L抗坏血酸和0.1 μmol/L地塞米松)的培养板中接种在Ti片上,孵育3周后,用PBS(pH7.4)和放射免疫沉淀实验缓冲液(RIPA缓冲液,50 mmol/L三氯化氢pH7.4,150 mmol/L NaCl,0.25%脱氧胆酸,1%Nonidet P-40 清洗Ti片,并加入含有蛋白酶抑制剂混合物(Roche)的1 mmol/L乙二胺四乙酸(EDTA),将细胞在冰浴RIPA缓冲液中裂解20 min,将裂解物在4 ℃离心10 min去除细胞碎片。将上清液与对硝基苯基磷酸盐(PNPP)温育,通过加入50 μL的1 mol/L NaOH终止与PNPP的反应。采用酶标仪,通过在410 nm处测量PNPP向对硝基苯酚的转化率来确定ALP活性。每个样本重复检查3次,结果取均值。
1.8 茜素红S染色
将MG63细胞接种于Ti片上(1×105/孔),培养3周。用蒸馏水冲洗Ti片,将冲洗后的Ti片用3.7%甲醛固定20 min,再次冲洗。对于茜素S染色,根据试剂使用说明书,对细胞进行染色,之后,置于显微镜下观察并进行钙化结节计数。每个样本重复检查3次,结果取均值。
1.9 Western blot 检测Ti片表面MG63细胞蛋白表达
采用胶原酶消化Ti片表面MG63细胞,将消化收集到的细胞,用预冷的PBS 液,冲洗沉淀2 次。加入20 μL RIPA裂解液到EP管中(含有0.2 μL PMSF),冰上裂解30 min,细胞裂解充分后离心取上清并按照说明书操作进行总蛋白定量。SDS-PAGE电泳后PVDF膜转膜和孵育抗体,5%脱脂奶粉-TBS封闭,一抗1∶1500,室温,反应2 h。TBS洗涤PVDF膜5 min×5次,二抗1∶5000,室温,反应1 hTBS洗PVDF膜5 min×5次,化学发光,显影,定影。每个样本重复检查3次,结果取均值。
1.10 统计分析
使用SPSS 软件进行统计学分析,定量资料以均数±标准差表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,P<0.05为差异具有统计学意义。
2 结果
2.1 Ti片表面形态
制备经修饰后的Ti片后,采用扫描电镜观察Ti片表面形态显示,与hBMP-2/Ti、hIGF-1/Ti 和hBMP-2/hIGF-1/Ti 相比,在原始Ti 上观察到光滑的表面形态(图2)。而Ti片表面无论是经过hBMP-2、hIGF-1、或hBMP-2与hIGF-1组合处理,均能导致形成粗糙的Ti表面。然而三者之间表面形态并无明显区别。

图2 hBMP-2/Ti、hIGF-1/Ti和hBMP-2/HIGF-1/Ti形态Fig.2 Surface morphology of hBMP-2/Ti,hIGF-1/Ti and hBMP-2/hIGF-1/Ti samples under scanning electron microscope(Original magnification:×2000).A:Non-coated Ti sample.B:hBMP-2/Ti sample.C:hIGF-1/Ti sample.D:hBMP-2/hIGF-1/Ti sample.
2.3 水接触角
Ti样品的亲水性检测结果显示,与原始Ti相比,表面改性Ti 样品显示出较低的接触角,即用hBMP-2、hIGF-1和hBMP-2/hIGF-1实现了表面改性。原始Ti与hBMP-2/Ti(P=0.032)、hIGF-1/Ti(P=0.029)和hBMP-2/hIGF-1/Ti(P=0.028)的接触角差异有统计学意义(图3)。
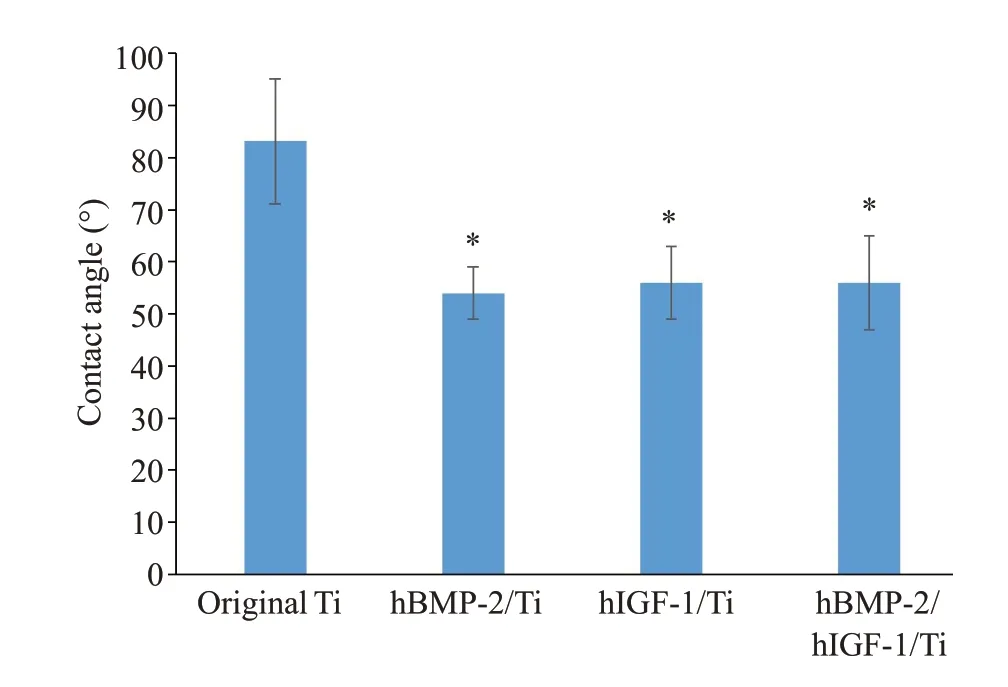
图3 原始Ti、hBMP-2/Ti、hIGF-1/Ti和hBMP-2/hIGF-1/Ti样品上的水接触角Fig.3 Contact angle of hBMP-2/Ti,hIGF-1/Ti and hBMP-2/hIGF-1/Ti samples.*P<0.05 vs original Ti.
2.4 修饰物对MG63细胞生长的影响
CCK8实验结果显示,培养hBMP-2/Ti、hIGF-1/Ti的MG63细胞,其增殖率相对于原始Ti没有显著差别(图4A),培养在hBMP-2/hIGF-1/Ti上的MG63细胞的细胞增殖率高于原始Ti。细胞ALP活性检测结果显示,培养在hIGF-1/Ti 和hBMP-2/hIGF-1/Ti 表面的细胞,相对于培养在原始Ti上的细胞,能分泌更多的ALP(P=0.021,P=0.014,图4B)。
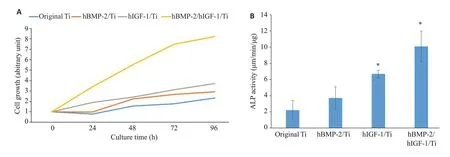
图4 修饰物对MG63细胞增殖的影响Fig.4 Effects of hBMP-2/Ti,hIGF-1/Ti and hBMP-2/hIGF-1/Ti on proliferation of MG63 cells.A:Growth curve;B:ALP activity.*P<0.05 vs original Ti.
2.5 修饰物对MG63细胞钙沉积的影响
与原始Ti 相比,培养在hBMP-2/Ti 和hBMP-2/hIGF-1/Ti 上的MG63 细胞产生了大量的钙沉积(P=0.006,P=0.002,图5A,B)。
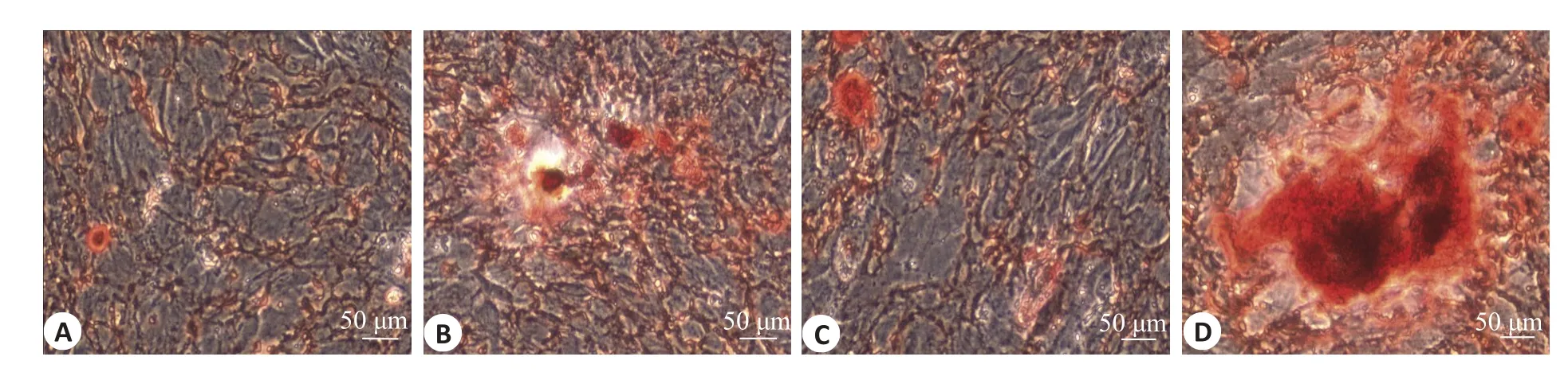
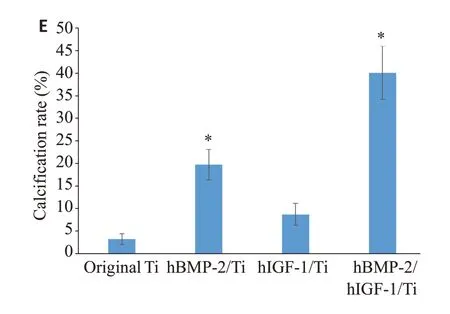
图5 hBMP-2/Ti,hIGF-1/Ti 和hBMP-2/hIGF-1/Ti对MG63细胞钙沉积的影响Fig.5 Effects of hBMP-2/Ti,hIGF-1/Ti and hBMP-2/hIGF-1/Ti on calcium deposition of MG63 cells.A:Original Ti.B:hBMP-2/Ti.C:hIGF-1/Ti.D:hBMP-2/hIGF-1/Ti (Alizarin Red S staining,×100);the red substance was calcified sediment.E:Calcified nodule count.*P<0.05 vs original Ti.
2.6 hBMP-2与hIGF-1能诱导MG63细胞骨钙素与骨调素的表达
Western blot结果显示,与培养在原始Ti上的细胞相比,培养在hBMP-2/Ti 和hBMP-2/hIGF-1/Ti 上的MG63 细胞骨钙素(hBMP-2/Ti:P=0.021;hBMP-2/hIGF-1/Ti:P=0.013)与骨调素(hBMP-2/Ti:P=0.017;hBMP-2/hIGF-1/Ti:P=0.008)的表达显著上调(图6)。
3 讨论
目前国内外有关钛种植表面修饰的研究,主要集中在种植体表面的物理或化学修饰,即通过喷砂或者酸蚀等理化作用,改变种植体表面宏观与微观形态[21-23]。这些理化修饰手段只能增加种植体的表面积,而无法解决钛种植体表面骨整合效率较低的问题。本研究在理化修饰的基础上,引入hIGF-1与hBMP-2基因修饰载体,能有效提高种植体表面的骨整合效率。在以往的报道中,有研究者在种植体表面通过静电吸附等方式在种植体表面固定基因载体[24],虽然在短期内也能诱导种植体表面骨形成,但仍然面临成本较高且半衰期短的问题。在本研究中,通过体外基因克隆技术获得了足量hIGF-1与hBMP-2基因修饰载体。研究表明,使用肝素可以降低BMP-2与其接头蛋白的结合,有效抑制其降解[25]。利用BMP-2的肝素结合位点结合BMP-2,并且肝素竞争性地抑制接头蛋白与成骨细胞的结合,能延长BMP-2的半衰期[26]。为了解决其半衰期短的问题,本研究对种植体表面进行肝素修饰,有效隔离了DNA降解酶的作用,从而提高了基因载体的表达效率。
钛种植体表面亲水性不高,不利于细胞的粘附生长。在本研究中,经过对钛种植体表面进行肝素改性后,显著降低了其表面的水接触角,从而提高了材料的亲水性。在以往的研究中,通常采用静电吸附将基因载体固定在壳聚糖表面,或者直接通过层层自组装吸附在种植体上,结合力都不够稳固。在种植体的动物实验中,因为扭力作用,容易使种植体表面的修饰物脱落[27,28]。而本研究利用肝素结合位点结合hIGF-1与hBMP-2分子,解决了基因载体结合不牢固的问题。以往的研究大多采用单一基因载体修饰种植体表面,因而骨整合效率并不高,而率先将hBMP-2/hIGF-1二者固定在种植体表面,结果表明,相对于不做任何处理的Ti片或加载hBMP-2或hIGF-1单一涂层的Ti片,在Ti片加载hBMP-2/hIGF-1涂层后能显著提高种植体表面MG63细胞的成骨效率。这一结果,不仅体现在茜素红S实验中的钙化结节数量上,在检测钙化相关的两个重要指标骨钙素与骨调素的表达水平上,也同样有这样的趋势。细胞是否成骨,在以往的口腔材料学研究中,一般是检测成骨相关蛋白的表达水平,而本研究通过茜素红S实验很直观的检测了MG63细胞的成骨作用[29]。通过成骨相关蛋白的表达水平检测以及茜素红S 实验结果发现,hIGF-1与hBMP-2的协同能显著诱导成骨细胞的增殖、成熟与钙化,而肝素的使用,又起到了缓释的作用。
因此,本研究设计的种植体材料,在控制成本的同时能有效地提高表面成骨效率,对今后的临床应用具有重要的指导意义。但本实验没有将材料应用于动物模型,因而具有一定的应用局限性,在将来的研究中,本课题组将进一步优化实验条件,将材料应用于动物实验,提高这一材料的应用价值。
