DR5介导的载多烯紫杉醇靶向脂质微泡联合超声靶向微泡破裂对人肝癌HepG2细胞凋亡及增殖的影响
2021-09-10吴小翎王志刚
杨 健,曾 妍,吴小翎,王志刚
1重庆医科大学附属第一医院消化内科,重庆 400016;重庆医科大学附属第二医院2精神心理科,3消化内科,重庆 400010;4重庆医科大学超声影像学研究所,重庆400010
近年来,超声分子影像学技术不断发展,为多种恶性肿瘤的诊治研究提供了新思路[1-3];超声微泡造影剂作为一种新型的药物和基因载体,在超声靶向微泡破裂技术(UTMD)辅助下可以提高靶细胞膜的通透性,增强药物和基因治疗的疗效[4-8];超声微泡造影剂还能通过靶向配体的修饰,从而实现个体化诊疗和精准医疗[9-13]。多烯紫杉醇能够干扰肿瘤细胞的有丝分裂,从而发挥抗肿瘤作用,但其水溶性差,且在临床应用中可能因为非靶组织的作用引起肺损伤等风险[14,15],因此,希望借助超声微泡造影剂作为靶向递送药物的载体,从而在增强疗效的同时降低非靶组织的损伤。国内外研究显示,Caspase-8,Bcl-2,NF-κB和DR5均在TRAIL介导的肿瘤细胞凋亡信号传导过程中发挥重要作用且相互作用关系密切[16-20];结合本课题组的前期研究发现,载药物的脂质超声微泡能够增强对肝癌细胞以及胰腺癌细胞的增殖抑制作用[21,22]、经抗DR5单克隆抗体(mAb)修饰的靶向载药超声微泡能进一步增强对人HepG2细胞的靶向结合和细胞增殖抑制作用[23];刘芬等[24]也发现将DR5mAb与载替加氟的高分子微球相连接后,可以提高载药物的高分子微球对人肝癌SMMC-7721细胞的主动靶向结合能力。在上述研究的基础上,为了探讨能否通过靶向载药微泡这种新型载体进一步增强人肝癌细胞增殖抑制和凋亡诱导作用的问题,本实验进一步研究DR5介导的载多烯紫杉醇靶向超声微泡联合UTMD对人肝癌HepG2细胞凋亡以及Bcl-2、NF-κB、Caspase-8、DR5蛋白表达的影响,为探讨载药物的靶向超声微泡在肝癌治疗方面的应用价值提供实验依据。
1 材料和方法
1.1 实验材料与主要仪器
1.1.1 实验材料 二棕榈酰磷脂酰乙醇胺、二棕榈酰磷酯酰胆碱、磷脂酸(Sigma);多烯紫杉醇(大连美仑有限公司);人肝癌HepG2细胞(中国科学院上海细胞库);胎牛血清(GIBCO);Cell Counting Kit-8、TUNEL细胞凋亡检测试剂盒(上海碧云天)、细胞周期检测试剂盒(南京凯基)、PCR试剂盒(宝生物);RT-PCR引物(华大基因);Bcl-2、NF-κB、Caspase-8、DR5抗体(Abcam)。
1.1.2 主要仪器 CGZZ型超声基因转染治疗仪(重庆医科大学超声影像研究所研制),YJT-银汞胶囊调和器(上海医疗器械股份有限公司),倒置荧光显微镜(Leica),酶标仪(Bio-Rad),流式细胞仪(BD),定量PCR仪(Bio-Rad),凝胶成像分析系统(Bio-Rad)。
1.2 实验方法
1.2.1 DLLM和DR5-DLLM的制备 按照前期研究的制备方法[23],采用机械振荡法和生物素-亲和素连接法制备空白微泡MBs、载药微泡DLLM和靶向载药微泡DR5-DLLM。在用于细胞试验前,上述3种微泡均于陆军军医大学辐照中心经60Co射线灭菌。
1.2.2 细胞分组和处理 取对数生长期的HepG2细胞,消化重悬后接种于细胞培养板,继续培养24 h待细胞贴壁,实验分为9组:空白对照组(Con),药物组(Drug),药物联合超声组(Drug+US),空白微泡组(MBs),空白微泡联合超声组(MBs+US),载药微泡组(DLLM),载药微泡联合超声组(DLLM+US),DR5介导的靶向载药微泡组(DR5-DLLM),DR5介导的靶向载药微泡联合超声组(DR5-DLLM+US))。每组设置3 个平行孔。Drug、DLLM、DR5-DLLM 以多烯紫杉醇IC50的药物浓度(5 nmol/L)给药;空白对照组加入0.5 mL生理盐水;超声以0.5 W/cm2的超声声强辐照45秒。
1.2.3 CCK-8法检测细胞毒性作用 分组处理各组细胞后,继续培养24 h,每孔加入10 μL CCK-8试剂,37 ℃培养箱中孵育3 h,用酶标仪在450 nm测定A值。
1.2.4 流式细胞术检测细胞周期 分组处理各组细胞后,继续培养24 h,PBS洗涤,消化离心,将细胞悬液逐滴加入到预冷的95%乙醇中,在滴加的同时充分振荡混匀,离心,弃上清液,在每份样品中加入0.5 mL5 μg/mL的PI染料(含RNase),充分吹打混匀,移至流式检测管中,4 ℃避光染色30 min后在流式细胞仪中检测,激发波长488 nm。
1.2.5 TUNEL检测细胞凋亡 分组处理各组细胞后,培养24 h,室温下在4%多聚甲醛中固定1 h。PBS洗涤,在4 ℃用0.1%Triton X-100处理细胞5 min。PBS洗涤,各孔滴加50 μL新鲜配制的TUNEL反应液,于37 ℃湿盒中反应1 h。PBS洗涤,每孔加入0.01 mg/mL DAPI缓冲液50 μL,在室温黑暗环境中作用5 min。PBS洗涤后,在荧光显微镜下拍照。
1.2.6 RT-PCR 检测Bcl-2、NF-κB、Caspase-8、DR5 的mRNA表达水平 分组处理各组细胞后,继续培养24 h,提取RNA。PCR引物序列如下:(1)BCL-2上游5'-CG ACTTCGCCGAGATGTCCAGCCAG-3',下游5'-ACT TGTGGCCCAGATAGGCACCCAG-3';(2)Caspase-8上游5'-CTACCAACTCATGGACCACAG-3',下游5'-GATGTACCAGGTTCCCTCTGC-3';(3)DR5 上 游5'-AAGACCCTTGTGCTCGTTGT-3',下 游 5'-GACACATTCGATGTCACTCCA-3';(4)NF-κB上游5'-ACTGTGTGACAAGGTGCAGAAAGAG-3',下 游5'-CTGCTGAAACTCGGAGTTGTCGAC-3';(5)GAPDH上游5'-GGAGTCCACTGGCGTCTTCA-3',下游:5'-CTGCTTCACCACCTTCTTGA-3'。完成PCR后,取样品5~10 μL,上样至1%琼脂糖胶,100V 电泳10~15 min,在紫外灯下观察电泳结果并利用成像系统拍照记录。
1.2.7 WB检测Bcl-2、NF-κB、Caspase-8、DR5的蛋白表达水平 分组处理各组细胞后,继续培养24 h,裂解细胞,收集蛋白。SDS-PAGE凝胶电泳分离蛋白,电转至PVDF膜上,封闭,漂洗,加入一抗,轻摇过夜,洗涤后加入二抗,室温下轻摇2 h,洗涤后加入ECL反应液,显影,拍照。测定各条带灰度值,以GAPDH为内参,结果以各检测目的蛋白与GAPDH的灰度值的比值表示。
1.2.8 统计学处理 计量资料均以均数±标准差表示,应用SPSS 22.0统计软件和Microsoft Excel 2016等进行统计分析,计量资料组间比较用单因素方差分析,两两比较采用LSD法,以P<0.05为差异有统计学意义的标准。
2 结果
2.1 CCK-8法检测细胞毒性结果
CCK-8检测结果如图1所示,结果表明Drug组,Drug+US 组,DLLM+US 组,DR5-DLLM+US 组对HepG2 细胞增殖有明显的细胞毒性作用,在4 者中,DR5-DLLM+US组的细胞毒性作用明显强于其他3组(P<0.001);MBs组、DLLM组、DR5-DLLM组和Con组之间差异无统计学意义(P>0.05,分别为0.63,0.29,0.28)。
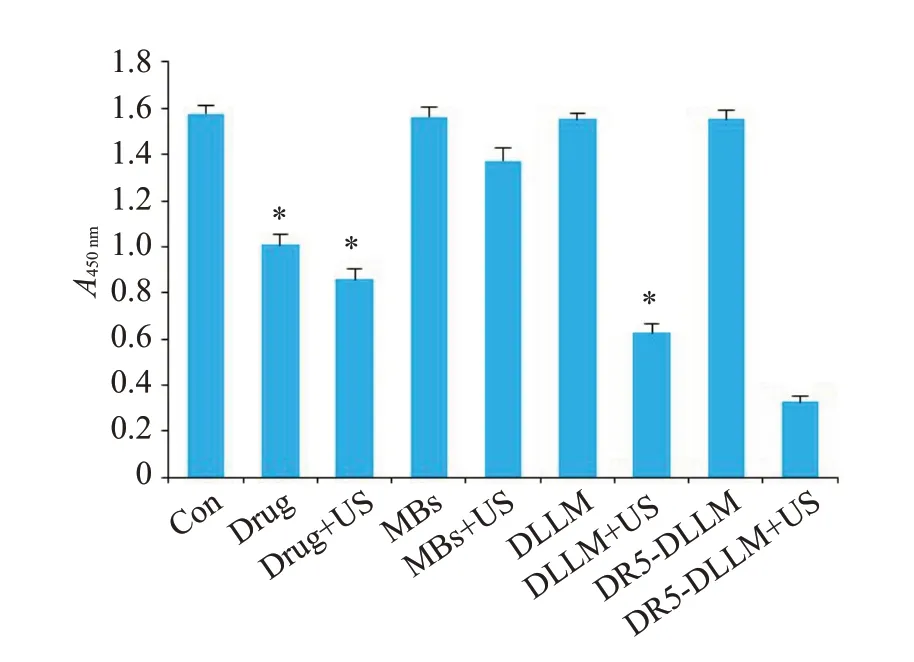
图1 CCK-8检测各处理组对HepG2细胞的毒性作用Fig.1 Cytotoxic effects of different treatments in human HepG2 cells detected by CCK-8 assay.*P<0.001 vs DR5-DLLM+US group.
2.2 流式细胞术检测细胞周期
流式细胞术检测细胞周期分布结果如图2所示,与其他组相比,DR5-DLLM+US组的G2/M周期阻滞作用最强,与其他组比较差异有统计学意义(P<0.001)。
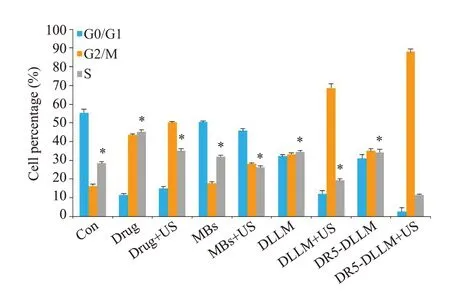
图2 流式细胞术检测人肝癌HepG2细胞周期Fig.2 Cell cycle distribution of HepG2 cells following different treatments detected by flow cytometry.*P<0.001 vs DR5-DLLM+US group.
2.3 TUNEL检测细胞凋亡结果
TUNEL检测细胞凋亡结果如图3所示,Drug组,Drug+US组,DLLM+US组,DR5-DLLM+US组均可见不同数量的凋亡细胞,其中DR5-DLLM+US组凋亡指数最高,与其他组之间的差异有统计学意义(P<0.001);MBs组、DLLM组和Con组相比较,差异无统计学意义(P值分别为0.99,0.72)。
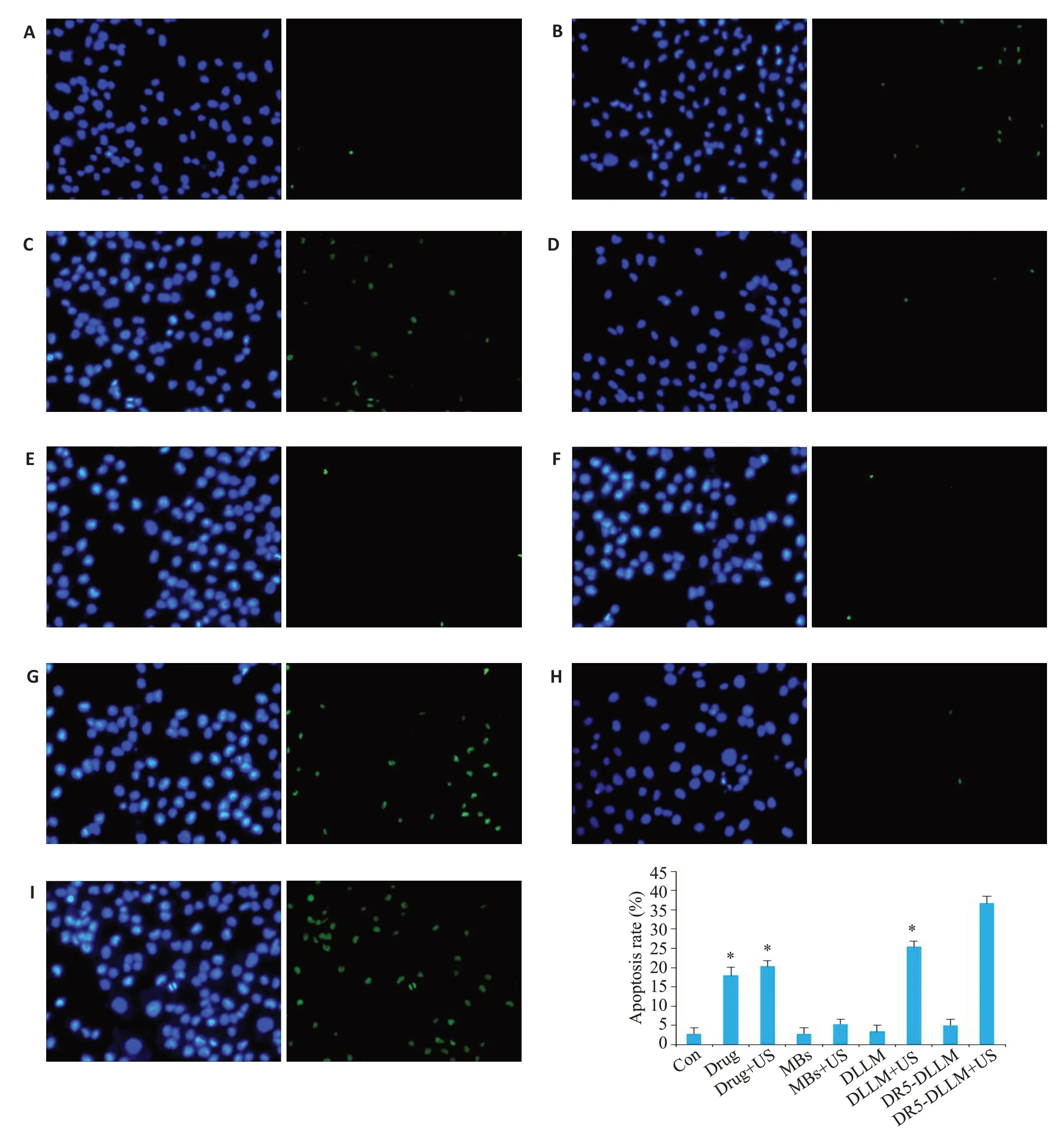
图3 TUNEL检测细胞凋亡Fig.3 Cell apoptosis following different treatments detected by TUNEL assay.A:Con.B:Drug.C:Drug+US.D:MBs.E:MBs+US.F:DLLM.G:DLLM+US.H:DR5-DLLM.I:DR5-DLLM+US.J:Apoptosis index detected by TUNEL assay.*P<0.001 vs DR5-DLLM+US group.
2.4 RT-PCR 检 测Caspase-8、DR5、NF-κB、Bcl-2 的mRNA表达水平
RT-PCR 检测结果如图4 所示,与其他组相比,DR5-DLLM+US组的Caspase-8、DR5的mRNA水平上调,Bcl-2和NF-κB水平下调(P<0.001)。MBs组、DLLM组、DR5-DLLM 组和Con 组相比较,Bcl-2 的mRNA表达水平差异无统计学意义(P>0.05,P值分别为0.30,0.25,0.52)。
2.5 Western blot检测Caspase-8、DR5、NF-κB、Bcl-2的蛋白表达水平
Western blot检测结果如图5所示,与其他组相比,DR5-DLLM+US组的Caspase-8、DR5蛋白表达水平上调,Bcl-2和NF-κB表达下调(P<0.001)。MBs组、DLLM组、DR5-DLLM组和Con组相比较,DR5的蛋白表达差异无统计学意义(P>0.05,P值分别为0.13,0.10,0.15)。
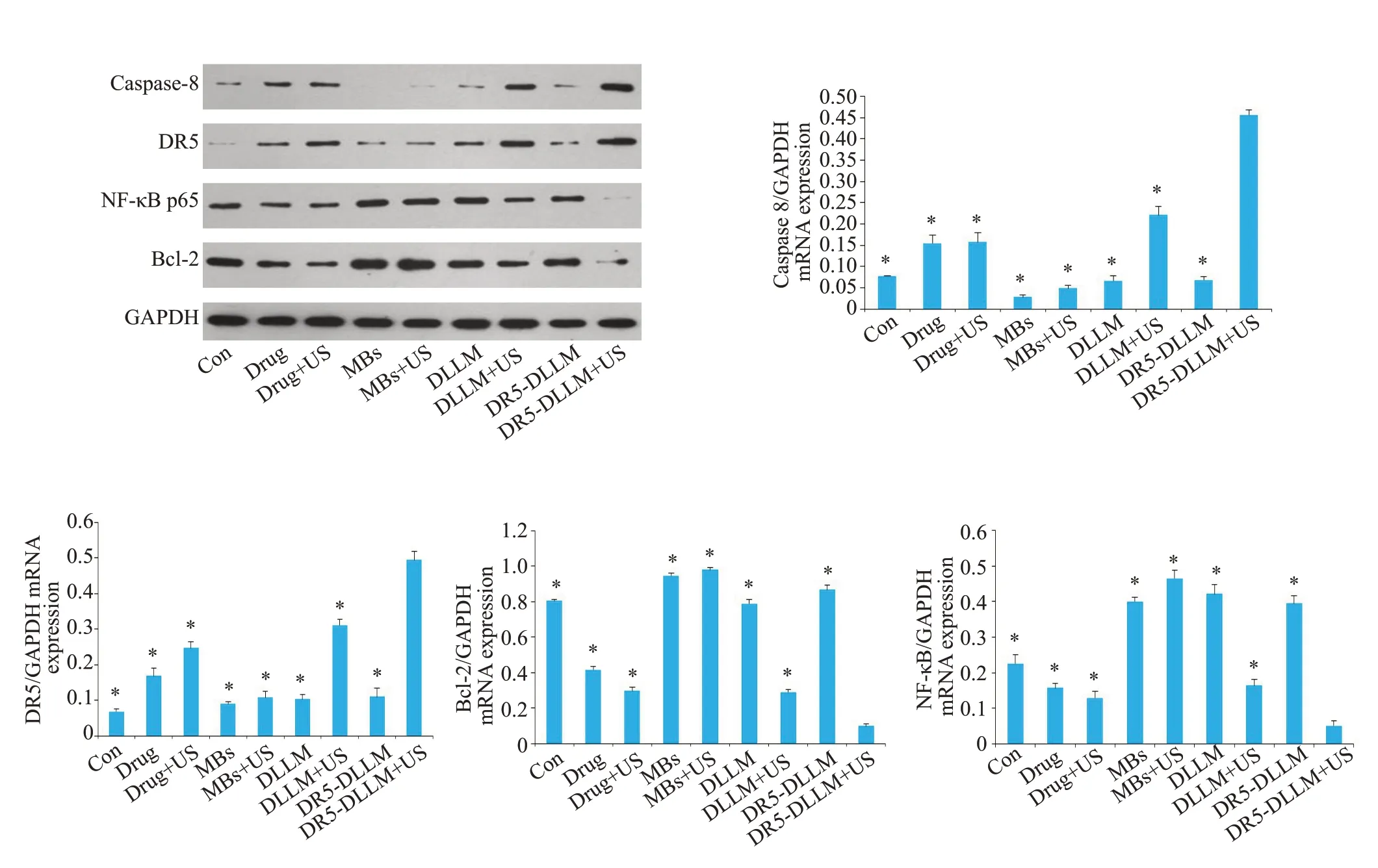
图5 Western blot检测Caspase-8、DR5、NF-κB和Bcl-2的蛋白表达Fig.5 Protein expressions of caspase-8,DR5,NF-κB and Bcl-2 detected by Western blotting.*P<0.001 vs DR5-DLLM+US group.
3 讨论
本研究在课题组前期研究的基础上,在国内首次探讨了DR5介导的载多烯紫杉醇靶向微泡联合超声靶向微泡破裂技术对人肝癌HepG2细胞增殖抑制和凋亡诱导的作用,并探讨了与肿瘤细胞增殖、凋亡诱导作用密切相关的Caspase-8,Bcl-2,NF-κB,DR5的mRNA和蛋白表达变化情况。本研究显示,相对于仅使用多烯紫杉醇药物、或者使用没有靶向结合能力的载多烯紫杉醇微泡,DR5靶向载多烯紫杉醇微泡组联合超声靶向微泡破裂技术的抗肿瘤作用明显增强,因此,有望为新型靶向超声造影剂的研制及其在肿瘤诊治领域的临床应用提供研究思路和实验数据。国内外研究文献[18-20,26-28]显示,通过调节Caspase-8,Bcl-2,NF-κB和DR5表达,可以抑制多种肿瘤细胞增值、促进肿瘤细胞凋亡,本研究在上述研究的基础上证实了新型靶向载药微泡联合超声靶向微泡破裂技术可以进一步增强对上述Caspase-8,Bcl-2,NF-κB,DR5的mRNA和蛋白表达调控作用,从而显示出更强的肿瘤细胞增值抑制、凋亡诱导和G2/M细胞周期阻滞作用,且上述作用经本研究证实明显强于单独使用抗肿瘤药物、超声靶向微泡破裂技术、以及非靶向的载药超声微泡等干预方式。通过靶向超声造影剂作为药物的靶向载体、超声靶向微泡破裂技术作为靶向释放和增强疗效的工具这种创新的治疗方式,药物的抗肿瘤作用效果得到了有效的增强;该方式还可以用于某些难治性肿瘤的治疗,改善肿瘤耐药、增强TRAIL介导的肿瘤细胞凋亡作用[29,30],因此是一种新型、有效的超声靶向治疗载体,并有望为改善肝癌治疗效果提供新的研究思路。
在本研究中我们还发现,在没有超声靶向微泡破裂技术参与的情况下,空白微泡组、载药物微泡组、DR5靶向载药微泡组和对照组之间的细胞增殖抑制和凋亡诱导作用无显著性差异。这说明DR5靶向载药微泡作用的发挥离不开超声靶向微泡破裂技术的参与:一方面是因为通过超声靶向微泡破裂技术,微泡造影剂内部的气体发生破裂瞬间产生空化效应、并在靶位置附近产生“微声流”、“射流”,能够在人肝癌HepG2细胞膜上产生可逆性的小孔,提高细胞膜对药物的通透性,实现对肿瘤细胞的靶向治疗;另一方面是由于我们构建的DR5靶向载多烯紫杉醇微泡时使用的全氟丙烷气体,是可以用于生产具有高稳定性超声微泡、从而实现超声成像和药物递送的理想气体成分[31]。同时我们也认识到,要将课题组研制的靶向载药物超声微泡应用于肝癌的临床诊疗过程还需要进一步优化和验证靶向微泡在体内的稳定性、安全性等诸多问题,这些都将是我们后续研究的方向。
综上所述,DR5 介导的载多烯紫杉醇靶向脂质微泡联合超声靶向微泡破裂技术能够通过下调Bcl-2和NF-κB表达、上调Caspase-8和DR5表达,增强对人HepG2 细胞的增殖抑制、凋亡诱导和细胞周期阻滞作用。
