海藻酸钠/壳聚糖气凝胶对酸面团来源植物乳杆菌的包埋分析
2021-09-09邓伶俐刘松奇安建辉谭林立
邓伶俐,刘松奇,易 顺,安建辉,,谭林立
(1 湖北民族大学生物科学与技术学院 湖北恩施 445000 2 生物资源保护与利用湖北省重点实验室 湖北恩施 445000 3 超轻弹性体材料绿色制造民委重点实验室 湖北恩施 445000)
植物乳杆菌(Lactobacillus plantarum)是乳酸菌的一种,具有调节肠道微生态,降低血清胆固醇水平以及降低心血管疾病发病率等功效[1]。研究表明,从酸面团中提取得到的植物乳杆菌T17 能够增加肠道菌群的β-多样性,减缓体重增加,优化血脂和细胞因子参数[2]。为使植物乳杆菌在加工和储藏过程中保持较高的生物活性,通常采用包埋的方式提高其稳定性。益生菌采用微胶囊包埋方式,通常以天然高分子或合成高分子为壁材[3]。海藻酸钠是一种廉价、生物相容性高的益生菌包埋壁材,其形成的离子型胶体在低酸环境下稳定,能够增强菌体对胃酸的耐受性[4]。然而,也有研究认为海藻酸钠胶体结构的孔径较大,不能有效限制胃液的渗透,因此通常将海藻酸钠与其它不同壁材混合复配使用,提高益生菌在胃肠道的稳定性[5-6]。已有研究表明,海藻酸钠气凝胶可用于花青素缓释[7],由于气凝胶具有较大的比表面积,能够作为益生菌的有效载体。目前关于植物乳杆菌微胶囊包埋的方法集中于壁材和组装过程方面,而关于以乳液为模板进行层层自组装方面的探索较少。1991年,Decher 提出基于静电作用的层层自组装概念[8]。层层自组装法(Layer-by-layer selfassembly,LBL)是指带有相反电荷的壁材在带电模板上交替沉积[9]。本文研究以乳液为模板的海藻酸钠气凝胶通过层层自组装吸附壳聚糖后对植物乳杆菌的包埋效果。通过红外光谱分析各组分间的相互作用。通过扫描电子显微镜观察气凝胶表面及植物乳杆菌,并评价其储存稳定性和胃肠道稳定性,为酸面团来源的植物乳杆菌包埋提供理论基础。
1 材料与方法
1.1 材料与仪器
植物乳杆菌T17,实验室研究人员从酸面团分离后保藏菌种;海藻酸钠、壳聚糖、胃蛋白酶、胰蛋白酶、胆盐,阿拉丁试剂有限公司;氯化钙、氯化钠,国药化学试剂有限公司。MRS 肉汤、MRS 培养基、TSB 培养基、TSA 培养基,杭州微生物试剂有限公司。
高压灭菌锅,上海申安医疗器械;170-SX 傅里叶红外光谱仪,美国Nicolet 公司;SU8010 扫描电子显微镜,日本Hitachi 公司;厌氧培养箱,上海跃进医疗器械。
1.2 菌种培养
菌种选用实验室从酸面团中分离得到的植物乳杆菌T17 (L.plantarum ZJUFT17,CCTCC No.M2017342)。挑取固体培养基上的单菌落接种于MRS 液体培养基中,37 ℃厌氧培养箱中培养24~48 h,按2%接种量活化传代2 次后备用。
1.3 气凝胶制备
含植物乳杆菌的气凝胶制备如图1所示。取活化好的植物乳杆菌T17 菌液(约1010CFU/mL)1 mL,离心摒弃上清液,用100 μL 生理盐水重悬,然后加入到10 mL 20 g/L 海藻酸钠的水溶液中,用1 mL 注射器通过32 G 针头匀速挤入到0.1 mol/L CaCl2水溶液中,静置固化1 h 后冻干,得到含植物乳杆菌的海藻酸钠气凝胶(AL)。将静置固化后的海藻酸钠用无菌生理盐水清洗2 遍后加入到含4 g/L 壳聚糖水溶液中进行自组装吸附,吸附2 h 后过滤冻干得到气凝胶ALC(图1a)。
取活化好的植物乳杆菌T17 菌液 (约1010CFU/mL)4 mL,离心摒弃上清液后用400 μL 生理盐水重悬,然后加入到乳化准备液中(0.4 g 乳清分离蛋白,2.0 g 玉米油,17.2 g 水),在高速均质机作用下(12 000 r/min)剪切5 min 后将乳液与40 g/L 海藻酸钠以体积比1∶1 混合,用1 mL 注射器通过32 G 针头匀速挤入到0.1 mol/L CaCl2水溶液中,静置固化1 h 后冻干,得到含植物乳杆菌的海藻酸钠气凝胶(EA)。将静置固化后的海藻酸钠用无菌生理盐水清洗2 遍后加入到含4 g/L 的壳聚糖水溶液中进行自组装吸附,吸附2 h 后过滤冻干得到气凝胶EAC(图1b)。

图1 层层自组装制备海藻酸钠/壳聚糖气凝胶示意图Fig.1 The schematic illustration of the preparation of lay-by-lay self-assembly sodium/chitosan aerogel
1.4 红外光谱测定分子相互作用
根据上述步骤制备不含植物乳杆菌的气凝胶颗粒用于红外光谱测定,采用傅里叶变换衰减全反射法进行红外光谱扫描,扫描范围4 000~400 cm-1,分辨率4 cm-1,累加32 次,以空气为背景,每次扫描前扣除背景。
1.5 气凝胶微观形态观察
将冻干后的AL、ALC、EA 和EAC 颗粒进行表面喷金处理,利用扫描电子显微镜观察其表面形态。将含有植物乳杆菌的气凝胶加入2.5%戊二醛溶液固定过夜,然后按如下流程进行样品前处理:磷酸缓冲液洗涤3 次后采用锇酸浸泡样品1.5 h,使用磷酸缓冲液洗涤3 次,采用乙醇梯度脱水(30%,50%,70%,85%,90%,100%乙醇各一次),真空干燥后表面喷金处理,利用扫描电镜观察气凝胶内的植物乳杆菌。
1.6 贮藏与消化稳定性
将按照图1制备得到的包埋植物乳杆菌T17的AL、ALC、EA 和EAC 颗粒在冻干前和冻干后进行单位质量菌落总数的计数。每种样品取10 颗称重,加入10 mL 生理盐水,均质分散,使植物乳杆菌充分释放出来,稀释后加入MRS 固体培养基中,37 ℃厌氧培养后计数。将冻干后的菌粉、ALC和EAC 储存于4 ℃和-20 ℃条件下,每隔7 d 取样测定菌量。
按照Li 等[10]的方法进行模拟胃肠液的制备。模拟胃液:NaCl 8.5 g/L,胃蛋白酶3 g/L,用1 mol/L HCl 调整pH 值为2.0,0.45 μm 滤膜过滤除菌备用。取加入100 μL 原菌液或者10 颗上述 (图1)制备的颗粒加入到10 mL 的人工胃液中,37℃、200 r/min 振荡厌氧培养2 h 模拟胃液消化后测定植物乳杆菌菌量,计算模拟胃液消化存活率。
将100 μL 原菌液或者10 颗上述(图1)制备的颗粒加入到10 mL 的人工胃液中,37 ℃200 r/min 振荡厌氧培养2 h 后加入100 μL 1 mol/L NaHCO3使体系pH 值为7.0。加入100 μL 300 g/L的胆酸和100 μL 100 g/L 的胰蛋白酶,37 ℃、200 r/min 振荡厌氧培养4 h 模拟肠道消化后测定植物乳杆菌菌量,计算模拟胃肠液消化存活率。按照公式(1)计算存活率。
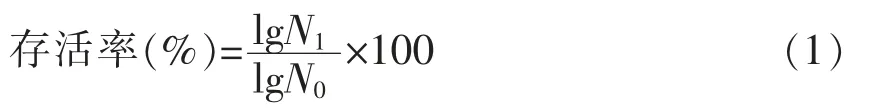
式中,N0——处理前的活菌菌落数,CFU/mL;N1——用人工胃肠液处理过的活菌菌落数,CFU/mL。
2 结果与讨论
2.1 分子相互作用分析
图2a 为海藻酸钠、壳聚糖和乳清分离蛋白的红外光谱图,图2b 为海藻酸钠气凝胶(AL)、海藻酸钠/壳聚糖气凝胶(ALC)、乳液模板海藻酸钠气凝胶(EA)和乳液海藻酸钠/壳聚糖气凝胶(EAC)红外光谱图。图2a 中海藻酸钠红外光谱中3 405 cm-1处的宽吸收峰是由-OH 伸缩振动引起的,2 933 cm-1处的吸收峰是C-H 伸缩振动引起的。1 616 cm-1和1 413 cm-1处的吸收峰是海藻酸钠结构中对称的-COONa 伸缩振动引起的,1 120,1 140,1 030 cm-1处的吸收峰是C-O-C 的弯曲振动峰。壳聚糖在1 651,1 593,1 419,1 378,1 155 cm-1处存在特征吸收峰。图2b 中AL 的红外光谱与海藻酸钠原料接近,但是吸附壳聚糖后ALC 的特征峰发生了较大变化,代表-OH 振动的峰强减弱,当海藻酸钠1 616 cm-1和1 413 cm-1处的特征峰减小时,说明壳聚糖NH3+和海藻酸钠COO-之间发生了静电相互作用,使得-COONa 特征峰基团减弱发生偏移[11]。以乳液为模板的海藻酸钠气凝胶(EA)未进行壳聚吸附时红外光谱就发生了较大变化,与ALC 峰形类似,说明海藻酸钠与乳清分离蛋白发生了静电相互作用。经过了壳聚糖吸附后EAC 的红外光谱中观察到了壳聚糖在1 575 cm-1和1 417 cm-1处的特征峰。

图2 样品红外光谱图Fig.2 FTIR spectra of samples
2.2 气凝胶形态
从图3中可以看出,以乳液为模板的颗粒不透明度更高,这是由于颗粒中乳液液滴分散的缘故。进行壳聚糖吸附之前AL 与EA 冻干前、后颗粒的形态差异不大,而冻干后ALC 的形态多为不规则颗粒,并且破碎较多,这可能是由于冻干过程中颗粒结构不致密,引起颗粒皱缩严重甚至破裂。冻干后,以乳液为模板的EAC 气凝胶颗粒形状接近球状,相比于未吸附壳聚糖的EA 形态差异不大。

图3 AL、ALC、EA 和EAC 气凝胶冻干前(a)和冻干后(b)照片Fig.3 The photo of the AL,ALC,EA,and EAC aerogel before (a) and after (b) freeze drying
通过扫描电子显微镜 (图4a 和4b) 观察发现,气凝胶在冷冻过程中发生了收缩,表面形成了皱缩,未进行壳聚糖吸附的AL 和EA 的气凝胶颗粒表面较为光滑,而进行了壳聚糖吸附的ALC 和EAC 气凝胶表面较为粗糙。ALC 相比于EAC 表面更为粗糙,并且观察到了更多的破裂颗粒,说明以乳液为模板层层自组装得到的气凝胶形态更为良好。表面未观察到植物乳杆菌,表明植物乳杆菌被包埋于气凝胶内部[12]。通过生物制样后观察气凝胶内部发现植物乳杆菌被海藻酸钠包裹(图4c)。

图4 AL、ALC、EA 和EAC 气凝胶冻干后电镜图Fig.4 The SEM images of AL,ALC,EA,and EAC after freeze drying
2.3 贮藏及消化稳定性
表1为冷冻干燥前、后ALC 和EAC 包埋的植物乳杆菌T17 的菌量,ALC 和EAC 冻干后菌株存活率分别为87.6%和92.3%,说明以乳液为模板包埋的植物乳杆菌的冻干稳定性相对较好。

表1 冷冻干燥前、后ALC 和EAC 中植物乳杆菌存活率Table 1 The livability of the Lactobacillus plantarum T17 in ALC and EAC before and after freeze drying
为了评价ALC 和EAC 植物乳杆菌气凝胶的储存稳定性,将其和冻干菌粉在4 ℃和-20 ℃条件下存储5 周,菌落总数变化如图5所示。随着存储时间延长,冻干菌粉中的菌落总数不断下降,4 ℃和-20 ℃条件下均下降明显。ALC 和EAC 包埋的植物乳杆菌菌量随着时间的延长几乎无变化,说明ALC 和EAC 包埋的植物乳杆菌具有较好的储存稳定性。徐鹏翔等[13]通过银杏蛋白和海藻酸钠制备的包埋植物乳杆菌的微胶囊在4 ℃储存30 d后菌落总数从8 lg(CFU/g)降低至3.31 lg(CFU/g)。姚泽晨等[14]以阿拉伯木聚糖和海藻酸钠制备的微胶囊包埋植物乳杆菌,在4 ℃和-20 ℃条件下7 周后菌落数分别下降了1.71 lg (CFU/g) 和1.2 lg(CFU/g)。

图5 植物乳杆菌T17 在ALC 和EAC 气凝胶以及菌粉中的储存稳定性Fig.5 The viability of the Lactobacillus plantarum T17 in ALC,EAC and powder
表2为乳液和非乳液模板的海藻酸钠-壳聚糖气凝胶中植物乳杆菌T17 经胃肠液消化后存活率,原菌液在胃液消化2 h 后存活率仅为56.8%,再经过4 h 肠液消化后未检测到存活的植物乳杆菌T17。ALC 和EAC 经过2 h 胃液消化后存活率都达到90%以上,说明以乳液为模板包埋植物乳杆菌T17 对于其胃液稳定性没有明显影响。单组分的海藻酸钠气凝胶对益生菌的包埋效果不佳,胃肠道稳定性不高。本研究中采用壳聚糖进行层层自组装后得到的气凝胶能够有效抵抗胃液的渗透,胃液稳定性较好。再经过4 h 肠液消化后ALC和EAC 中植物乳杆菌T17 的存活率分别为60%和53.1%。Gbassi 等[15]研究发现海藻酸钠颗粒外吸附一层乳清分离蛋白能够显著提升其包埋的植物乳杆菌胃肠道消化稳定性。通过层层自组装静电吸附壳聚糖到海藻酸钠颗粒上能够降低胃肠液对其渗透性,从而表现出较好的消化稳定性。
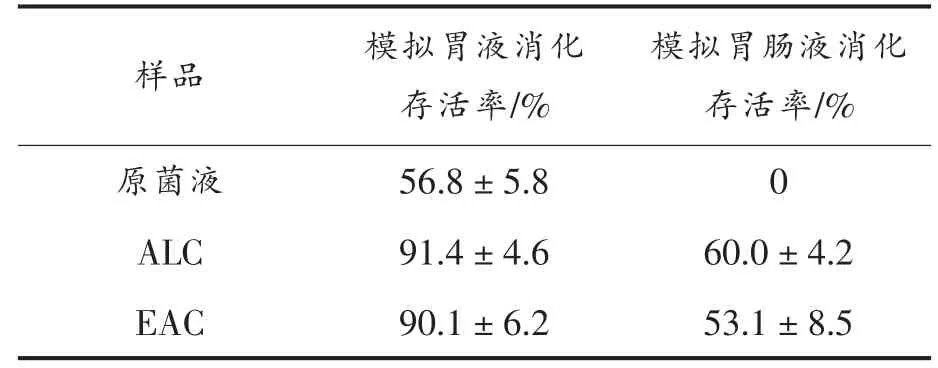
表2 ALC、EAC 和原菌液中植物乳杆菌经过模拟胃肠液消化后的存活率Table 2 The viability of the Lactobacillus plantarum T17 in ALC,EAC and original medium after simulated gastric and intestinal digestion
3 结论
本研究采用层层自组装的方法制备了以非乳液和乳液为模板的海藻酸钠/壳聚糖气凝胶颗粒包埋酸面团来源的植物乳杆菌。结果表明:以乳液为模板的颗粒中海藻酸钠与乳清分离蛋白之间发生了较强的静电相互作用,壳聚糖通过静电相互作用吸附在海藻酸钠颗粒上。乳液模板的海藻酸钠/壳聚糖气凝胶具有更好的冻干稳定性和储存稳定性。非乳液和乳液模板的气凝胶对植物乳杆菌的消化稳定性有显著提升,二者没有明显差异。
