藜麦体外模拟消化过程中酚类物质含量及抗氧化活性的变化
2021-09-09向卓亚邓俊琳朱永清林长彬杨开俊刘廷辉
向卓亚,邓俊琳,陈 建,朱永清,夏 陈*,林长彬,杨开俊,刘廷辉
(1 四川省农业科学院农产品加工研究所 成都 610066 2 四川甘孜州农业科学研究所 四川康定 626000)
藜麦原产于南美洲安第斯山区秘鲁和波利亚境内的“喀喀湖”沿岸,为一年生草本植物,其籽粒作为当地居民传统的主食,有着“粮食之母”之称,目前主要种植在秘鲁、智利、厄瓜多尔等高海拔地区[1],而我国山西、青海等地也已进行种植推广[2]。藜麦籽颜色多样,主要有红、白、黄、黑等,营养学研究发现颜色的差异与其内部的营养成分密切相关,即颜色越深其营养价值越高[3-4]。藜麦籽粒中蛋白质、必需氨基酸、膳食纤维、矿物质等营养成分高于一般类谷物[5],同时富含多酚类化合物和黄酮类化合物等活性物质,其中酚类化合物主要为酚酸(如没食子酸、阿魏酸)、槲皮素和芦丁,而常见谷物小麦、燕麦、黑麦中均不含黄酮类化合物[6-8]。多酚类化合物具有提高人体免疫力、抗癌、预防心血管病等功效;黄酮类能够降血糖、降血脂、抗病毒等,因此藜麦具有较高的营养保健价值[9]。
基于藜麦中多酚类化合物种类多且含量高,大量研究者对藜麦的生物活性进行了测定。Abderrahim 等[10]发现秘鲁有色藜麦中总多酚(1.23~3.24 mg/g)和总黄酮(0.47~2.55 mg/g)含量较高,表现出较强的抗氧化能力(119.8~335.9 mmol/kg)。Tang 等[11]发现藜麦中酚类化合物十分丰富,并且深色藜麦种子中酚类物质含量高且具有较强的抗氧化性。尽管目前藜麦被大量的研究证实具有较强的体外抗氧化性等生物活性,但还不能因此直接预测其对人体健康的影响。Rein 等[12]提出应当对其活性成分的生物可达性进行评估,因为活性成分只有经消化过程中各阶段的释放吸收才能发挥益处。目前对藜麦的研究多集中在优化活性成分的提取及体外生物活性的研究上,对于其体外模拟消化过程中活性物质的变化情况未有详细报道。本文以黑藜麦、白藜麦以及黄藜麦为研究对象,体外模拟消化研究各消化阶段(口腔、胃、小肠和大肠)藜麦消化液中多酚类与黄酮类活性成分的变化情况以及抗氧化活性,探讨藜麦对于人体的营养贡献,为不同品种藜麦加工副产物的综合利用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 试验材料 黑藜麦、红藜麦和黄藜麦:2018年9月采收于西藏自治区农牧科学院农业研究所现代农业示范园区,品系分别为30 号、ZL-06 和ZL-05。将藜麦粉碎后过60 目筛,分别密封于自封袋中,置干燥箱中备用。
1.1.2 试剂 甲酸、福林-酚试剂、三氯化铝、三氯化钙、乙醇、盐酸、氯化钾(分析纯),成都市科龙化工试剂厂(分析纯);乙腈、甲醇(色谱纯),美国Mreda 公司;水溶性VE、胃蛋白酶、α-淀粉酶、胰蛋白酶、胆汁、戊聚糖复合酶,sigma 公司;没食子酸、芦丁、阿魏酸、槲皮素(纯度98%)、2,2’-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐、菲洛嗪,北京索莱宝科技有限公司。
1.2 设备与仪器
FW-100 高速万能粉碎机,北京科伟永兴仪器有限公司;TD-4Z 型台式低速离心机,四川蜀科仪器有限公司;KQ-250DB 型数控超声波清洗器,昆山市超声仪器有限公司;Gentrifuge 5180R型冷冻干燥机,德国Eppendorf 公司;Synergy HTX型酶标仪,美国伯腾仪器有限公司;UV-6100 型紫外分光光度计,上海元析仪器有限公司;1260 型高效液相色谱仪,美国Agilent 公司。
1.3 试验方法
1.3.1 模拟体外消化试验 体外消化试验参照Qin 等[13]的方法略作修改,流程图见图1。
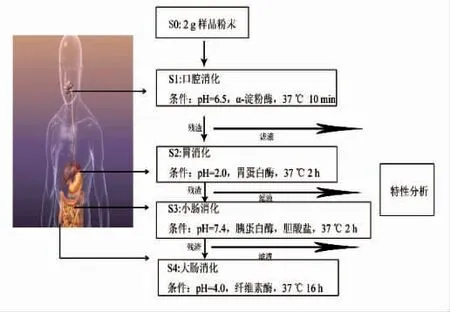
图1 体外模拟消化流程图Fig.1 Graphic representation of the simulated in vitro digestion procedure
称取2.0 g 藜麦粉末置于离心管中,加入20 mL 蒸馏水,用柠檬酸调节pH 值至6.5,加入1 mL α-淀粉酶溶液(酶活75 U/mL)后置于37 ℃水浴震荡10 min,8 000 r/min 离心10 min,将上清液(S1)倒出,备用。向残渣中加入20 mL 蒸馏水,用6 mol/L HCl 调节pH 值至=2,随后加入105.6 mg胃蛋白酶,置于37 ℃水浴震荡2 h 后8 000 r/min离心10 min,将上清液(S2)倒出,备用。继续向残渣中加入18 mL 蒸馏水,用2 mol/L NaHCO3调节pH 值至7.4,加入1 mL 胰蛋白酶(10 mg/mL)与1 mL 胆酸盐溶液(65 mg/mL),置于37 ℃水浴震荡2 h 后8 000 r/min 离心10 min,将上清液(S3)倒出,备用。向残渣中继续加入20 mL 蒸馏水,用6 mol/L HCl 调节pH 值至4.0,加入80 μL 纤维素酶,置37 ℃水浴震荡16 h 后8 000 r/min 离心10 min,将上清液(S4)倒出,备用。
1.3.2 藜麦中多酚和黄酮提取液[14]称取1 g 藜麦样品,加入8 mL 85%甲醇(含1%甲酸),40 ℃超声提取30 min,8 000 r/min 离心15 min,倒出上清液,备用。重复提取2 次,合并3 次提取液,定容25 mL。
1.3.3 总多酚的检测 总多酚测定采用Folin-Ciocalteu 法[15]。向20 μL 藜麦消化液或提取液中加入20 μL 福林酚试剂,摇匀后静置5 min,加入160 μL 5% Na2CO3溶液,室温下避光反应60 min,在波长765 nm 处测定吸光度。总多酚含量以没食子酸当量计算,单位为mg/g。
1.3.4 总黄酮的检测 总黄酮采用氯化铝-亚硝酸钠比色法[16]测定。向20 μL 藜麦消化液或提取液中加入80 μL 蒸馏水和10 μL 25% NaNO2,反应6 min 后加入10 μL 10%AlCl3·6H2O,反应5 min 后加入30 μL (1 mol/L)NaOH 和100 μL 蒸馏水,于波长510 nm 处测定吸光值。总黄酮含量以儿茶素当量计算,单位为mg/g。
1.3.5 抗氧化活性分析
1)ABTS+清除能力[17]将20 μL 藜麦消化液用蒸馏水稀释1 倍,加入160 μL ABTS 溶液混匀,避光反应6 min,于波长734 nm 处测定吸光值。以水溶性VE 质量浓度(μg/mL)为横坐标(x),吸光值为纵坐标(y),制作标准曲线,得到回归方程:y=12.895x+0.0363,R2=0.998,线性范围为0.0~19.5 μg/mL,测定结果以μg/mL 表示。
2)FRAP 抗氧化能力[18]取30 μL 藜麦消化液,加入140 μL 蒸馏水,20 μL 2.1675 mmol/L FeCl2,40 μL 5 mmol/L 菲洛嗪水溶液,混合避光反应20 min,于波长562 nm 处测定吸光值。以水溶性VE 质量浓度为横坐标 (x),吸光值为纵坐标(y),制作标准曲线,得到回归方程:y=0.0082x-0.0406,R2=0.999,线性范围为14.15~107.46 μg/mL,测定结果以μg/mL 表示。
1.3.6 多酚类化合物的分析[19]将3 mL 藜麦消化液冷冻干燥后加入1 mL 甲醇溶解,经0.22 μm微孔滤膜过滤后进样分析。色谱柱:Poroshell 120 PFP 柱(4.6 mm×100 mm,2.7 μm);DAD 检测器,检测波长:280,320 nm 和350 nm;柱温:30 ℃;流量:0.8 mL/min;进样量5 μL;流动相:0.1%的甲酸水溶液(A)+乙腈(B)。梯度洗脱:0~10 min,B 5%~10%;10~20 min,B 10%~20%;20~35 min,B 20%~40%。
标准品溶液制备:将没食子酸、阿魏酸、芦丁和槲皮素4 个标准品20 mg 分别用甲醇溶解并定容10 mL 作为标准品母液。利用梯度稀释法将母液配制成一系列浓度梯度的标准品溶液,备用。以没食子酸、阿魏酸、芦丁、槲皮素质量浓度(μg/mL)为横坐标(x),峰面积为纵坐标(y),绘制标准曲线,得线性方程如表1所示。样品中多酚单体的含量计算公式如下:多酚单体含量(μg/g)=待测液中多酚单体浓度×稀释倍数×样品定容体积/提取质量。

表1 没食子酸、阿魏酸、芦丁和槲皮素的标准曲线Table 1 The standard curve of gallic acid,ferulic acid,rutin,and quercetin
1.3.7 数据分析 所有试验重复3 次,试验数据以平均值±标准差表示。采用SPSS 17.0 软件进行数据分析,通过单因素方差分析(ANOVA)进行显著性分析,P<0.05 为差异显著。
2 结果与分析
2.1 总多酚含量的变化
藜麦富含多酚类物质和黄酮类物质,其良好的生理功能与之密切有关。利用模拟体外消化模型来评估消化过程中总多酚和总黄酮的释放情况,能间接反映藜麦的健康效应。图2显示体外模拟消化前、后总多酚的释放量。不同藜麦总多酚释放量大致具有相同的趋势,即经4 阶段消化后,藜麦中总多酚均被显著释放,大致为口腔>小肠≥胃>大肠。其中,经口腔消化后,黒藜麦、红藜麦和黄藜麦总多酚释放量分别为4.16,3.82 mg/g 和2.67 mg/g。口腔消化时间较短,而此阶段总多酚的释放量均较大,这与目前较多研究发现经口腔消化后仅有小部分多酚类物质被释放的结论不一致[20-21]。然而,Zheng 等[22]同样发现山楂中总酚类物质和黄酮类物质在模拟口腔消化过程中释放量超过65%。这些活性成分释放量的差异可能是由于生物活性和性质的不同所引起的。随着消化的继续,模拟胃消化后总多酚释放量分别为1.40,1.01 mg/g 和0.60 mg/g,均显著低于口腔中的释放量。在低pH 值环境中和胃蛋白酶的作用下能够释放一些与碳水化合物结合的酚类物质,从而使这些活性物质更具生物活性,然而除黑藜麦外,胃消化后总多酚释放量均显著低于小肠释放量。这样的结果与Bohn 等[23]相似,他们发现某些酚类物质可能在胃液中损失,导致许多酚类化合物在小肠消化过程中释放[24]。经大肠消化后,由于大肠中普遍存在的肠道微生物所产生的酶进一步催化多酚类物质释放[25],因此仍有少量的多酚类物质被释放。此外,不同品种藜麦消化略有差异,黑藜麦各消化阶段(除大肠消化液外)总多酚释放量显著高于黄藜麦和红藜麦,这是由于不同基因型的藜麦(黑色、红色和黄色)具有不同形式的酚类化合物,且总多酚含量与种子的颜色有关,即颜色越深,总多酚含量越高且抗氧化活性将更高[11]。
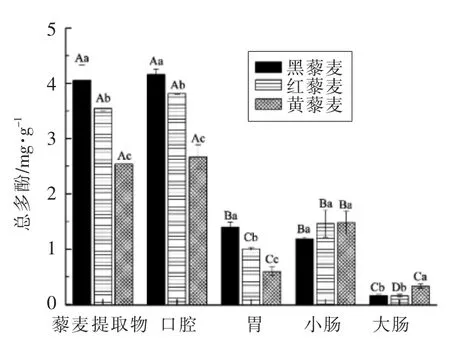
图2 藜麦体外消化过程中总多酚含量的变化Fig.2 Changes of total phenolic content in quinoa during in vitro digestion
2.2 总黄酮含量的变化
如图3所示,藜麦模拟体外消化过程中总黄酮释放量的变化趋势与总多酚相似。黒藜麦、红藜麦和黄藜麦中总黄酮含量分别为2.61,2.95 mg/g和2.08 mg/g,模拟消化后总黄酮被显著释放,释放量约为口腔>胃≥小肠≥大肠。经口腔消化后,黒藜麦、红藜麦和黄藜麦释放量分别为0.82,0.73 mg/g 和0.33 mg/g,除黄藜麦外,总黄酮的释放均达到藜麦提取物的30%。此外,仅黒藜麦经胃消化后总黄酮量释放量显著高于小肠,其余均无显著差异,这可能是不同品种藜麦的活性成分的生物活性差异造成的;而小肠消化后总黄酮释放量降低的原因可能是藜麦中黄酮类化合物在碱性条件下不稳定,较容易降解为其它小分子化合物[26]。小肠消化液中总黄酮释放量与大肠并无显著差异,而随着消化的继续整体呈下降趋势,这与Qin 等[13]的研究结果一致。

图3 藜麦体外消化过程中总黄酮含量的变化Fig.3 Changes of the total flavonoids content in quinoa during in vitro digestion
2.3 抗氧化性的变化
为研究藜麦消化过程中可溶性组分的抗氧化能力,建立了2 种抗氧化模型,即ABTS+自由基清除和FRAP 抗氧化能力进行分析。从图4a 可以看出,不同品种藜麦间抗氧化能力存在一定差异,其中黑藜麦在各消化阶段均表现出较高的ABTS+自由基清除能力,其次为黄藜麦。除小肠消化液外,藜麦消化液抗氧化能力表现出减弱的趋势,其ABTS+自由基的清除能力表现为口腔>小肠>胃>大肠。这与大量体外消化试验发现胃和小肠阶段抗氧化能力最高的结论相反,而在苹果或山楂果实的体外消化试验研究中同样发现其抗氧化化合物主要在口腔释放[22,27]。这可能是因为食物中酚类化合物以不同形式(游离酚或结合酚)存在,而藜麦中游离酚在口腔消化过程中随即溶出而释放,结合酚则经酶的作用后释放,因而口腔具有较高的抗氧化活性[28]。此外,藜麦中丰富的多酚类化合物只有经肠内酶水解才能被消化吸收,这使得小肠消化液同样表现出较强的抗氧化能力[29]。由于藜麦中80%的多酚类化合物在体外仍具有生物活性[30],因此藜麦在整个体外消化过程中均表现出较高抗氧化能力。
藜麦消化液对FRAP 抗氧化能力与ABTS+自由基清除能力大致保持一致,见图4b。消化液中酚类和黄酮类化合物等物质能螯合机体内金属离子,抑制自由基酶活性[31]。黑藜麦同样表现出较高的FRAP 抗氧化能力,然而,3 种藜麦随着消化的继续,FRAP 抗氧化能力均出现减弱的趋势,即口腔>小肠>胃>大肠。抗氧化试验表明藜麦在消化过程中抗氧化活性成分主要在模拟口腔和小肠中释放,少量在模拟胃和大肠消化过程中释放;相比之下,水果和多数谷类中抗氧化功能成分则主要在胃和小肠消化过程中释放[20,32]。
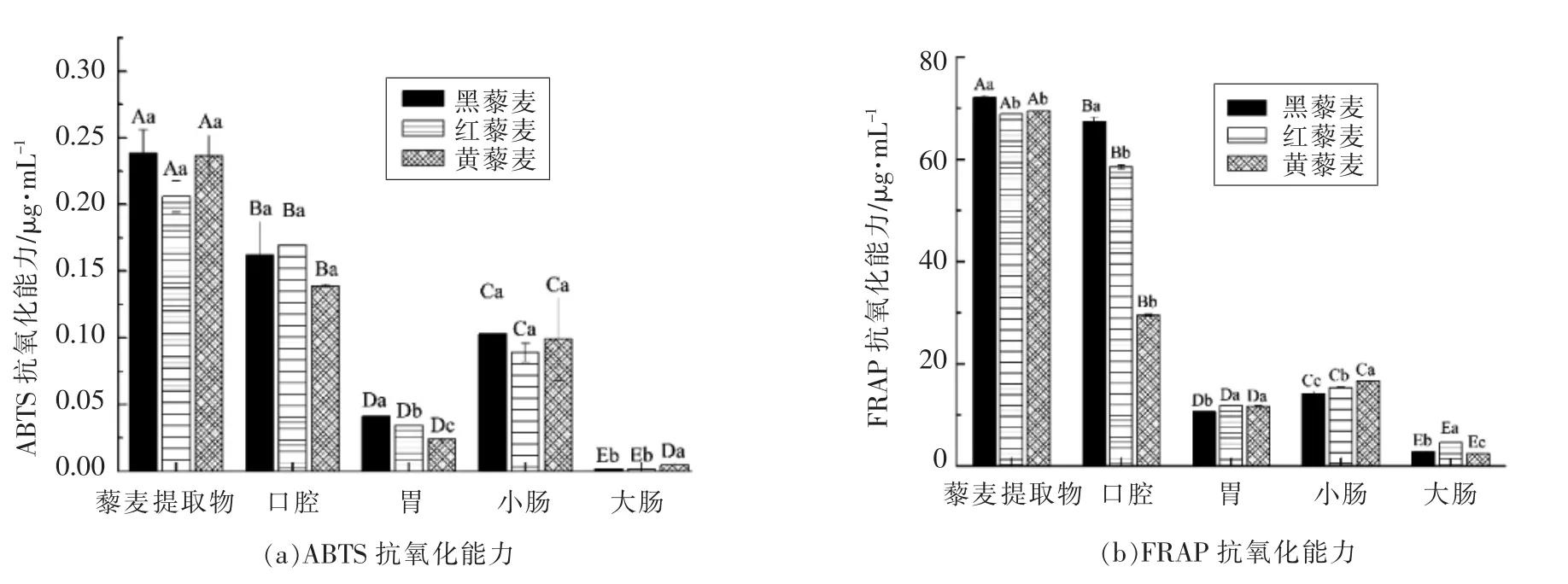
图4 藜麦体外消化过程中抗氧化能力的变化Fig.4 The antioxidant power of quinoa during in vitro digestion
2.4 主要酚类化合物含量变化
藜麦中酚类化合物种类繁多,为进一步明确具体的酚类化合物在消化过程中含量的变化情况,本研究选取藜麦中具有代表性的4 种酚类化合物,即没食子酸、阿魏酸、芦丁和槲皮素进行体外消化跟踪研究,结果见表2。在藜麦提取物中未检测到没食子酸、槲皮素,而检测到较高含量的芦丁和少量的阿魏酸,这是由于藜麦中多酚类化合物以结合型为主,其常与木质素或多肽等结合,无法通过普通溶剂提取出来,且芦丁溶于乙醇,因此检测到较高含量的芦丁[33]。藜麦经体外模拟消化后,4 种酚类化合物均被显著释放,释放量约为口腔>胃>小肠>大肠。4 种酚类化合物首先在口腔消化后被显著释放,这与总多酚含量变化情况相一致,其中芦丁释放量高于没食子酸、阿魏酸和槲皮素。经胃消化后,没食子酸、阿魏酸、芦丁和槲皮素均显著降低,这与李俶等[34]研究发现各酚酸类化合物含量在模拟胃液中无显著变化的结论相反。而Kroon 等[35]发现小麦种子在胃和小肠消化后仅有少量的阿魏酸(2.6%)释放,这说明不同食品体系中活性成分具有不同的生物特性。藜麦经小肠消化后,没食子酸和阿魏酸继续释放,而释放量显著低于口腔和胃;黄藜麦中槲皮素也被显著释放,释放量达到13.84 μg/g,这是由于肠道消化酶能够促进复杂的食品体系中多酚类化合物从小肠中进一步释放[36]。消化末期,在大肠消化液中仅检测到少量的阿魏酸和没食子酸。大多的研究发现谷类中结合态多酚占总多酚的比例超过90%[37],藜麦中高比例的结合型多酚在体外经酶水解、酸水解等方式破坏酯键、醚键等得以释放[33],使其表现出较高的生物活性(抗氧化性),因此消化后具有较高的保健价值。
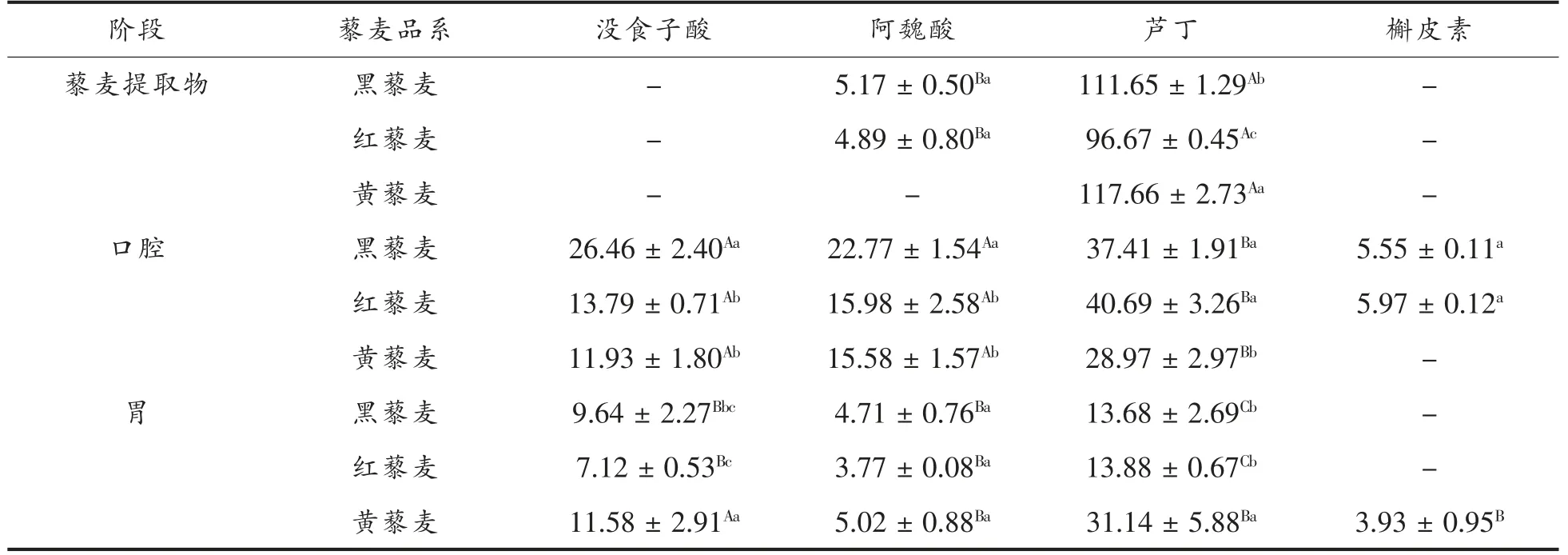
表2 藜麦模拟体外消化过程中主要多酚类化合物组分的含量(μg/g)Table 2 The concentrations of the major phenolic compounds in quinoa during simulated in vitro digestion (μg/g)
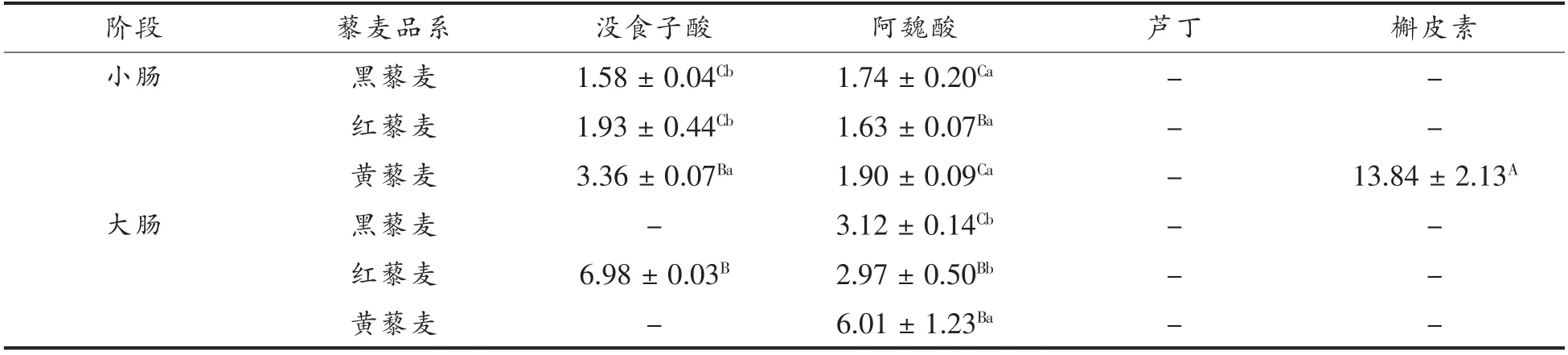
(续表2)
2.5 总多酚和总黄酮与抗氧化性的相关性分析
表3列出体外消化过程中总多酚和总黄酮含量的变化与藜麦抗氧化活性 (ABTS+和FRAP)之间的相关性。总多酚和总黄酮的释放量与其抗氧化性呈显著正相关,黄藜麦中总多酚与FRAP 的相关性虽不显著,但相关系数高达0.7。较强的相关性和较高的相关系数,说明藜麦经体外消化释放的多酚类和黄酮类物质对其表现出的抗氧化性起重要作用。这样的结果与Zheng 等[22]发现在体外模拟消化过程中山梨红和大津杏果实中释放的总多酚和总黄酮与抗氧化性呈显著正相关相一致。
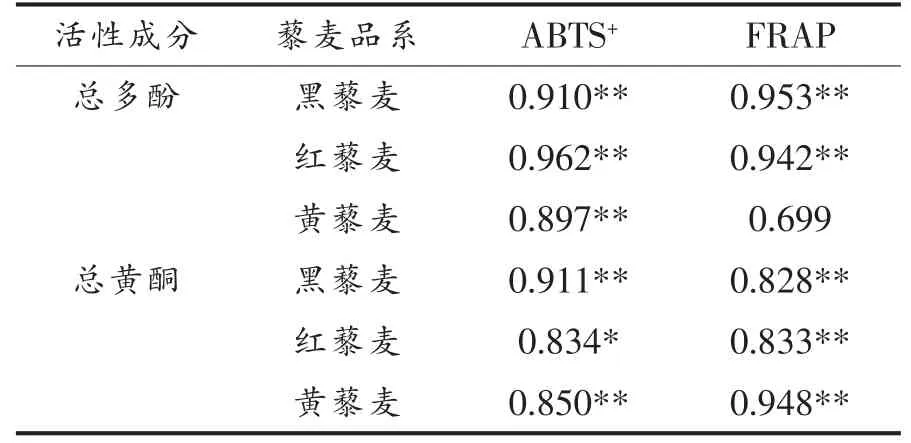
表3 藜麦多酚和黄酮与抗氧化性相关性分析Table 3 Pearson's correlation coefficient analysis between total released phenolic content,total released flavonoid content and antioxidant power from quinoa
3 结论
3 种藜麦富含多酚类物质和黄酮类物质,将其体外消化后显著释放出多酚类和黄酮类物质并表现出较高的抗氧化性。3 种藜麦经口腔消化后释放出大量的多酚类物质和黄酮类物质,其次为小肠,在胃和大肠中少量释放,并且释放量与藜麦抗氧化性呈显著正相关。通过对几类多酚类化合物进行跟踪,发现芦丁在口腔和胃中持续显著释放,没食子酸在口腔、胃、小肠中持续释放,阿魏酸在口腔、胃、小肠和大肠中持续释放。不同品系的藜麦中槲皮素释放量差异较大。综上所述,体外模拟消化能较好地评价藜麦中活性成分的生物利用度。基于藜麦品系中各活性成分的差异,未来可系统研究不同品系藜麦中多酚化合物及黄酮类物质的代谢路径及其活性成分多酚单体。
